抗酸染色液(改良Kinyoun冷染法)说明书
- 格式:pdf
- 大小:85.34 KB
- 文档页数:2

夹层杯抗酸染色制片法概要一:标本的预处理:消化和离心1.将标本至于夹层杯中加消化液消化至液体清亮(2~5分钟可灭活细菌)(若是其它容器取痰的,可小心的在痰上加些许消化液,待痰不再粘附其上后转入夹层杯)(夹层杯可装液体不超过杯身三分之二)(非痰类标本亦须加适量消化液消化)。
2.将本杯置于离心机内对称平衡放稳,以4500转/分钟转速离心5分钟,弃去液体(轻快的倒掉),放在干片机内烘烤(干片机提前开启至60度)。
二:染色:初染和洗脱和复染1.加A液在60度温度下染色5分钟。
2.B液脱色(尽量将红色脱净)。
3.C液复染一分钟。
(每次弃去染色液后需以缓慢小水流沿杯壁将杯中剩余液体洗清沥干)。
(加染液液量以可覆盖膜片为适量)三:制片:取片和阅片1.将染色后的片子烘干。
2.用取片针顶起杯底纳米膜片,用镊子夹出,轻轻印干水分,用中性胶倒封于玻片上,弃去保护膜。
(水分将会影响胶水对膜片的粘附)3.阅片。
(可利用“红十字”找寻视野)四:注意事项1.膜片上的细菌的保护:本制片法的原理为通过离心沉降并烘烤将目标菌粘附在膜片上后进行染色,在操作过程中必须避免直接冲刷、液体剧烈振荡、大力印擦等而将膜上已粘附的细菌冲走,这些失误会严重影响阳性率。
2.各标本间的交叉污染:标记混淆、杯中液体互溅、液体转移等将会使结果严重不可靠。
3.脱色的程度:脱色不完全将导致膜上非抗酸菌或其它物质也呈现红色,脱色过久过重会影响抗酸杆菌所着色,二者都将影响后续镜检。
4.B液:其重要成分为酒精盐酸,易挥发,用完务必盖好盖子。
5.操作时间段的把握:请有效利用机器与时间间隔,避免标本堆积。

抗酸染色液使用说明抗酸染色液是一种常用于细胞和组织样本染色的试剂,可以用于观察细胞核和染色体的形态与分布。
它通过特殊的染色剂和酸性条件,将细胞核和染色体显色出来,使其能够被显微镜观察和分析。
以下是抗酸染色液的使用说明。
1.准备工作(1)检查抗酸染色液的保存条件和有效期,确保试剂的质量良好。
(2)清洁工作台,并准备好所需的实验器皿和试管。
(3)准备样本,如细胞悬液或固定的组织切片。
2.染色液配制(1)根据试剂的说明书,准备抗酸染色液的工作浓度。
通常情况下,抗酸染色液是浓缩的,需要根据实验的要求进行适当的稀释。
(2)将适量的抗酸染色液加入到一支干净的试管或玻璃瓶中。
3.样本处理(1)如果使用细胞悬液,可以直接将细胞悬液加入到试管中。
如果使用组织切片,需要先将组织切片放置在适量的生理盐水或缓冲液中,洗去固定液和脱水剂,并将其转移到试管中。
(2)确保样本充分润湿,避免气泡和样本堆积。
4.染色过程(1)将试管放置在恒温水浴中,设置适当的温度和时间。
一般来说,使用42°C的水浴,对细胞进行染色12-15分钟,对组织切片进行染色15-20分钟。
(2)在染色过程中,每隔一段时间(如2-3分钟)轻轻摇动试管,以确保样本均匀接触染色液。
5.染色液去除(1)在染色结束后,将试管从水浴中取出,并将液体倒掉。
(2)用生理盐水或缓冲液轻轻冲洗试管中的样本,去除多余的染色液。
(3)重复冲洗2-3次,确保样本的清洁。
6.样本固定(1)根据实验要求,将样本固定在载玻片上。
固定方法可以是使用适当的固定剂,如甲醛或乙醛溶液,将样本浸泡或喷洒在固定剂中,然后将其转移到载玻片上。
(2)对于组织切片,可以使用热解固定的方法,将载玻片和组织切片一起加热。
7.盖片和观察(1)在固定样本上滴加一滴适当的复盖剂。
(2)将一张玻璃盖片轻轻压在载玻片上,使其紧密贴合。
(3)将载玻片放置在显微镜上,通过目镜和物镜观察样本。
注意事项:-在染色过程中,保持试管的温度和时间的一致性,以保证染色效果的稳定性和准确性。

抗酸染色液数量:85套技术指标要求:1、每套包括:初染液(石炭酸复红液):500ml*1瓶复染液(0.06%亚甲兰):500ml*1瓶脱色液(5%盐酸乙醇):500ml*1瓶油镜油:20ml*1瓶2、石炭酸复红液要求:a)碱性复红(分子式C19H18NCL):必须使用最低含量超过88%的生物染色剂b)石炭酸(分子式C6H6O):必须使用熔点为40.5℃的分析纯试剂c)配置的染色液必须无染料沉渣,在有效期内不产生沉渣d)石炭酸复红染液的最大吸收峰的吸光度是0.35±0.5,测定波长为545nm3、0.06%亚甲兰要求:a)碱性复红(分子式C16H18CLN3S):必须使用最低含量超过82%的生物染色剂b)配置的染色液必须无染料沉渣,在有效期内不产生沉渣4、染色法:热染法5、包装要求:硬质塑料瓶包装,每瓶配有滴盖6、有效期:不少于2年,可分次供货改良罗氏培养基数量:10000支技术指标要求:1、培养管:无裂纹;2、分枝杆菌培养基容量:7ml±0.5ml;3、培养基:表面无裂纹、气泡或斑点;4、污染试验:培养基放入35℃孵育箱内孵育24~48小时,应无细菌生长;5、生长试验:接种H37Ra结核分枝杆菌(25177)至21天可见菌落生长;6、稳定性:在产品有效期结束当日,培养基仍应符合无菌的使用性能要求。
改良罗氏药敏培养基(比例法)数量:700套(16支/套)技术指标要求:1、每套药敏培养基包括:对照管 2支;利福平2支;异烟肼2支;链霉素2支;乙胺丁醇2支;卡那霉素2支;氧氟沙星2支;PNB 1支;TCH 1支2、培养管:无裂纹;3、分枝杆菌培养基容量:7ml±0.5ml;4、培养基:表面无裂纹、气泡或斑点;5、污染试验:培养基放入35℃孵育箱内孵育24~48小时,应无细菌生长;6、生长试验:接种H37Ra结核分枝杆菌(25177)至21天可见菌落生长;7、稳定性:在产品有效期结束当日,培养基仍应符合无菌的使用性能要求。

抗酸染色法实验报告抗酸染色法实验报告引言:细胞与组织的染色是生物学和医学研究中常用的技术手段之一。
抗酸染色法是一种常见的细胞和组织染色方法,其原理是在酸性条件下,利用染色剂与细胞或组织中的特定成分发生化学反应,从而使其显色。
本实验旨在通过抗酸染色法观察细胞和组织的结构,以及研究其功能和特性。
实验材料与方法:实验所需材料包括:细胞或组织样本、酸性染色剂、显微镜、玻璃片、显微镜载玻片、显微镜盖玻片等。
实验步骤如下:1. 准备细胞或组织样本:选择合适的细胞或组织样本,如植物叶片、动物组织切片等。
将样本切割成适当大小,并保持其新鲜。
2. 固定样本:将样本浸泡在适当的固定液中,如福尔马林或乙醛溶液中,以保持其形态和结构。
3. 抗酸处理:将固定的样本经过脱水和透明化处理后,放入抗酸剂溶液中浸泡一段时间。
抗酸剂的选择应根据实验目的和样本特性来确定。
4. 染色处理:将抗酸处理后的样本放入酸性染色剂溶液中,浸泡一定时间,使其与样本中的特定成分发生反应。
5. 清洗与固定:将染色后的样本用去离子水或适当的缓冲液进行清洗,以去除多余的染色剂。
然后,用适当的固定剂固定样本。
6. 制片与观察:将固定的样本切割成薄片,并放置在显微镜载玻片上。
然后,用显微镜盖玻片覆盖在样本上,以便观察。
实验结果与讨论:通过抗酸染色法,我们成功地染色了细胞或组织样本,并观察到了其结构和特性。
染色后的样本在显微镜下呈现出明亮的颜色,使我们能够清晰地观察到细胞和组织的细节。
在染色过程中,染色剂与样本中的特定成分发生反应,从而使其显色。
不同的染色剂对不同的细胞和组织成分有选择性,因此可以通过不同的染色剂来观察不同的结构和功能。
例如,我们可以使用伊红染色剂来染色细胞核,使其呈现红色。
细胞核是细胞的控制中心,其中包含着遗传物质DNA。
通过观察细胞核的形态和数量,我们可以了解细胞的增殖能力和功能状态。
此外,我们还可以使用嗜酸性染色剂来染色细胞质中的酸性成分,如染色体和核糖体。

(一)试剂的配制1 .石炭酸复红染液:(1 )储存液①碱性复红液:碱性复红8g,加95% 乙醇至100ml ,充分振荡使复红溶解。
碱性复红乙醇储存液应避光保存,为保证染液的质量,建议储存液保存不超过6 个月。
②5% 石炭酸水溶液:40~50℃水浴加热石炭酸使之融解,取液态石炭酸5g 溶于90ml热蒸馏水中,待溶液冷却至室温时,补充蒸馏水至100ml 。
(2 )石炭酸复红工作液:经定性滤纸过滤的碱性复红储存液10ml与5%石炭酸水溶液90ml 充分振荡、混合均匀后,用定性滤纸过滤。
碱性复红(或称为碱性品红,basic fuchsin,or pararosaniline chloride,分子式为C 19 H18NCl)用于AFB 染色时,必须使用染料最低含量超过88% 的生物染色剂,合格产品一般在试剂包装上注明相应含量。
如果标注的染料含量低于88% ,则在配制时需调整称取量。
例如,染料含量标注为75% 的产品,配制100ml 储存液时实际的称取量应是8/0.75=10.7g。
石炭酸(苯酚,phenol ,分子式为C 6 H6 O):应使用熔点为40.5 ℃的分析纯试剂。
2 .5%盐酸乙醇脱色液:35% 浓盐酸5ml 与95% 乙醇95ml混合。
3 .亚甲蓝复染液:(1 )储存液:亚甲蓝0.3g 溶于95% 乙醇50ml中,完全溶解后加蒸馏水至终体积100ml 。
(2 )亚甲蓝复染液:以蒸馏水5 倍稀释0.3%亚甲蓝储存液,经充分振荡、混合均匀后,亚甲蓝的终浓度为0.06% ,使用定性滤纸过滤,即得亚甲蓝染液。
亚甲蓝(methylene blue chloride,or methylthionine chloride ,分子式为C 16 H18 ClN3S):染色时必须使用染料含量超过82% 的生物染色剂。
4 .萋-尼氏染色步骤:1. 涂片自然干燥后,放置在染色架上,玻片间距保持10mm 以上的距离;火焰固定(在5秒钟内将玻片置于火焰上烤4 次)。

抗酸染色液冷染法一、引言抗酸染色液冷染法是一种常用的组织学染色技术,用于观察细胞和组织的结构和组成。
本文将介绍抗酸染色液冷染法的原理、步骤和应用。
二、原理抗酸染色液冷染法是一种无需加热的染色方法,其原理是利用染色液中的酸性成分与细胞或组织中的碱性成分发生化学反应,形成颜色的沉淀物。
抗酸染色液中的染料具有亲和力,能够选择性地与特定的细胞或组织成分结合,从而使其显色。
三、步骤1. 取得待染细胞或组织的标本。
2. 用生理盐水或磷酸盐缓冲液洗涤标本,去除多余的组织液和血液。
3. 用抗酸染色液将标本浸泡,一般需要数分钟至数十分钟的时间,具体时间根据染色物质的性质和染色结果而定。
4. 将标本用蒸馏水洗涤,去除多余的染色液。
5. 用酒精脱水,逐渐将标本转为透明状态。
6. 用透明剂浸泡标本,使其变得更加透明。
7. 将标本置于显微镜下观察,可以使用油浸镜头进行高倍观察。
四、应用抗酸染色液冷染法广泛应用于组织学和病理学的研究中,可用于观察细胞的形态、结构和功能。
具体应用包括:1. 组织切片染色:可以用于观察组织器官中不同类型的细胞和细胞组织的排列和结构。
2. 细胞染色:可以用于观察细胞内的细胞器、染色质和细胞膜等结构。
3. 病理学研究:可以用于观察疾病引起的组织和细胞变化,帮助诊断和治疗疾病。
五、优缺点抗酸染色液冷染法相比于其他染色方法具有以下优点:1. 无需加热:相比于热染色方法,冷染法更加简便和快速。
2. 显色效果好:抗酸染色液具有较好的亲和力,可以选择性地染色目标结构。
3. 适用范围广:可以应用于多种类型的细胞和组织,具有较高的适应性。
4. 结果稳定:抗酸染色液染色结果相对稳定,不易褪色。
然而,抗酸染色液冷染法也存在一些缺点:1. 需要经验:染色条件和时间需要经验积累,染色结果可能受到操作者技术水平的影响。
2. 不能应用于活体标本:冷染法需要对标本进行固定和处理,无法直接应用于活体标本的观察。
六、总结抗酸染色液冷染法是一种常用的组织学染色技术,具有简便、快速和选择性染色等优点。

改良萋-尼抗酸染色液
Modified Ziehl-Neelsen Stain
产品编码产品名称规格
GC082917改良萋-尼抗酸染色液100ml,250ml
改良萋-尼抗酸染色液用途:
供抗酸性细菌的染色,包括弱抗酸菌的染色。
改良萋-尼抗酸染色液原理:
由于抗酸性细菌具有抗酸性,在被含石炭酸的复红液染色后结合牢固,不易被酸性脱色液脱色,最终染色为红色。
而非抗酸性细菌在被含石炭酸的复红液染色后结合不牢,容易被酸性脱色液脱色,经复染后最终显微镜下显示为蓝色或无色。
改良萋-尼抗酸染色液使用方法:
1.将标本直接制成涂片,自然干燥或火焰固定;
2.滴加初染液(A液)覆盖涂片染色5~8分钟,水洗,溘去多余的水;
3.滴加脱色液(B液)覆盖涂片,脱色,脱掉涂片上的红色(通常5~10秒),隐约残留的红色应忽略不计,脱色时间的长短因涂片的厚薄而不同,防止脱色过度。
水洗,溘去多余的水;
4.滴加对比复染液(C液)覆盖涂片染色,染色20~30秒,水洗,溘去多余的水;
5.晾干或轻轻烤干后后,显微镜下油镜检查,背景淡蓝色或无色。
适用仪器:
光学显微镜
样本要求:
选择能反映活动病程有临床价值的标本或培养物。
实验结果:
阳性为光学显微镜油镜(10×100)下见有红色杆状菌,反之为阴性。


实验九-抗酸染色教程文件一、实验目的:通过本实验,掌握抗酸染色技术的概念、方法、原理和操作步骤,巩固和提高学生的实验操作和技能,培养学生认真细致的实验态度,增强实验室安全意识。
二、实验原理:抗酸染色技术是现代生物学和医学科学的基础之一,是经典的细胞学染色技术之一。
抗酸染色技术是利用酸及其盐类的特殊作用,使染色剂能与细胞核染色质、特定细胞器和其他细胞成分结合,从而使其在显微镜下形成自然而美观的图像。
抗酸染色技术是病理学诊断中常用的技术之一,用于检测病理细胞变异和细胞形态学及分子生物学研究中。
三、实验材料及方法:1、实验所需试剂:1)透明丙酮(Xylene);2)96%乙醇;3)50%酸性酒精(HCl in 95% ethanol);4)1%枚举胶液(Mayer's hematoxylin);5)1%酸性酒红溶液(0.05% acid fuchsin in distilled water);8)85%甲醛;1)显微镜;2)蜡刀;3)染色架;4)玻片;5)移液器;6)玻璃棒。
3、实验步骤:1)石蜡切片的脱脂和再脱蜡:a.将石蜡切片放入透明丙酮中,浸泡10~15分钟;b.将切片转移到96%乙醇溶液中,浸泡2~3分钟;d.将切片放入50%酸性酒精中浸泡2~3分钟,用水漂洗3~4次,每次时间30~60秒;2)抗酸染色:b.用水漂洗3~4次,每次时间30~60秒,直至溶液清澈无色;g.将切片置于盛有1:1比例的绝对酒精和85%甲醛中,浸泡5~10分钟,直至细胞没有氧化痕迹,将切片转移到正确的显微镜载玻片上并拍照。
四、实验结果:经过抗酸染色后,在显微镜下,细胞核染色质和细胞质中的特定结构都能显现出来,从而可以形成美观而自然的图像。
通过比较观察和分析不同样本组织的抗酸染色图像,可以了解细胞结构和组分的形态学变化,进而研究细胞功能和病理生理。
五、注意事项:1、操作时应注意安全,化学试剂避免直接接触皮肤和吸入粉尘,切片时应戴手套;2、试剂的浓度和配制方式必须严格按照操作说明书执行,不可随意更改;3、操作中应注意卫生,保持实验室清洁;4、实验结束后应及时处理废弃物,如有需要可循环利用;5、实验室毒性、易燃、易爆等安全标识牌应贴在显眼的地方,以保证实验室安全。

抗酸染色(冷染法)标准操作规程01原理本试剂盒采用 WHO 推荐的 Ziehl-Neelsen 法分枝杆菌的细胞壁内含有大量的脂质,包围在肽聚糖的外面,所以分枝杆菌一般不易着色,要经过加热和延长染色时间来促使其着色。
但分枝杆菌中的分枝菌酸与染料结合后,就很难被酸性脱色剂脱色。
齐-尼氏抗酸染色法是在加热条件下使分枝菌酸与石炭酸复红牢固结合成复合物,用盐酸酒精处理也不脱色。
当再加碱性美兰复染后,分枝杆菌仍然为红色,而其他细菌及背景中的物质为蓝色。
02试剂石碳酸复红染液、酸性酒精溶液、亚甲蓝溶液03方法1. 涂片:参见各标本操作程序涂片,涂片后在室温下自然干燥,也可在酒精灯上略加温,使之迅速干燥,但勿靠近火焰2. 固定:常用高温进行固定。
即手持载玻片一端,标本面朝上,在灯的火焰外侧快速来回移动 3 ~ 4 次,共约 3 ~ 4 秒。
要求玻片温度不超过 60℃,以玻片背面触及手背皮肤不觉过烫为宜,放置待冷后染色3. 染色3.1 滴加石碳酸复红染液盖满玻片,染色 10 分钟或更久,无需加温3.2 流水自玻片一端轻缓冲洗,冲去染色液,沥去标本上剩余的水3.3 滴加酸性酒精溶液盖满玻片,脱色 1 ~ 2 分钟,如有必要,需流水冲去溶液后,再次脱色至痰膜无可视红色为止3.4 流水自玻片一端轻缓冲洗,冲去染色液,沥去标本上剩余的水3.5 滴加亚甲蓝溶液,染色 30 秒钟3.6 流水自玻片一端轻缓冲洗,冲去染色液,沥去标本上剩余的水,待玻片干燥后镜检3.7 一张染色合格的玻片,痰膜肉眼观察为亮蓝色,无红色斑04结果判定1. 干燥后油镜观察 300 个视野(观察时间不少于 4 min),抗酸性细菌呈红色,其它细菌或细胞呈蓝色2. 报告方式2.1 未找到抗酸杆菌2.2 找到抗酸杆菌±:可疑,发现抗酸杆菌 1 ~ 2 条 / 300 视野2.3 找到抗酸杆菌 1+:发现抗酸杆菌 3 ~ 9 条 / 100 视野2.4 找到抗酸杆菌 2+:发现抗酸杆菌 1 ~ 9 条 / 10 视野2.5 找到抗酸杆菌 3+: 发现抗酸杆菌 1 ~ 9 条 / 1 视野2.6 找到抗酸杆菌 4+:发现抗酸杆菌≥ 10 条 / 1 视野05质量控制每次用卡介苗做阳性对照大肠埃希菌 ATCC25922 做阴性对照06注意事项1. 每一玻片只能涂一份标本,以防脱落混淆;2. 脱色时间需根据涂片厚薄而定,厚片可适当延长,以无红色脱出为止;3. 冬季室温过低时,染色时间要适当延长;4. 有时同一个抗菌体上红色深浅也有不同,观察时应注意;5. 每次试剂用完后,请迅速盖好,以免挥发,储存时应避免高、低温及阳光照射;6. 在涂抹痰标本时,严禁对玻片加热;7. 染色时勿使玻片上的染液干燥。
微生物检验实验室抗酸染色标准操作规程1.目的规范抗酸染色标准操作规程。
2.原理抗酸菌具有耐受酸性介质脱色的生物状,此类细菌在石碳酸(苯酚)的协同作用下,被复红染色剂着色,能够耐受酸性酒精脱色,显微镜观察时保持紫色红色;而其他脱落细胞或标本中的非抗酸菌被酸性酒精脱色,可被复染剂亚甲蓝染为蓝色。
3.试剂3.1 Kinyoun溶液。
碱性品红40g 乙醇(95%)200ml 石碳酸80ml 蒸馏水1000ml3.2 Gabett溶液亚甲蓝10g 无水酒精300ml硫酸200ml 蒸馏水500ml4.质控每天用龟分支杆菌ATCC93326做阳性对照,大肠埃希菌ATCC25922做阴性对照。
5.操作步骤5.1 初染涂片上滴加石碳酸复红液,用火焰加热至产生蒸汽,约5分钟,水洗。
5.2 脱色第二液脱色约1分钟,轻轻摇动玻片,无红色脱色或略呈粉红色时为止,水洗。
5.4 复染第三液复染30秒,水洗。
自然干燥后镜检。
6.结果判断抗酸杆菌呈红色。
7.注意事项7.1 每张玻片只能涂一份标本,禁止将2份或2份以上的标本涂在同一张载玻片上。
7.2 为防止交叉感染,标本应先高压灭菌后再涂片染色。
7.3 在涂抹痰标本时,严禁对载玻片进行加热。
7.4 菌龄为18~24小时为佳。
8.临床意义只针对用于结核病、麻风病等的细菌检查,初步诊断。
9.安全防护措施9.1操作人员要戴口罩、手套和穿隔离衣。
9.2涂片制备痰标本要高压灭菌或者在标本中加入等量0.5%“84”消毒液(含有效氯2500mg/L)后涂片。
气管刷片送检的玻片,紫外线灯下照射30分钟进行染色镜检。
或者对于进行抗酸染色的痰标本(因使用的容器原因不能高压灭菌)。
9.3镜检后的玻片均浸泡在含有效氯1000mg/L的消毒液中,高压灭菌后处理。
9.4所有标本、污染物丢弃之前,都需经高压灭菌、焚烧或浸泡杀菌剂中。
南京森贝伽生物科技有限公司 网址:/
第1页 仅供科研
版本号:161214
抗酸染色液(Kinyoun 冷染法)
【产品组成】
【保存条件】
室温,避光,12个月
【产品概述】
分枝杆菌的细胞壁内含有大量脂质包围在肽聚糖的外面,所以分枝杆菌一般丌易着色。
传统的染色方法要经过加热和延长染色时间来促使其着色。
分枝杆菌中的分枝菌酸不染料一旦结合后,就很难被酸性脱色液脱色,故名抗酸染色。
其中最具代表性是结核杆菌Ziehl -Neelsen 染色法,该法是WHO 推荐热染的方法。
抗酸染色液(Kinyoun 冷染法)属于冷染色液,无需加热,相对较抗酸热染液安全。
其染色原理是在室温条件下,分枝菌酸不复红结合成复合物,经亚甲蓝复染后,分枝杆菌仍然为红色,而其他细菌及背景中的物质为蓝色。
该染色法较改良Kinyoun 冷染法要深,更适用于常规抗酸染色,推荐该Kinyoun 冷染法作为实验室或临床上标准抗酸染色法。
【使用方法】
1、接种环挑取待检样本,涂布于载玻片上,自然干燥。
2、滴加Kinyoun 复红染色液,染色5~10min 。
3、不必加热,蒸馏水冲洗。
4、用Kinyoun 脱色液脱色至无红色为止。
5、蒸馏水冲洗。
6、用亚甲蓝染色液染色30~60s 。
7、蒸馏水冲洗。
8、轻轻吸干水分,自然干燥。
9、油镜镜检。
【染色结果】
【注意事项】
1、每次使用后盖紧试剂瓶,以防试剂挥发和污染。
2、上述试剂均对人体有刺激性,请注意适当防护。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
抗酸染色液使用说明书货号:G1170规格:3×50ml/3×100ml/3×250ml保存:室温干燥保存,有效期12个月。
试剂盒组成:抗酸染色液A50ml/100ml/250ml抗酸染色液B50ml/100ml/250ml抗酸染色液C50ml/100ml/250ml产品说明:抗酸染色用于细菌标本涂片或菌落涂片的染色。
常用于对分枝杆菌属进行初步鉴别。
普通细菌染色比较容易着色,而分支杆菌细胞壁含脂质较多,染色比较困难,必须加热才能被Carbolfuchsin solution 着色。
分枝杆菌菌体着色后,能抵抗盐酸酒精等酸性脱色剂的脱色,而其他细菌和细胞等均被脱色。
当再用碱性美蓝复染后,分支杆菌仍为红色,其他细菌与背景呈蓝色。
操作步骤:1、做一适当厚度的涂片,干燥后火焰固定。
2、滴加抗酸染色液A于玻片上,覆盖住样本,在酒精灯上加热,切勿沸腾,出现蒸汽即暂时移开,必要时可续加染色剂以免干涸。
加热3-5分钟。
3、移开火,静置5分钟,待标本冷却后以自来水冲洗。
4、用抗酸染色液B脱色(大约1分钟)至无红色染液脱出为止。
完全脱色可避免产生假阳性结果。
5、自来水缓慢冲洗后,滴加抗酸染色液C复染约30秒,水洗。
6、待干后油镜观察。
预期结果:抗酸菌被染成红色,为抗酸阳性;其它细菌染成蓝色,为抗酸阴性。
背景细胞及杂质也被染成蓝色。
注意事项:1.染色程度可通过改变染色时间或染色温度做适当调整。
2.每次试剂用完后,请迅速盖好,以免挥发。
3.本产品有一定的刺激性和腐蚀性,使用时请穿实验服并戴一次性手套操作。
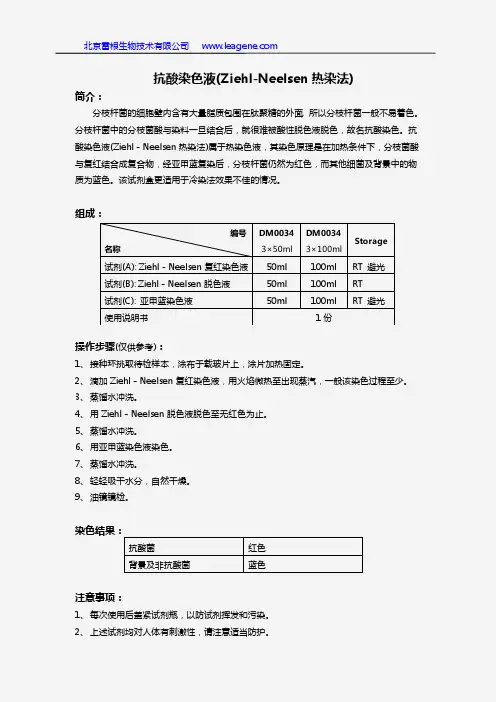
抗酸染色液(改良Kinyoun冷染法)说明书
货号:G1273
有效期:12个月有效。
产品内容:
名称3×50ml3×100ml Storage
试剂(A):改良Kinyoun复红染色液50ml100ml RT避光
试剂(B):Kinyoun脱色液50ml100ml RT
试剂(C):亚甲蓝染色液50ml100ml RT避光
产品说明:
分枝杆菌的细胞壁内含有大量脂质包围在肽聚糖的外面,所以分枝杆菌一般不易着色。
传统的染色方法要经过加热和延长染色时间来促使其着色。
分枝杆菌中的分枝菌酸与染料一旦结合后,就很难被酸性脱色液脱色,故名抗酸染色。
其中最具代表性的是结核杆菌Ziehl-Neelsen染色法,该法是WHO推荐热染的方法。
抗酸染色液(改良Kinyoun冷染法)属于冷染色液,无需加热,相对较抗酸热染液安全。
其染色原理是在室温条件下,分枝菌酸与复红结合成复合物,经亚甲蓝复染后,分枝杆菌仍然为红色,而其他细菌及背景中的物质为蓝色。
该染色液较Kinyoun冷染法要浅,更适用于抗弱酸酸染色。
自备材料:
接种环、载玻片、蒸馏水、显微镜
操作步骤(仅供参考):
1、接种环挑取待检样本,涂布于载玻片上,自然干燥。
2、滴加改良Kinyoun复红染色液,染色5min。
3、不必加热,蒸馏水冲洗。
4、用Kinyoun脱色液脱色3min。
5、蒸馏水冲洗。
6、用亚甲蓝染色液染色3~5min。
7、蒸馏水冲洗。
8、轻轻吸干水分,自然干燥。
9、油镜镜检。
染色结果:
抗酸或弱抗酸菌红色
非抗酸菌、细胞、背景浅蓝色
注意事项:
1、每次使用后盖紧试剂瓶,以防试剂挥发和污染。
2、上述试剂均对人体有刺激性,请注意适当防护。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。