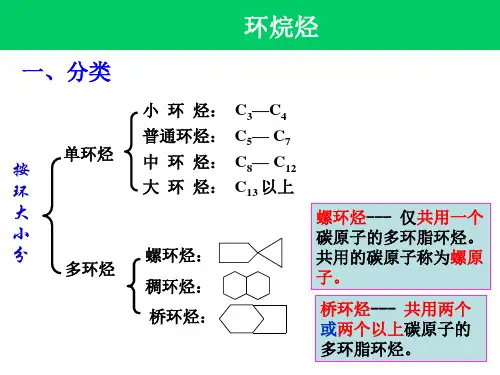
环烷烃(环丙烷、环丁烷、环戊烷、环己烷)的构象
- 格式:doc
- 大小:66.00 KB
- 文档页数:3





有机化学基础知识点环烷烃的命名和结构有机化学基础知识点:环烷烃的命名和结构环烷烃是有机化合物中的一类重要结构,具有许多实际应用。
正确的命名和了解其结构是学习有机化学的基础。
本文将介绍环烷烃的命名规则和结构特点。
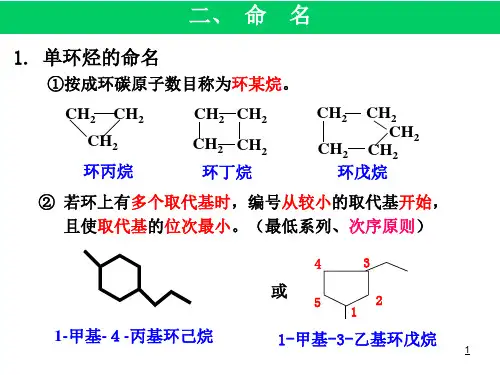
一、环烷烃的命名规则环烷烃是由碳原子组成的环状结构,每个碳原子上连接有氢原子。
根据碳原子数目的不同,环烷烃可分为环丙烷、环戊烷、环己烷等等,命名时需要按照以下规则进行:1. 确定环烷烃的基本结构,即环中碳原子的数目。
2. 按照碳原子数目,选择相应的前缀,如“环丙”、“环戊”、“环己”等等。
3. 在前缀之后加上“烷”的后缀,表示该化合物为饱和碳氢化合物。
4. 如果环烷烃中存在取代基,需用号码和取代基名称表示,位置号码是根据碳原子的顺序确定的。
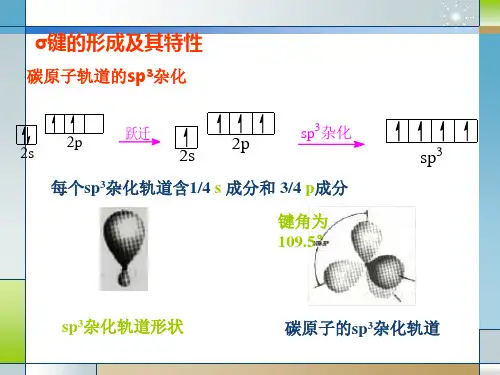
二、环烷烃的结构特点环烷烃具有独特的结构特点,主要包括以下几个方面:1. 环烷烃中的碳原子间的连接是共价键连接,碳原子的杂化也因分子中的环数目不同而不同。
以环丙烷为例,其中每个碳原子的最外层电子结构为sp³杂化。
2. 环烷烃的分子式与双键数目无关,即不像烯烃或炔烃那样分子式中会有双键或三键的存在。
3. 环烷烃的分子中不存在自由旋转,即环状结构会阻碍碳原子之间的自由旋转,使得环烷烃有一定的不对称性。
4. 环烷烃的物理性质与环的数目及取代基有关,一般来说,环烷烃的沸点随着环数的增加而增加,而环烷烃的熔点则随着环数的增加而下降。
三、环烷烃的简化结构式表示环烷烃的结构可以用简化结构式表示,以环丙烷为例:H|H-C-H|H上述简化结构式中的直线段代表碳碳单键,每个角上的直线段代表碳原子上的氢原子,圆圈则表示环的存在。
四、环烷烃的衍生物命名对于含有取代基的环烷烃,其命名规则与一般的取代基命名规则相似。
取代基在环上的位置由号码表示,取代基名称紧随号码后给出。
例如,对于在环戊烷上存在乙基取代基的化合物:CH₃-CH₂|CH₂-CH₃可以命名为2-乙基环戊烷。
综上所述,环烷烃的命名和结构是有机化学中的重要内容。
环烷烃的构象和拜尔张力学说环烷烃的构象1.环己烷的构象早在1890年,沙赫斯(Sachse,H.)通过研究以为,依照正四面体的模型,六个碳原子的环能够不在同一平面上,同时还维持着正四面体的正常角度,但由于表达得不清楚,图又画得不行,因此没有引发那时化学家们的注意。
莫尔(Mohr,E.,1918)从头研究了那个问题,正式提出了非平面无张力环的学说,并画出模型。
他以为碳原子能够维持正常的键角,环己烷的六个碳原子不在同一平面上,能够形成两种折叠着的环系,如图2-19所示。
图2-19(i)的两个叫作椅型,它是一个超级对称的分子,借助于模型能够看得很清楚。
第一,在那个模型中的碳原子是处在一上一下的位置。
第二,那个模型是僵硬的,只要一个键角改变,其它键角也同时改变。
第三,还能够看到,环中相邻两个碳原子的构象都是邻交叉型的,如用纽曼式表示,成为以下的形式:最后,还能够看出,椅型的环己烷的氢原子能够分为两组:一组是六个C——H键与分子的对称轴大致是垂直的,都伸出环外,这叫作平键(或称平伏键)或e键(e是equatorial的字首,赤道的意思),三个e键略往上伸,三个e键略向下伸;另六个氢的键都是与轴平行的,这叫作直键(或称直立键)或a键(a是axial的字首,轴的意思),三个伸在环的下面,三个伸在环的上面。
图2-19(i)中带点的白球都在环的上面,不带点的白球都在环的下面。
这种关系在斯陶特模型图2-20中能够表示得更清楚一些:在图2-20中,a键的氢原子都用带黑点的球表示,e键的氢原子用白球表示。
由于成环的碳链是封锁的,因此沿着碳碳键不管如何旋转,在环上面的不可能转到环的下面来,老是维持着原先各个氢原子的空间关系。
这种构象,既无角张力,也无扭转张力,代表一个最稳固的形式,是优势构象。
另一种维持正常键角的环己烷模型如图2-19(ii)的两个,叫作船型,可用纽曼式表示如下:第一可看到,2、3和5、6两对碳原子的构象是重叠型的,这种构象虽无角张力,但有扭转张力,相当于能量高的构象。
环烷烃的构象
链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
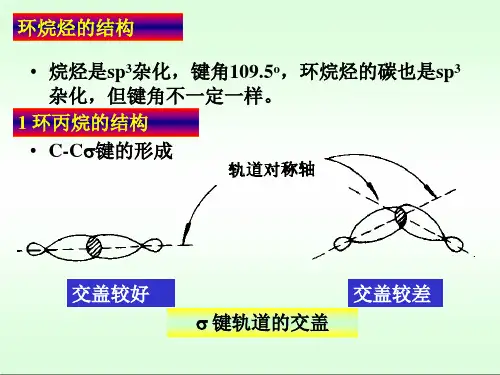
一、环丙烷的构象
环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:
1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象
环丁烷有两种极限构象:动画演示:
平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象
环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式
半椅式
四、环己烷的构象
环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型
Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖
1、椅式和船式构象
环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.
1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。
在椅式构象中,从透视式和纽曼式中可以看到:相邻的两个碳上的C—H 都是交叉式构象,非键合的氢间最近距离0.25 nm,大于0.24 nm(正常非键合氢之间的距离)。
C原子的键角109.5°。
无各种张力,是优势构象,在平衡构象中约占99.9%
环己烷的椅式构象
在船式构象中,船底上四个 C 中C1 和C2 ,C4 和C5 是重叠构象,有扭转张力,船头上两个伸向船内的氢(旗杆键上氢)相距0.183nm,小于正常非键合氢原子间距离
(>0.24nm),有非键张力,它的能量比椅式高30kJmol-1。
环己烷的船式构象
2.扭船式和半椅式构象。
1)扭船式构象:
将船式构象的碳扭转约30°,变成扭船式:
环己烷的扭船式构象
与船式相比:旗杆键的氢非键张力减少;比船式构象的能量低7kJmol-1
2)半椅式构象
把椅脚的碳C6向上提,与C1、C2、C4、C5 成一个平面,变成半椅式构象。
环已烷半椅式构象
与椅式构象相比:C2、C1、C6、C5、C4有扭转张力。
有角张力。
比椅式能量高46kJmol-1 3.环的翻转
当由一种椅式翻转成另一种椅式构象时,要经过两个半椅式,两个扭船式和一船式等构型:
环已烷椅式翻转能量图
4.平伏键与直立键
环已烷的椅式构象中,六个碳原子分别在两个平行的平面中。
C1、C3、C5在上面的平面中,C2、C4、C6在下面的平面中。
环己烷环有一个三重对称轴,垂直于两平面。
1)直立键:每个碳上有一根与轴平行的C—H 键,称直立键,也称竖直键(a键)。
有三根向上,三根向下。
2)平伏键:每个碳上有一根与平行平面成19°角的C—H 键称平伏键,也称水平键(e键)。
有三根向上偏19°,三根向下偏19°。
3)环的翻转:当从一种椅式构象翻转成另一种椅式构象时,平伏键转变成直立键,直立键变成平伏键。
这种翻转在室温下很迅速,用NMR谱测不出翻转,随着温度的降低,环翻转变慢,可用NMR谱跟踪,当温度降到-63°C时,可以看到a 键上H和e 键上H分开的信号。
-89°C 时环翻转很慢,这时可清楚测到a键上H和e键上H。
5.取代环已烷的构象。
1)一取代环已烷:有取代基R在a键上,也在e键上两种构象。
在e键上的构象稳定,因为,R在e键上相应的是对位交叉构象,在a键上是邻位交叉构象。
随着R基团的增大,在e键上的构象比例也增加。
R在a键和e键
2)二取代环已烷:二取代基的情况有几种取代位置,还有顺反关系。
一般是大取代基在e 键上的是稳定构象。
立体化学研究环已烷衍生物性质时,经常引入一个叔丁基,此时叔丁基在 e 键的构象稳定,环不易再翻转,称为“锁住”效应。
反式-4-甲基-1-叔丁基环己烷构象顺式-4-甲基-1-叔丁基环己烷构象
3)多取代基环已烷:
在确定多取代环已烷的构象时,一般是大取代基在 e 键上多个取代基在 e 键上的构象稳定。