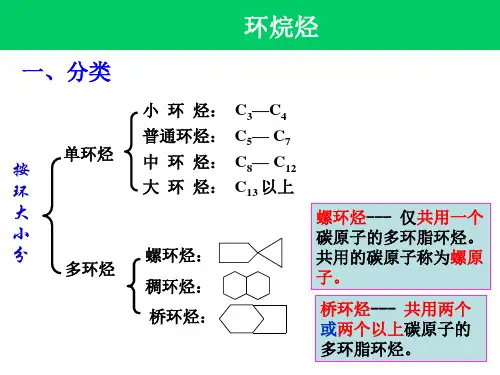
c3 (环烷烃)解析
- 格式:ppt
- 大小:2.45 MB
- 文档页数:30

环烷烃的概念环烷烃是一类有机化合物,也被称为脂环烷烃或脂肪环烷烃。
它的分子结构由碳(C)和氢(H)原子组成,其中碳原子形成一个或多个环状结构,每个碳原子上连接着两个氢原子。
环烷烃的普遍化学式为CnH2n,其中n代表碳原子的数量。
环烷烃根据碳原子的环状结构可以分为多个类别,最简单的是环己烷(C6H12),它由六个碳原子组成一个环。
其他常见的环烷烃有环戊烷、环丙烷等。
环烷烃的特点是分子结构中含有一个或多个环状结构,这种环状结构使得环烷烃相对于直链烷烃具有一些特殊的性质。
首先,由于环烷烃分子内部有较大的空间限制,环烷烃的分子难以与其他分子进行反应,使得环烷烃的化学稳定性较高。
此外,环烷烃还具有较高的沸点和熔点,比直链烷烃的物理性质要高。
环烷烃可以通过多种方法合成,最常见的方法是通过烷烃的脱氢反应得到。
例如,环己烷可以由己烷经过加热脱氢反应制得。
此外,环烷烃还可以通过环状化合物之间的反应合成,如环戊烷可以由乙烯和乙烯二聚反应得到。
环烷烃在生活中有广泛的应用。
最典型的例子是石油和天然气中的环烷烃,它们是石油和天然气中最常见的组分之一。
石油和天然气中的环烷烃可以用于生产燃料、润滑剂和化工原料。
此外,环烷烃还可用作溶剂、塑料、橡胶等领域的原料。
但是,环烷烃也存在一些环境和健康方面的问题。
环烷烃是一类挥发性有机物,它们在大气中的存在会对空气质量产生负面影响,形成臭氧、光化学烟雾等污染物。
此外,环烷烃还可能引发健康问题,如呼吸道疾病和神经系统损伤。
总之,环烷烃是一类有机化合物,具有稳定性高、物理性质特殊的特点。
它们在能源、化工和其他领域有着广泛的应用,但也带来环境和健康方面的问题。
对环烷烃的深入研究和合理利用,有助于提高环境质量,推动可持续发展。
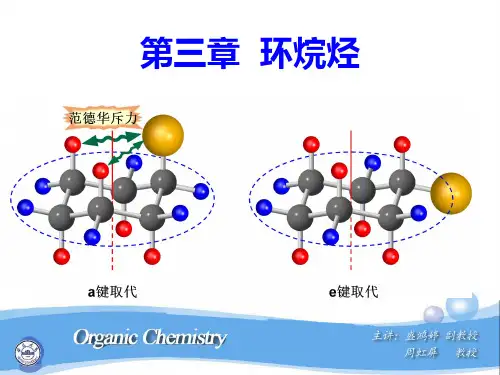






环烷烃的构象链状化合物的构象是由基团绕C—Cσ键旋转产生的;而环状化合物的构象至少涉及到两个C—Cσ键和其键角的转动和变化,有时还涉及到键长和键角的变化,比较复杂,常称环的翻转。
一、环丙烷的构象环丙烷是三个碳的环,只能是平面构象,即它的构型。
尽管只有一种构象,但这个环极不稳定,主要因为:1、所有C-H键都是重叠构象,扭转张力大。
2、C原子是不等性杂化或弯曲键,有“角张力”存在。
二、环丁烷的构象环丁烷有两种极限构象:动画演示:平面式构象:象环丙烷一样,不稳定,存在扭转张力和“角张力”。
蝶式构象:能缓解扭转张力和角张力,呈蝶式构象。
通过平面式构象,由一种蝶式翻转成为另一种蝶式构象,处于动态平衡。
蝶式是优势构象。
也有扭转能力和角张力存在。
三、环戊烷的构象环戊烷的构象主要是信封式和半椅式构象。
两者处于平衡。
因为平面构象能量较大,一般认为环戊烷采取这种构象可能性很少。
E相对=19kJ/mol 信封式半椅式四、环己烷的构象环己烷的构象经过近百年的努力才建立起来。
Baeyer 1885年提出张力学说,认为环状化合物是平面构型Sachse 1889年质疑张力学说只适合小环,提出环已烷有船式、椅式两种构象。
Hassel 1930年利用偶极矩测定法和电子衍射法研究环已烷构象,∠CCC=109.5°,气相、液相中环已烷几乎全是椅式构象。
Barton 1950年发展了构象理论,以甾族化合物为对象提出构象分析,把构象分析明确地引入有机化学中。
Hassel 和Barton获1969年Nobel化学奖1、椅式和船式构象环已烷保持碳原子的109.5°键角,提出了椅式和船式构象.1)椅式构象:C1、C2、C4、C5在一个平面上,C6和C3分别在平面的下面和平面的上面,很象椅脚和椅背,故称“椅式”。
2)船式构象:C1、C2、C4、C5在一个平面上,C3和C6在平面上面。
形状象只船,C3和C6相当船头和船尾,故称“船式”。

烷烃【打火机的由来:】1823年,德国化学家德贝莱发明了世界上第一台打火机。
他是利用锌和硫酸发生化学反应生成氢气,氢气喷到铂棉上自动起火。
由于这种打火机缺点很多,未能得到推广使用。
现代的电子打火机,主要用丁烷作为燃料,用电子陶瓷取代火石作为引燃物,用起来方便快捷。
丁烷属于烷烃,它的性质与甲烷相似,还有哪些物质与丁烷的性质也相似呢?一、烷烃的结构和性质(1)烷烃的概念烃分子里,碳原子之间都以碳碳单键结合成链状,碳原子的其余价键全部跟氢原子结合,这样的结合使得每个碳原子的化合价都已充分利用,都达到“饱和”,凡是具有这些共同特征的烃都属于烷烃,又叫做叫做饱和链烃。
烷烃概念的内涵有如下几点:①烷烃首先是烃,分子里只含C、H两种原子;②分子里仅含C—C键和C—H键;③烷烃分子结合成链状,可以是所谓的“直链”,如:CH3―CH2―CH2―CH3。
也可以含有支链,如:。
但结合为环状的不是烷烃,如:它们属于环烷烃,通式为C n H2n,化学性质与烷烃相似。
(2)烷烃的物理性质烷烃都是由分子组成的物质,分子之间的相互作用是分子间作用力,分子间作用力要比化学键弱得多。
因此,烷烃的熔点、沸点都较低,密度较小。
但是,不同的烷烃其物理性质也不同。
对于烷烃而言,相对分子质量大的,分子间作用力大,熔、沸点较高;对于相对分子质量相同的烷烃,支链越多,沸点越低。
烷烃的物理性质归纳如下:【溶解性:】烷烃不溶于水,但易溶于有机溶剂。
液态烷烃本身就是有机溶剂。
(相似相溶:结构相似者可能互溶)【状态:】分子里碳原子数等于或小于4的烷烃,在常温、常压下都是气体。
另外,(新戊烷)在常温、常压下也是气体。
其他烷烃,在常温、常压下都是液体或固体。
【密度:】烷烃的相对密度小于水的密度。
以下是部分烷烃的沸点和相对密度:例:将下列物质的沸点按由高到低的顺序排列(填序号)_____。
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH ④(CH3)4C⑤(CH3)2CHCH2CH3解析:本题是填空题,考查同系物的沸点与其相对分子质量及结构的关系等方面的知识。
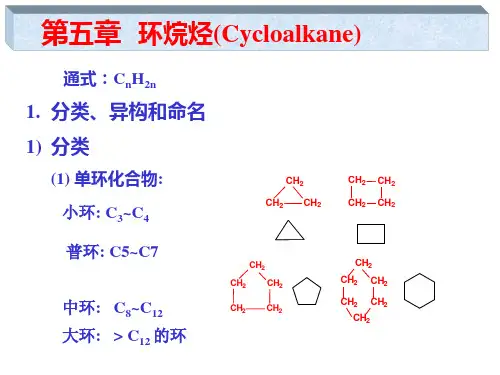
环烷烃1 环烷烃的结构环烷烃属于饱和烃,它的分子结构中存在碳环;与链状烷烃相似,所有碳原子都采取sp3杂化,每个碳原子与其连接的4个原子构成四面体空间结构,分子中仅有C—C σ键和C—H σ键。
最小的环烷烃是由3个碳原子构成的环丙烷(△)。
名师提醒(1)相同碳原子数的链状烷烃和环烷烃相比较,链状烷烃分子中的C—C键数比环烷烃分子中的少1,如丙烷分子中只有2个C—C σ键,而环丙烷分子中有3个C—C σ键;链状烷烃分子中的C—H键数比环烷烃分子中的多2。
(2)虽然环烷烃和链状烷烃的碳骨架不同,但由于二者的共价键类型相同,故化学性质相似。
2 环烷烃同系物的通式环丙烷()的分子式是C3H6,环丁烷()的分子式是C4H8,环戊烷()的分子式是C5H10……,由此可推断出环烷烃的分子通式是C n H2n(n≥3,n 为正整数)。
3 环烷烃同系物的物理性质随碳原子数的递增,环烷烃同系物的熔点、沸点逐渐升高,密度逐渐增大,但都小于水的密度,都难溶于水。
4 环烷烃同系物的化学性质与链状烷烃相似,环烷烃的化学性质比较稳定,不与强酸、强碱、强氧化剂反应;能在光照下发生取代反应、能在空气或O2中燃烧等。
典型例题例3-9(2020福建厦门期末)甲基环戊烷()常用作溶剂及色谱分析标准物质,也可用于有机合成。
下列有关该有机物的说法错误的是()A.分子式为C6H12B.与环己烷互为同分异构体C.易溶于水及苯D.不能使酸性高锰酸钾溶液褪色解析◆由甲基环戊烷的结构简式可推知其分子式为C6H12,A项正确;环己烷的分子式为C6H12,故环己烷与甲基环戊烷的分子式相同,而结构不同,二者互为同分异构体,B项正确;由环烷烃的物理性质可知,该有机物难溶于水,C项错误;由环烷烃的化学性质可知,该有机物不能使酸性高锰酸钾溶液褪色,D项正确。
答案◆C。