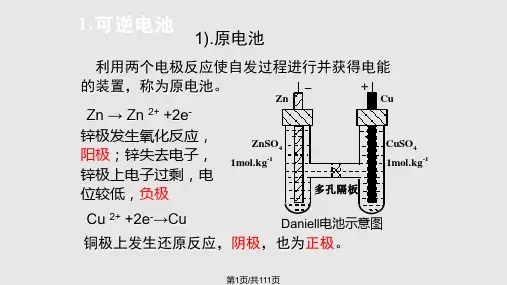
H 2SO 4 H 2SO 4
(1)有活泼性不同的两个金属电极(或
金属与能导电的非金属)
Cu
(2) 电解质溶液
(3)内外电路相通
H 2S O 4
⒈ 判别以下哪些安装构成了原电池?假设不是,
练
请阐明理由;假设是,请指出正负极称号,
习
并写出电极反响式.
①
②
③
④
⑤
⑥
⑦
⑧
⑨
5. 原电池的运用
(1)制造干电池、蓄电池、高能电池等。
,发生
吸氧 腐蚀,电极反响式为:负极:Fe–2e-=Fe2+,
正极:O2+2H2O+4e-=4OH-;
〔2〕
假设液面下降,那么溶液呈酸性
,发生
析氢 腐蚀,电极反响式为:负极:Fe–2e-=Fe2+
正极:2H++2e-=H2↑。
2、分析右图,按要求写出有关反响方程式:
〔1〕、铁棒上的电极反响式为:
〔2〕、碳棒上的电极反响式为:
〔3〕、溶液中发生反响的化学方程式:
2Fe+2H2O+O2= 2
F4Fe(eO(OHH)2)2+2H2O+O2=4Fe(OH) 2Fe–4e-=2Fe2+
3、镍—镉3可充电电池可发生如下反响: O2+2H2O+4e-=
Cd(OH)2+2Ni(OH)2 放电 充电
4OH-
Cd+2NiO(OH)+2H2 O
附H2、O2的分子数,从而增大反响速率。(4)LiH中Li为+1价,
H为-1价,故反响Ⅰ中复原剂是Li,反响Ⅱ中氧化剂是H2O。
由反响Ⅰ可知吸收规范情况下224 L H2时生成160 g LiH,那