原电池和电解池的组合装置
- 格式:ppt
- 大小:362.00 KB
- 文档页数:15

微专题电化学“多池和多室”串联问题及计算1(2023·湖北·统考高考真题)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。
该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为xmol⋅h-1。
下列说法错误的是A.b电极反应式为2H2O+2e-=H2↑+2OH-B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜D.海水为电解池补水的速率为2xmol⋅h-1【答案】D【解析】由图可知,该装置为电解水制取氢气的装置,a电极与电源正极相连,为电解池的阳极,b电极与电源负极相连,为电解池的阴极,阴极反应为2H2O+2e-=H2↑+2OH-,阳极反应为4OH--4e-=O2↑+2H2O,电池总反应为2H2O 通电=2H2↑+O2↑。
A.b电极反应式为b电极为阴极,发生还原反应,电极反应为2H2O+2e-=H2↑+2OH-,故A正确;B.该装置工作时阳极无Cl 2生成且KOH浓度不变,阳极发生的电极反应为4OH--4e-=O2↑+2H2O,为保持OH -离子浓度不变,则阴极产生的OH -离子要通过离子交换膜进入阳极室,即离子交换膜应为阴离子交换摸,故B 正确;C .电解时电解槽中不断有水被消耗,海水中的动能高的水可穿过PTFE 膜,为电解池补水,故C 正确;D .由电解总反应可知,每生成1molH 2要消耗1molH 2O ,生成H 2的速率为xmol ⋅h -1,则补水的速率也应是xmol ⋅h -1,故D 错误;答案选D 。
2(2022·山东·高考真题)设计如图装置回收金属钴。
保持细菌所在环境pH 稳定,借助其降解乙酸盐生成CO 2,将废旧锂离子电池的正极材料LiCoO 2(s )转化为Co 2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。
已知电极材料均为石墨材质,右侧装置为原电池。
下列说法正确的是A.装置工作时,甲室溶液pH 逐渐增大B.装置工作一段时间后,乙室应补充盐酸C.乙室电极反应式为LiCoO 2+2H 2O +e -=Li ++Co 2++4OH -D.若甲室Co 2+减少200mg ,乙室Co 2+增加300mg ,则此时已进行过溶液转移【答案】BD【解析】A .电池工作时,甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO 2气体,同时生成H +,电极反应式为CH 3COO --8e -+2H 2O =2CO 2↑+7H +,H +通过阳膜进入阴极室,甲室的电极反应式为Co 2++2e -=Co ,因此,甲室溶液pH 逐渐减小,A 错误;B .对于乙室,正极上LiCoO2得到电子,被还原为C o 2+,同时得到Li +,其中的O 2-与溶液中的H +结合H 2O ,电极反应式为2LiCoO 2+2e -+8H +=2Li ++2Co 2++4H 2O ,负极发生的反应为CH 3COO --8e -+2H 2O =2CO 2↑+7H +,负极产生的H +通过阳膜进入正极室,但是乙室的H +浓度仍然是减小的,因此电池工作一段时间后应该补充盐酸,B 正确;C .电解质溶液为酸性,不可能大量存在OH -,乙室电极反应式为:LiCoO 2+e -+4H +=Li ++Co 2++2H 2O ,C 错误;D .若甲室Co 2+减少200mg ,则电子转移物质的量为n (e -)=0.2g 59g /mol ×2=0.0068mol ;若乙室Co 2+增加300mg ,则转移电子的物质的量为n (e -)=0.3g 59g /mol×1=0.0051mol ,由于电子转移的物质的量不等,说明此时已进行过溶液转移,即将乙室部分溶液转移至甲室,D 正确;故合理选项是BD 。




微专题:原电池、电解池的串联组装问题[专题解读]原电池、电解池的串联组装问题是将原电池和电解池有机地融合在一起进行综合考查。
解答该类试题,透彻理解电化学原理是基础,准确判断电池种类是关键,灵活利用电子守恒是处理数据的法宝。
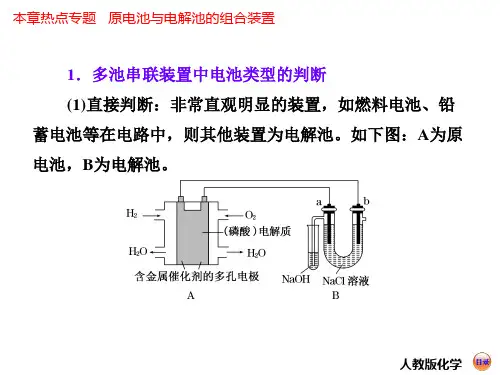
具体有以下三个步骤:第一步:多池串联装置中电池类型的判断(1)直接判断非常直观明显的装置,如燃料电池、铅蓄电池等在电路中存在时,则其他装置为电解池。
如下图中,A为原电池,B为电解池。
(2)根据电池中的电极材料和电解质溶液判断原电池一般是两种不同的金属电极或一个为金属电极,另一个以碳棒为电极;而电解池则一般都是两个惰性电极,如两个铂电极或两个碳棒。
原电池中的电极材料和电解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。
如上图中,B为原电池,A为电解池。
(3)根据电极反应现象判断在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型,如图。
若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;甲是电解池,A是阳极,B是阴极。
B、D极发生还原反应,A、C极发生氧化反应。
第二步:利用相关概念进行分析和判断在确定了原电池和电解池后,利用有关概念做分析和判断,如电极的判断、电极反应式的书写、实验现象的描述、溶液中离子的移动方向、pH的变化及电解质溶液的恢复等。
只要按照各自的规律分析即可。
第三步:串联装置中的数据处理原电池和电解池综合装置的有关计算的根本依据就是电子转移守恒,分析时要注意两点:①串联电路中各支路电流相等;②并联电路中总电流等于各支路电流之和。
在此基础上分析处理其他各种数据。
上图中,装置甲是原电池,装置乙是电解池,若电路中有0.2mol 电子转移,则Zn 溶解6.5g,Cu 电极上析出H 22.24L(标准状况),Pt 电极上析出Cl 20.1mol,C 电极上析出Cu 6.4g。
甲池中H +被还原,产生H 2,负极Zn 被氧化生成ZnSO 4,pH 变大;乙池中是电解CuCl 2溶液,电解后再加入适量CuCl 2固体可使溶液复原。

电解池原电池电解池原电池是一种通过电解池反应产生电能的装置。
它由两个电解池组成,其中一个电解池是负极,另一个电解池是正极。
电解池原电池的工作原理是将化学能转化为电能。
在电解池原电池中,负极和正极之间通过电解质连接。
电解质可以是液体或固体,它的作用是提供离子传导通道,使电流能够在负极和正极之间流动。
当外部电路与电解池原电池连接时,负极上的化学反应会产生电子,这些电子通过外部电路流动到正极,在正极上发生另一种化学反应。
这个过程中,化学能被转化为电能。
电解池原电池可以用于各种应用,如电子设备、交通工具和储能系统等。
其中最常见的应用是在电动汽车中使用的锂离子电池。
锂离子电池是一种典型的电解池原电池,它的正极由锂离子化合物组成,负极由碳材料组成,电解质是有机溶剂。
除了锂离子电池,还有其他种类的电解池原电池,如铅酸电池、镍氢电池和锌锰电池等。
每种电池都有其特定的工作原理和性能特点。
铅酸电池是一种成熟的技术,广泛应用于汽车起动、照明和太阳能储能等领域。
镍氢电池具有高能量密度和长寿命,在航空航天和混合动力汽车等领域得到广泛应用。
锌锰电池是一种环保型电池,主要用于一次性电子产品和微型电子设备。
电解池原电池的性能主要取决于其正负极材料、电解质和结构设计等因素。
正负极材料的选择和制备工艺对电池的能量密度、循环寿命和安全性等方面具有重要影响。
电解质的选择和浓度对电池的离子传导和电化学反应速率有重要影响。
结构设计包括电池的外壳、内部分隔膜和电流集电体等,对电池的容量、自放电和安全性等有重要影响。
为了提高电解池原电池的性能,科学家们在材料、电解质和结构设计等方面进行了广泛的研究。
通过改进材料的结构和制备工艺,可以提高电池的能量密度和循环寿命。
通过优化电解质的配方和浓度,可以提高电池的离子传导和电化学反应速率。
通过改进电池的结构设计,可以提高电池的容量和安全性。
电解池原电池是一种通过化学反应产生电能的装置。
它可以应用于各种领域,如电子设备、交通工具和储能系统等。

原电池和电解装置的工作原理原电池和电解装置是两种常见的电化学设备,用于产生电流和进行化学反应。
下面将介绍它们的工作原理。
原电池原电池是一种将化学能转化为电能的装置。
它由两个半电池组成,即负极和正极。
负极是电荷提供者,正极是电荷接受者。
两个半电池通过电解质桥或盐桥连接。
在负极内,有一种氧化还原反应发生,生成电子。
这些电子通过外部电路流动,到达正极,完成了电流的传递。
这个过程涉及一个重要的原理,即氧化还原反应。
氧化还原反应是指物质失去或获得电子的过程。
在负极,发生一个氧化反应,电子从负极物质中释放出来。
在正极,发生一个还原反应,电子被正极物质接受。
这样,原电池中就会产生电流。
电解装置电解装置是一种利用电流进行化学反应的装置。
它由两个电极和一个电解质溶液组成。
其中,一个电极称为阳极,另一个电极称为阴极。
电解质溶液中含有离子,如阳离子和阴离子。
当外部电源连接到电解装置时,电流开始流动。
在电解装置中,发生了两个主要的反应:阳极反应和阴极反应。
阳极反应是指在阳极上的氧化反应,阴极反应是指在阴极上的还原反应。
通过这些反应,离子在溶液中进行移动,形成新的物质。
这是化学反应发生的过程。
电解装置的工作原理与原电池类似,都涉及到氧化还原反应。
不同之处在于,原电池是自主产生电流,而电解装置需要外部电源提供电流。
此外,电解装置能够实现特定的化学反应,通过控制反应条件和电流强度,可以制造所需的物质。
总之,原电池和电解装置是两种常见的电化学装置。
它们的工作原理都基于氧化还原反应,通过电流传递和化学反应来产生电能或制造物质。
了解它们的工作原理有助于我们更好地理解电化学领域的应用和实验。
参考:。
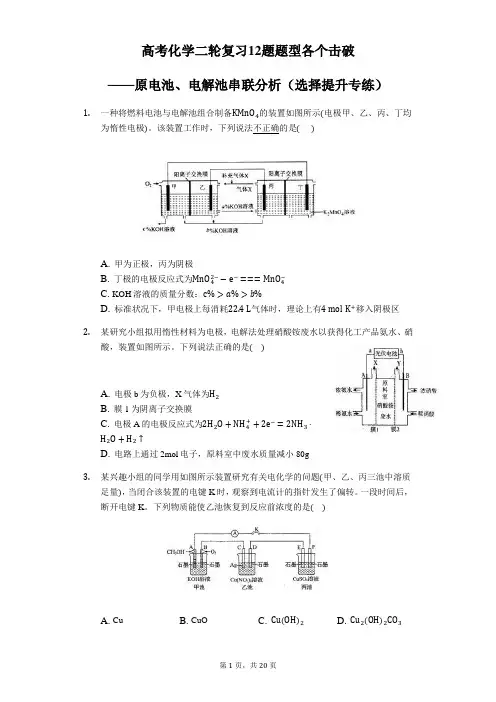
高考化学二轮复习12题题型各个击破——原电池、电解池串联分析(选择提升专练)1.一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。
该装置工作时,下列说法不正确的是()A. 甲为正极,丙为阴极B. 丁极的电极反应式为MnO42−−e−===MnO4−C. KOH溶液的质量分数:c%>a%>b%D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4mol K+移入阴极区2.某研究小组拟用惰性材料为电极,电解法处理硝酸铵废水以获得化工产品氨水、硝酸,装置如图所示。
下列说法正确的是()A. 电极b为负极,X气体为H2B. 膜1为阴离子交换膜C. 电极A的电极反应式为2H2O+NH4++2e−=2NH3⋅H2O+H2↑D. 电路上通过2mol电子,原料室中废水质量减小80g3.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
一段时间后,断开电键K。
下列物质能使乙池恢复到反应前浓度的是()A. CuB. CuOC. Cu(OH)2D. Cu2(OH)2CO34.如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。
下列说法正确的是()A. 闭合开关K时,电极B为负极,且电极反应式为2Br−−2e−=Br2B. 装置(Ⅰ)放电时,总反应为2Na2S2+Br2=Na2S4+2NaBrC. 装置(Ⅰ)充电时,Na+从左到右通过阳离子交换膜D. 该装置电路中有0.1mol e−通过时,电极X上析出3.2g Cu5.下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72−废水,电解过程中溶液发生反应:Cr2O72−+6Fe2++14H+=2Cr3++6Fe3++7H2O。

电解池和原电池的组合原理一、引言电解池和原电池是电化学领域中常见的两种电池类型。
电解池是一种可以通过电解反应将化学能转化为电能的装置,而原电池则是一种可以将化学能直接转化为电能的装置。
本文将介绍电解池和原电池的组合原理,以及它们在实际应用中的一些例子。
二、电解池的组合原理电解池是由两个电极和电解质溶液组成的。
其中,一个电极称为阳极,另一个电极称为阴极。
电解质溶液中的化学物质在电解过程中被分解成离子,并在电极上发生氧化还原反应。
阳极上发生氧化反应,阴极上发生还原反应。
在电解过程中,离子在电解质溶液中的传导形成了电流,从而产生了电能。
通常情况下,电解质溶液是由无机盐或有机酸碱溶液组成的。
当外加电压施加到电解池上时,阳极上发生了氧化反应,阴极上发生了还原反应。
电解池中的电解质溶液中的阳离子被吸引到阴极,而阴离子被吸引到阳极。
在电解过程中,阳离子被电子还原,而阴离子被电子氧化。
这样,电解质溶液中的化学物质就被分解成了元素或化合物。
三、原电池的组合原理原电池是通过化学反应产生电能的装置。
原电池包括两个半电池,每个半电池由一个电极和一个电解质组成。
其中,一个半电池中的电极称为阳极,另一个半电池中的电极称为阴极。
原电池的工作原理是通过半电池中的化学反应将化学能转化为电能。
在原电池中,阳极和阴极之间存在电势差,这是由于两个半电池中的化学反应引起的。
当两个半电池通过导线连接时,电子从阳极流向阴极,形成了电流。
同时,在半电池中发生化学反应,产生了离子。
离子在电解质溶液中的传导形成了电流。
这样,原电池中的化学能就被转化为了电能。
四、电解池和原电池的组合应用电解池和原电池在实际应用中有许多重要的用途。
下面将介绍一些常见的例子。
1. 电解池和原电池的组合用于电镀电镀是一种利用电解池和原电池原理将金属镀层沉积在物体表面的工艺。
在电解池中,作为阳极的金属被氧化,而作为阴极的物体表面上的金属离子被还原,从而实现了金属镀层的沉积。

⾼中化学知识点——原电池和电解池原电池和电解池1.原电池和电解池的⽐较:装置原电池电解池实例原理使氧化还原反应中电⼦作定向移动,从⽽形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液⽽在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或⾮惰性);③电解质(⽔溶液或熔化态)。
反应类型⾃发的氧化还原反应⾮⾃发的氧化还原反应电极名称由电极本⾝性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电⼦流向负极→正极电源负极→阴极;阳极→电源正极电流⽅向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应⽤①抗⾦属的电化腐蚀;②实⽤电池。
①电解⾷盐⽔(氯碱⼯业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
⼀原电池;原电池的形成条件原电池的⼯作原理原电池反应属于放热的氧化还原反应,但区别于⼀般的氧化还原反应的是,电⼦转移不是通过氧化剂和还原剂之间的有效碰撞完成的,⽽是还原剂在负极上失电⼦发⽣氧化反应,电⼦通过外电路输送到正极上,氧化剂在正极上得电⼦发⽣还原反应,从⽽完成还原剂和氧化剂之间电⼦的转移。
两极之间溶液中离⼦的定向移动和外部导线中电⼦的定向移动构成了闭合回路,使两个电极反应不断进⾏,发⽣有序的电⼦转移过程,产⽣电流,实现化学能向电能的转化。
从能量转化⾓度看,原电池是将化学能转化为电能的装置;从化学反应⾓度看,原电池的原理是氧化还原反应中的还原剂失去的电⼦经导线传递给氧化剂,使氧化还原反应分别在两个电极上进⾏。
原电池和电解池知识点一、原电池1.原理:原电池利用化学反应的放电过程产生电能。
化学反应中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。
阳极和阴极之间通过导电介质(如电解质溶液)连接起来,形成一个闭合的电路。
在化学反应过程中,氧化反应释放出的电子从阳极流出,经过外部电路进入阴极,参与还原反应。
同时,电解质中的阳离子在阴极处得到电子而还原,而阴离子则在阳极处失去电子而氧化,完成整个电池的放电过程。
2.构造:原电池一般由两个不同的电金属和一个电解质溶液组成。
电金属通常选择容易氧化(失去电子)而不容易被还原(得到电子)的金属。
常用的原电池有干电池(如锌-碳电池,锌-锰电池)、铅蓄电池、锂电池等。
阳极和阴极通常以导电材料(如金属箔)制成,再涂覆上催化剂,以促进氧化和还原反应的发生。
电解质的选择取决于所使用的金属和化学反应的特点。
3.应用:原电池广泛应用于我们的日常生活和工业生产中。
干电池被用于给家电产品、手动工具等提供电源。
铅蓄电池被用于汽车、UPS电源等领域。
锂电池被广泛应用于便携式设备(如手机、笔记本电脑)和电动车等。
二、电解池1.原理:电解池是一种将电能转化为化学能的装置。
它利用外部电源的电能驱动化学反应,使一种物质在阳极发生氧化反应,而在阴极发生还原反应。
与原电池类似,电解池的阳极和阴极通过电解质连接起来,形成一个闭合的电路。
2.构造:电解池一般由电解槽(容器)、两个电极和电解质组成。
电解槽通常由耐腐蚀的材料(如玻璃或塑料)制成,以容纳电解质溶液。
两个电极一般由导电性能良好的材料制成,如铂或金属箔。
电解质的选择取决于所需的化学反应。
3.应用:电解池在生产和实验室中有广泛的应用。
它可以用来电镀、电解制取金属、电解水制氢氧化钠等。
工业上最常见的应用是电解铜、电解钯、电解腐蚀金属表面等。
总结:原电池和电解池是两种常见的电化学装置。
原电池将化学能转化为电能,而电解池将电能转化为化学能。
原电池利用化学反应的放电过程产生电能,结构上由两个不同的电金属和一个电解质溶液组成。
“原电池(电解池)——电解池组合”题目分类辨析原电池与电解池是每年高考都会涉及的内容,除了能分析区别单个原电池、电解池的基本原理、电极方程式的书写、离子移动等。
将原电池和电解池结合在一起以及多个电解池串联在一起综合考察也是高考试卷中电化学部分的重要题型。
下面就将如何区分这两种模型以及解题方法进行分析。
一、明白原理、确定模型。
下面的组合装置是学生做题过程中经常遇到的,在看到装置图能快速找到其归属模型是后面分析的基础该四幅图的区别点在于整套装置中有没有直接给出的电源。
图3与图4是直接有画出电源的。
因此电源连接的若干烧杯为串联的电解池;而图1与图2是没有直接给出电源的,而是将电源放大为原电池,与电解池串联。
因此,遇到复杂的装置找出有无直接画出的电源是确定分类的关键点。
下面将对这两种模型的分析方法进行总结。
二、原电池与电解池组合图1图2图3 图4(1)首先,找出原电池。
①根据构成原电池条件判断我们知道构成原电池一定要活泼性不同的电极。
因此分析图1、图2可以快速判断左边的装置为原电池。
②根据常见的原电池由图5我们可以看出甲为氢氧燃料电池,因此可以判断甲为原电池,乙为电解池。
当然,根据构成原电池的条件,我们也可以排除乙为原电池。
③根据实验现象若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池。
(2)其次,确定原电池正负极①根据金属单质做负极从图1、图2可以分析出Zn、Pt分别作为原电池的负极。
①根据实验现象图6中,D电极上析出铜,说明发生反应Cu2+ + 2e-= Cu,可以分析其为正极,那么C 电极即为负极。
(3)确定电解池阴阳极。
根据“和电源正极相连的为阳极,和负极相连的为阴极”即可。
然后再根据阳极发生氧化反应、阴极发生还原反应写出电极方程式。
图5图6三、电解池与电解池组合①②备注:①为给出了电源的正负极;②为未给出电源正负极该类模型的一大特点是题目中有直接给出的电源,对于已经给出电源正负极的装置来说,我们直接根据与正极相连的为阳极,与负极相连的为阴极。
电解池和原电池的组合原理一、引言电解池和原电池是电化学中常见的两种电池形式。
电解池是指通过电解反应将化学能转化为电能的装置,而原电池则是通过化学反应直接产生电能的装置。
本文将从电解池和原电池的组合原理出发,详细介绍它们的工作原理和应用。
二、电解池的组合原理电解池是由阳极和阴极两个电极以及电解质溶液组成的。
在电解质溶液中,阳极发生氧化反应,阴极发生还原反应。
通过外部电源施加电压,使阳极和阴极之间产生电势差,促使电解质中的离子发生迁移,进而发生氧化还原反应。
这样,化学能就会转化为电能。
电解池的组合原理可以分为以下几个方面来阐述:1. 电解质的选择电解质是电解池中起到导电作用的物质。
常用的电解质有酸、碱、盐等。
选择合适的电解质可以提高电解池的导电性能,进而提高其效率。
2. 电极的材料选择电极是电解池中进行氧化和还原反应的地方。
电极材料的选择直接影响电解池的效率和稳定性。
常见的电极材料有铜、银、铂等,选择适合的电极材料可以提高反应速率和电解质的转化效率。
3. 外部电源的作用外部电源的作用是提供足够的电压和电流,促使电解质中的离子进行迁移。
外部电源可以是直流电源或交流电源,选择适当的电源可以满足电解反应的需要。
三、原电池的组合原理原电池是利用化学反应直接产生电能的装置。
原电池由两个电极和电解质组成。
其中,一个电极进行氧化反应,另一个电极进行还原反应。
两个电极之间的化学反应产生电子,在外部电路中流动,从而产生电流。
原电池的组合原理可以从以下几个方面来说明:1. 化学反应的选择原电池的电极反应是通过化学反应产生电能的。
选择适合的化学反应可以提高电池的效率和稳定性。
常见的原电池有干电池、锂电池、铅酸电池等,它们采用不同的化学反应方式来产生电能。
2. 电解质的选择电解质是原电池中起到导电作用的物质。
选择合适的电解质可以提高电池的导电性能,进而提高其效率。
常见的电解质有酸、碱、盐等。
3. 电极的材料选择电极是原电池中进行氧化和还原反应的地方。
原电池与电解池相连电池和电解池是电化学领域中常见的两种装置,它们在能量转换和储存方面发挥着重要作用。
本文将探讨原电池与电解池的联系和应用。
我们来了解一下原电池。
原电池是一种将化学能转化为电能的装置。
它由两个电极和一个电解质组成。
其中,一个电极是负极,另一个电极是正极。
电解质则是连接两个电极的介质,通常是液体或者固体。
在原电池中,化学反应会在电极和电解质之间发生,产生电子流动,从而产生电能。
与原电池相比,电解池的作用正好相反。
电解池是一种将电能转化为化学能的装置。
它也由两个电极和一个电解质组成,但是在电解池中,电能会被用来驱动非自发性的化学反应。
通过在电解质中施加外加电压,电解池可以使化学物质发生电解,从而产生新的物质。
原电池和电解池之间的联系在于它们都涉及到了电极和电解质的使用。
在原电池中,化学反应导致电子流动,产生电能;而在电解池中,外加电压导致电子流动,驱动化学反应。
可以说,原电池和电解池是电化学反应的两个方向。
原电池和电解池在生活中有着广泛的应用。
原电池常见于日常用品,如手电筒、遥控器等。
它们通过将化学能转化为电能,为我们的生活提供了便利。
而电解池则广泛应用于电镀、电解制氢、电解水等工业过程中。
通过外加电压,电解池可以实现一些非常重要的化学反应,为工业生产提供了支持。
总结起来,原电池和电解池是电化学领域中重要的装置。
它们通过电极和电解质的相互作用,实现了能量的转换和储存。
原电池将化学能转化为电能,而电解池则将电能转化为化学能。
它们在日常生活和工业生产中都有着广泛的应用。
通过深入了解原电池和电解池的原理和应用,我们可以更好地理解电化学领域的基本原理和技术。