除菌过滤器测试方法和原理
- 格式:doc
- 大小:48.50 KB
- 文档页数:4


除菌过滤器后的完整性测试除菌过滤器使用后,必需采用适当的方法赶忙对其完整性进行测试并记录。
除菌过滤器使用前,应当进行风险评估来确定是否进行完整性测试,并确定在灭菌前还是灭菌后进行。
当进行灭菌后—使用前完整性测试时,需要采取措施保证过滤器下游的无菌性。
常用的完整性测试方法有起泡点测试、扩散流/前进流试验或水侵入法测试。
进入A级和B级干净区的消毒剂,应经除菌过滤或采用其他适当方法除菌。
假如使用过滤方法除菌,应评估消毒剂与所选择滤器材质之间的适用性。
滤器使用后需进行完整性测试。
用于直接接触无菌药液或无菌设备表面的气体的过滤器,应在每批或多批次连续生产结束后对其进行完整性测试。
对于其他的应用,可以依据风险评估的结果,订立完整性测试的频率。
气体过滤器的完整性测试,可以使用低表面张力的液体润湿,进行起泡点或者扩散流/前进流的测试;也可以使用水侵入法测试。
水侵入法可作为优先选择。
对于冗余过滤,使用后应先对主过滤器进行完整性测试,假如主过滤器完整性测试通过,则冗余过滤器不需要进行完整性测试;假如主过滤器完整性测试失败,则需要对冗余过滤器进行完整性测试。
冗余过滤器完整性测试结果可作为产品放行的依据。
除菌过滤器使用前,应通过风险评估的方式确定是否进行完整性测试,以及测试哪一级过滤器或者两级过滤器都要进行检测,并确定在过滤器灭菌前还是灭菌后进行。
灭菌后的检测,应考虑确保两级过滤器之间的无菌性。
可依据工艺需要和实际条件,决议采用在线完整性测试或者离线完整性测试。
但应注意,完整性测试是检测整个过滤系统的完整性,而非仅针对过滤器自身。
在线测试能更好地保证上下游连接的完整性。
当无法满足在线测试条件时,可选择进行离线完整性测试。
此时应将过滤器保持在套筒中整体拆卸,并直接进行测试,不应将滤芯从不锈钢套筒拆卸单独测试。
考虑到完整性测试结果的客观性以及数据可靠性,应尽可能在关键使用点使用自动化完整性测试仪。
自动化完整性测试仪应在使用前,进行安装确认、运行确认和性能确认。

过滤器完整性试验完整性试验(integrity test)是过滤和超滤工作中必不可少的检测方法。
除菌滤器(滤膜或滤芯)或超滤器使用前后均需做完整性检测。
以此确认滤芯孔径、滤芯安装是否正确,滤芯受损情况及滤芯和厂家认证是否一致。
只有这样才能确保除菌或超滤有成功的把握。
尤其是经处理后重复使用的滤芯和超滤膜,更有必要在使用前后做相应的完整性检测。
完整性检测分破坏性检测和非破坏性检测两类。
厂家以颗粒挑战试验或细菌挑战试验来评价或验证滤芯的质量,因滤芯试验后滤膜被颗粒堵塞和污染而废弃,故称为破坏性检测。
用户常用的是非破坏性检测。
本节仅就非破坏性检测作一简介。
FDA认可的非破坏性检测方法有3种,即起泡点试验(bubble point test),扩散流试验(forward flow or diffusive flow test)和压力保持实验或压力衰减试验(pressure hold test or pressure decay test)。
通过非破坏性检测方法可以检测滤器性能,但前提必须是供货商提供经过破坏性试验验证的非破坏性试验标准合格值,否则检测数据无意义。
一、起泡点试验1.试验原理起泡点试验是最古老的试验方法,它是颇尔博士于1956年发明的,用于对微米级过滤器进行非破坏性完整检测(David B Patent3007334.Filed November 30.1956)。
其原理是基于毛细管(孔)模型,完全润湿的膜由于表面张力和毛细管压力的作用,使孔径内充满湿润液,当气体的压力达到一定程度液体充满润湿液的膜孔管压力时,液体则被压出膜孔外,然后气体也通过膜孔产生气泡。
气泡点压力是从完全润湿的膜中从最大孔径压出液体时的压力。
2.检测方法检测起泡点压力有两种方法:如在下游(滤器出口管)充满液体,缓慢加压后,下游管子流出的液量突然增加时,此时的压力即为起泡点压力;如在下游管子没有液体,缓慢加压后,至有连续不断的气泡流出,此时的压力即为起泡点压力,见下列示意图(图9-10)。


除菌过滤器测试方法和原理对于关键的除菌级过滤工艺而言,完整性测试是一种必要的手段,以确保过滤工艺的安全性。
通过完整性测试,可以确定过滤器自身的完整性及正确安装,可以确保工艺中安装了正确的过滤器,可以确定所安装的过滤器符合制造商提供的标准,还可以确保过滤系统的密闭性等等。
同时,进行完整性测试也是各国法规和审计的要求。
总体而言,完整性测试方法分为两大类,破坏性的和非破坏性的,下面将分别进行介绍。
破坏性测试对除菌级过滤器而言,破坏性测试是指细菌挑战测试,该测试方法是证明过滤器能够满足苛刻的除菌级过滤器标准的根本方法。
在细菌挑战测试中,需根据统计学原理从每批产品中抽取一定数量的样品,按照标准测试方法(如:ASTMF838-83),利用缺陷性假单胞菌溶液(BrevundimonasdiminutaATCC19146)进行细菌挑战测试,过滤器需要达到至少107CFU/cm2滤膜的细菌截留,才可认为该滤器为除菌级过滤器。
Millipore将破坏性完整性测试结果作为每批产品放行的放行标准。
而对于客户而言,则需要在除菌过滤器验证时进行细菌挑战测试,测试中采用实际工艺料液并在最差工艺条件下进行。
非破坏性测试非破坏性完整性测试方法主要包括基于毛细管原理的起泡点和HydroCorr(挤水法)测试,以及基于扩散原理的扩散流和保压测试。
下面分别做一下简单介绍:流测试。
而对于小面积滤器测试,由于扩散流很小,测量误差可能较大,推荐采用直接与孔径GasFlow关联的泡点测试。
DifferentialPressure保压测试保压测试,又称为压力衰减测试,实际上是基于扩散流测试原理的方法,该方法需要利用精密压力表测量过滤系统上游由于扩散流所导致的压力衰减。
以下为压力衰减公式:D=扩散流量Pa=大气压(1atm.or14.7psi)Vh=过滤系统上游体积P=压力衰减由于这种方法仅检测上游压力变化,从而避免了在滤器下游进行操作,可以方便的对灭菌后的过滤系统进行检测而不会破坏其无菌性。

医用过滤器完整性测试仪原理一,测试范围:全自动过滤器完整性测试仪是对过滤材质及过滤系统进行完整性测试的专用仪器,它可以进行气泡点和扩散流(前向流)及保压法测试,检测滤材及过滤系统的过滤精度及完整性。
测试方法满足FDA、国家药典及GMP规范中对除菌过滤器进行验证的要求。
单纯测定泡点值的方法并不能wan全确保滤膜、滤芯的滤菌截流能力合格,只有扩散流测试结果和细菌挑战实验结果有对应关系,所以必须结合扩散流方法综合评价,才能保证无菌过滤工艺的完整性。
圆片滤膜(Discmembrane):25至300的各种滤膜,折叠式滤芯,囊式滤芯及小型滤芯二,应用领域:药液除菌过滤器的完整性测试除菌空气过滤器的完整性测试制药用气体除菌过滤器的完整性测试储罐空气呼吸器的完整性测试制药用水使用点之前除菌过滤器的完整性测试三,执行标准JB/T20230—2023YYT1551.3YYT0770.1四,技术参数电源要求/功率:100-240VAC,50/60Hz;200瓦z大操作压力:9000mbar(145psi)z低进气压力:4000mbar(58psi)外型尺寸:400(宽)x390(深)x345(高)mm控制系统:PLC;操作界面:中英文切换;触摸屏:7寸彩色触摸屏威纶通测试范围:最大测试压力:100-8000mbar(1.5-116psi)可选择更大净体积测试精度:4%;气泡点精度:50mbar;扩散流精度:4%;操作条件:环境温度:+15℃~+35℃;相对湿度:10-80%;与PC机连接,可无限存储(选配)测试方法、时间:净体积测试:2min1min;快速扩散流测试:6min2min;单纯泡点测试:9min2min;泡点+扩散流测试:20min2min;打印功能:中文打印,输出测试参数、测试结果历史记录功能:存储500组测试结果(包括测试曲线)显示屏尺寸:5.7"TFT;单色串口连接方式:串行端口:RS232;可配置电脑数据可导出编辑。

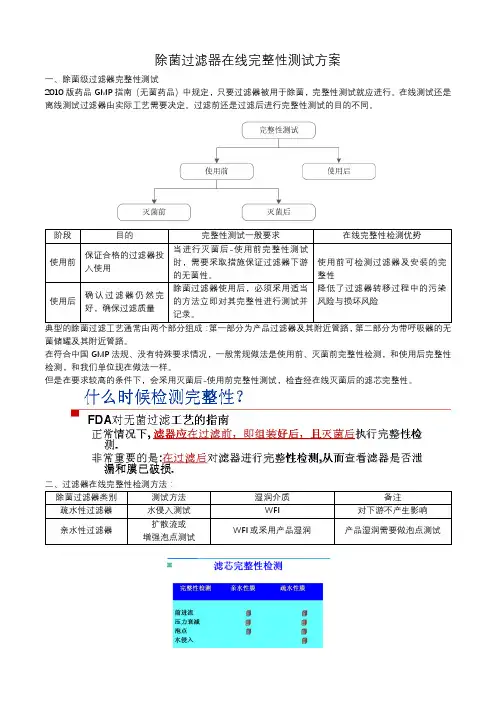
除菌过滤器在线完整性测试方案
一、除菌级过滤器完整性测试
2010版药品GMP 指南(无菌药品)中规定,只要过滤器被用于除菌,完整性测试就应进行。
在线测试还是离线测试过滤器由实际工艺需要决定。
过滤前还是过滤后进行完整性测试的目的不同。
典型的除菌过滤工艺通常由两个部分组成:
第一部分为产品过滤器及其附近管路,第二部分为带呼吸器的无菌储罐及其附近管路。
在符合中国
GMP 法规、没有特殊要求情况,一般常规做法是使用前、灭菌前完整性检测,和使用后完整性检测,和我们单位现在做法一样。
但是在要求较高的条件下,会采用灭菌后-使用前完整性测试,检查经在线灭菌后的滤芯完整性。
疏水性过滤器(呼吸器)完整性检测测试方法:水侵入测试
呼吸器在线完整性检测自动化方案成本高,也可以采用在线手动(湿润方式手工操作)完整性测试。
亲水性过滤器完整性检测测试方法:增强泡点测试
除菌液体过滤器及呼吸器在线完整性检测方案(粗略方案)
三、在线完整性检测功能改造需求:
增加湿润溶液储罐;
下游接收装置或管线(保证下游无菌,无二次污染风险);
呼吸器电加热保温夹套,确保疏水性滤芯完全灭菌;
用于完整性测试的管路,也必须进行灭菌;
需要对现有管路改造,在线灭菌后、在线完整性测试后,均需要洁净气体吹扫,视需要还可以进行系统保压;在线SIP、在线完整性测试,对自动化程度要求比较高,现场的手动阀门有很大一部分要改为自动控制;更多的冷凝水排放点,增加必要的阀门控制点,确保下游无菌,热动力式疏水阀应安装于水平管道上;
对纯蒸汽、洁净压缩空气等公用介质要求较高,应使用纯蒸汽发生器所产蒸汽,压缩空气应无油、干燥、露点低等,洁净压缩空气系统流程可参考下图。



液体除菌过滤器结构原理及完整性检测过滤器壳体通常由不锈钢或其他耐腐蚀材料制成,具有一定的强度和密封性。
壳体内部通常分为进口、出口和过滤室。
进口用于引入待过滤的液体,出口用于排出经过过滤的液体,而过滤室则是液体经过滤芯进行过滤的位置。
滤芯是液体除菌过滤器的核心部件,其质量和结构直接影响到过滤效果。
滤芯通常是由纤维材料编织而成,具有微孔结构,可以阻止细菌和污染物通过。
同时,滤芯表面通常会有静电或化学处理,以增加吸附能力,进一步提高过滤效果。
液体除菌过滤器的原理是通过滤芯对液体进行筛选和吸附,将细菌和污染物截留在滤芯表面或内部,从而使经过过滤的液体达到较高的清洁度。
具体来说,液体通过进口进入过滤室,被滤芯截留,并且在滤芯表面或内部发生吸附作用。
经过过滤的液体最终通过出口流出,而被截留的细菌和污染物则留在滤芯中,确保液体的纯净程度。
为了保证液体除菌过滤器的完整性,需要进行完整性检测。
完整性检测主要是检测滤芯是否存在损坏或组装不牢固等问题,以确保液体在经过过滤器时不会绕过滤芯而导致细菌和污染物的通过。
常用的完整性检测方法包括:1.漏气检测:通过在液体入口处施加一定的气体压力,检测是否有气体从其他部位泄漏出来。
如果有泄漏,则说明滤芯存在损坏或未组装好的问题。
2.光学检测:在滤芯表面涂上特定的荧光染料,然后使用紫外线或其他特定波长的光源照射滤芯表面。
如果滤芯有损坏,则染料会从损坏的地方渗出,形成明显的荧光斑点。
3.堵塞检测:通过在滤芯的入口处注入有颜色的颗粒物,然后观察出口处是否有颗粒物通过,以检测滤芯是否有堵塞的情况。
除了以上的完整性检测方法,还可以根据具体情况采用其他的检测手段,以确认液体除菌过滤器的完整性和过滤效果。
总之,液体除菌过滤器通过滤芯对液体进行筛选和吸附,使细菌和污染物被截留,从而保证液体的清洁度。
同时,为了确保其完整性,需要进行相应的完整性检测。
通过这样的结构、原理和完整性检测,液体除菌过滤器可以广泛应用于食品饮料、药品生产、实验室等领域,以保障液体的安全和纯净。
除菌过滤器微生物截留的试验分析除菌过滤器微生物截留的试验分析【摘要】目的:探讨非最终灭菌注射剂生产过程中除菌过滤器对微生物的截留效果,确认过滤除菌工艺的有效性与安全性。
方法:采用孔径为0.22μm除菌级聚醚砜滤芯,以直径在0.3~0.4μm的缺陷假单胞菌为生物指示剂,将菌液用滤芯过滤,计算被过滤液体过滤前的微生物数量与过滤后的微生物数量比的常用对数值(LRV)。
结果:菌液过滤前后微生物数量比的常用对数值LRV大于7。
结论:滤芯每平方厘米有效过滤面积符合中国药典2005年版2部附录ⅩⅦ灭菌法的规定,确认除菌过滤工艺在注射剂生产过程中的有效性与安全性。
【关键词】除菌过滤器;缺陷假单胞菌;微生物截留;无菌保证程度除菌过滤器在药品生产中主要用于无菌药品的除菌过滤,除菌过滤是药品生产过程中非常重要的.一种除菌方式,特别是对非最终灭菌的注射剂而言,除菌过滤是消除药液中微生物的唯一方法。
通过对除菌过滤器滤芯材质的选择、灭菌方法、完整性测试以及细菌的截留试验,确认除菌的效果,提高除菌过滤在注射剂生产过程中无菌保证程度重要性的认识。
1材料与方法1.1试验材料(1)滤芯:滤膜材质为聚醚砜,10英寸226卡式,孔径:0.22μm,级别:除菌级,滤膜面积:3600cm2。
来源:颇尔过滤器(北京)有限公司。
(2)全自动过滤器完整性测试仪:上海先维过滤设备厂,型号:212A。
(3)甘露醇:广西南宁化学制药有限公司,批号:0809110,配置20kg浓度为0.5%的水溶液。
(4)微生物指示剂:缺陷假单孢菌(ATCC19146直径0.3~0.4μm),北京鑫四环消毒技术开发中心。
(5)菌液浓度:每平方厘米应达到107个菌的挑战水平。
(6)培养基:硫乙醇酸盐流体培养基:北京三药科技开发公司,批号:081111;营养琼脂:广东环凯微生物科技有限公司,批号:200902081;营养肉汤:广东环凯微生物科技有限公司,批号:200901071。
除菌过滤器测试方法和原理对于关键的除菌级过滤工艺而言,完整性测试是一种必要的手段,以确保过滤工艺的安全性。
通过完整性测试,可以确定过滤器自身的完整性及正确安装,可以确保工艺中安装了正确的过滤器,可以确定所安装的过滤器符合制造商提供的标准,还可以确保过滤系统的密闭性等等。
同时,进行完整性测试也是各国法规和审计的要求。
总体而言,完整性测试方法分为两大类,破坏性的和非破坏性的,下面将分别进行介绍。
破坏性测试
对除菌级过滤器而言,破坏性测试是指细菌挑战测试,该测试方法是证明过滤器能够满足苛刻的除菌级过滤器标准的根本方法。
在细菌挑战测试中,需根据统计学原理从每批产品中抽取一定数量的样品,按照标准测试方法(如:ASTM F838-83),利用缺陷性假单胞菌溶液(Brevundimonas diminuta ATCC 19146)进行细菌挑战测试,过滤器需要达到至少107 CFU/cm2滤膜的细菌截留,才可认为该滤器为除菌级过滤器。
Millipore将破坏性完整性测试结果作为每批产品放行的放行标准。
而对于客户而言,则需要在除菌过滤器验证时进行细菌挑战测试,测试中采用实际工艺料液并在最差工艺条件下进行。
分类测试名称测试实施者
破坏性细菌挑战测试
制造商以及客户进
行验证时进行
非破坏性
起泡点测试,扩散测试,
HydroCorr 制造商出厂时及使用者现场进行
非破坏性测试
非破坏性完整性测试方法主要包括基于毛细管原理的起泡点和HydroCorr(挤水法)测试,以及基于扩散原理的扩散流和保压测试。
下面分别做一下简单介绍:
起泡点测试
起泡点测试基于毛细管模型。
滤膜的结构中充满了微孔流道,这些微孔流道就形成了很多“毛细管”,当滤膜被润湿液体完全润湿后,液体受到表面张力的作用而保留于滤膜内部,如果要想将液体挤出膜孔就需要外加一个气体压力。
能够克服表面张力将膜孔内的液体完全挤出时所需要的最小压力,就是滤膜的泡点值压力,也就是我们常说的起泡点,基于这种原理的测试方法,就是起泡点测试法。
这也是应用最为广泛的一种非破坏性完整性测试方法。
以下为泡点值计算公式:
P = 泡点压力
d = 孔径
k = 形状矫正因子
=液固接触角
=表面张力
泡点值直接与过滤器孔径相关联。
对滤膜而言,有很多微孔存在,每个孔的泡点值不一定完全一样,所以滤膜的泡点值指的是该滤膜可能的最大膜孔的泡点值,也即最大直径膜孔的泡点。
当达到泡点后,滤膜至少有一个孔会被吹干,气体会迅速通过该干燥的孔吹至膜下游,从下游气体流量的突变可以判断达到泡点了。
对大面积过滤器而言,由于扩散流较大,手工完整性测试中可能会影响人为泡点的判断,所以对于大面积滤器手工测试推荐采用扩散流测试;而对小面积过滤器,由于泡点与滤器孔径可以直接关联,推荐采用泡点测试。
HydroCorr测试
HydroCorr测试又称为“挤水法”,“水浸入法”。
该测试方法是基于水在疏水性滤膜表面存在表面张力和毛细管现象发展出来的。
把水压进最大的膜孔所需要的最小压力称为水侵入压力。
进行HydroCorr测试时的压力要低于水侵入压力,而对于一个完整的过滤器,将不会有水真正通过过滤膜进入下游。
Hydrocorr测试过程当中测定的是折叠过滤器结构尺寸上被挤压而产生的液面下降,形成的“表观”水流量。
d = 孔径
k = 形状矫正因子
=液固接触角
г=表面张力
HydroCorr是一种高度灵敏,不用醇类而根据水流量进行疏水性滤膜完整性测试的方法。
由于滤膜没有被润湿,几乎是干燥的,所以可以在完整性测试结束后马上投入使用而只需要最少的或不需要干燥工作。
扩散流测试
扩散流测试基于溶解-扩散模型。
当滤膜被润湿液体完全润湿后,如果在过滤器的上游存在压缩气体,而该压缩气体的压力值又小于泡点压力时,滤膜仍然是完全润湿的。
由于压缩气体一侧的气体浓度会高于常压一侧,此时气体分子会从高压测溶解到润湿液体中并扩散至常压测,如果在下游接一根管子会发现有气体缓慢流出,这就是扩散流,通过检测扩散流的完整性测试方法称为扩散流测试。
气体的扩散符合Fick定律,扩散流量与滤膜两侧压差和膜面积成正比,为了消除测试压力不同所带来的影响,扩散流测试都在固定的压力下进行(通常为泡点值的80%)。
以下为扩散流计算公式:
K = 扩散/溶解系数
P1, P2 = 两侧压差
P = 滤膜开孔滤
L = 膜有效流道长度
A = 膜面积
DF = 扩散流
通过在测试压力下测量气体扩散流量可以测量扩散流,但是扩散流与滤膜孔径无关。
对于大面积滤器而言不会影响扩散流测试结果的判断,所以对于大面积过滤器而言,推荐采用扩散
流测试。
而对于小面积滤器测试,由于扩散流很小,测量误差可能较大,推荐采用直接与孔径关联的泡点测试。
保压测试
保压测试,又称为压力衰减测试,实际上是基于扩散流测试原理的方法,该方法需要利用精密压力表测量过滤系统上游由于扩散流所导致的压力衰减。
以下为压力衰减公式:
D =扩散流量
T = 时间
Pa = 大气压(1 atm. or 14.7 psi)
Vh = 过滤系统上游体积
P = 压力衰减
由于这种方法仅检测上游压力变化,从而避免了在滤器下游进行操作,可以方便的对灭菌后的过滤系统进行检测而不会破坏其无菌性。
需要注意的是,非破坏性完整性测试本身只能反压膜的物理特性。
一种非破坏性完整性测试必须和破坏性测试如细菌挑战试验相关联,即通过非破坏性测试的过滤器必须通过破坏性测试如细菌挑战试验的验证进行关联,才可以使非破坏性完整性测试标准与除菌功能相关联。