【精品试卷】高考一轮复习钠及其化合物的化学方程式和离子方程式(复习必备)
- 格式:docx
- 大小:29.52 KB
- 文档页数:8

高三一轮复习化学方程式汇总一、钠及其化合物1、钠与氧气常温下反应2、钠与氧气加热反应3、钠与氯气反应4、钠与硫反应5、钠与水反应6、将钠投入硫酸铜溶液7、将钠投入氯化铁溶液中8、钠与盐酸反应9、钠与乙醇反应10.氧化钠与水反应11、氧化钠与二氧化碳反应12、氧化钠与盐酸13、过氧化钠与水14、过氧化钠与二氧化碳15、过氧化钠与盐酸16、碳酸钠与与少量盐酸17、碳酸钠与过量盐酸18、向碳酸钠溶液中通入二氧化碳19、碳酸钠溶液与石灰水反应20、碳酸钠溶液与氯化钡反应21、碳酸氢钠与硫酸反应22、碳酸氢钠与氢氧化钠23、碳酸氢钠与少量石灰水24、碳酸氢钠与过量石灰水反应25、碳酸氢钠受热分解26、氢氧化钠溶液与少量二氧化碳27、氢氧化钠溶液与过量的二氧化碳二、铝及其化合物1、铝与氧气反应2、铝与氯气3、铝与硫反应4、铝与硫酸反应5、铝与氢氧化钠溶液6、氧化铝与盐酸7、氧化铝与氢氧化钠8、电解熔融的氧化铝9、氢氧化铝与盐酸10、氢氧化铝与氢氧化钠反应11、硫酸铝与氨水反应12、向偏铝酸钠溶液中通少量二氧化碳13、向偏铝酸钠溶液中通入过量二氧化碳14、氯化铝与偏铝酸钠溶液反应15、向氯化铝溶液中加入过量氢氧化钠16、向偏铝酸钠溶液中加入少量盐酸17、向偏铝酸钠溶液中加入过量盐酸18、明矾的化学式及明矾净水原理的离子方程式19、氢氧化铝受热分解三、铁及其化合物1、铁与氧气2、铁与氯气3、铁与硫4、铁与溴蒸汽5、铁与水蒸气6、铁与硫酸铜7、铁与氯化铁8、铁与醋酸反应9、铁与过量的稀硝酸反应(产物NO)10、铁与少量的稀硝酸反应(产物NO)11、氧化亚铁与盐酸12、氧化亚铁与稀硝酸13、氧化铁与盐酸14、氧化铁与氢碘酸15、四氧化三铁与盐酸16、氢氧化铁与盐酸17、氢氧化亚铁与盐酸18、氯化铁与氨水19、氯化亚铁与氨水20、氯化亚铁与氢氧化钠21、氢氧化亚铁被氧气氧化22、氯化铁与硫氰化钾23、氯化铁与铜反应24、氯化铁与硫化氢25、氯化铁与碘化钾26、氯化铁溶液中通二氧化硫27、氯化亚铁与氯气反应28、氯化亚铁与溴水29、氯化亚铁与稀硝酸30、氯化亚铁与锌反应四、铜及其化合物1、铜与氧气2、铜与硫反应3、铜的表面生成铜绿4、碱式碳酸铜与硫酸反应五、氯气及其化合物。
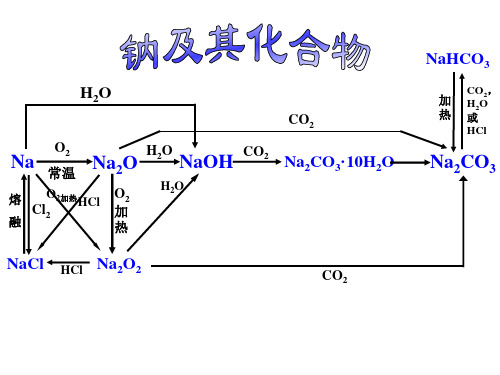

1.钠在常温与氧气4Na+O 2=2Na 2O 2.钠在空气中加热燃烧2Na+O 2=Na 2O 23.钠和水2Na+2H 2O=2NaOH+H 2↑4.钠和足量盐酸2Na+2HCl=2NaCl+H 2↑5.钠和少量盐酸2Na+2HCl=2NaCl+H 2↑2Na+2H 2O=2NaOH+H 2↑6.钠和氢氧化钠溶液2Na+2H 2O=2NaOH+H 2↑7.钠和氯化钠溶液2Na+2H 2O=2NaOH+H 2↑8.钠和硫酸铜溶液2Na+2H 2O=2NaOH+H 2↑2NaOH+CuSO 4=Cu(OH)2↓+Na 2SO 49.钠和硝酸铁溶液2Na+2H 2O=2NaOH+H 2↑Fe(NO 3)3+3NaOH=Fe(OH)3↓+3NaNO 310.钠和氯化镁溶液2Na+2H 2O=2NaOH+H 2↑MgCl 2+2NaOH=Mg(OH)2↓+2NaCl 11.钠和氯化铵溶液2Na+2H 2O=2NaOH+H 2↑NH 4Cl+NaOH=NH 3↑+NaCl+H 2O12.钠的制备2NaCl(熔融)=2Na+Cl 2↑13.过氧化钠与水2Na 2O 2+2H 2O=4NaOH+O 2↑14.过氧化钠与二氧化碳2Na 2O 2+2CO 2=2Na 2CO 3+O 215.过氧化钠与盐酸2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑16.小苏打受热分解2NaHCO 3=Na 2CO 3+H 2O+CO 2↑17.盐酸滴入苏打溶液中Na 2CO 3+HCl=NaCl+NaHCO 3NaHCO 3+HCl=NaCl+H 2O+CO 2↑18.少量苏打溶液滴入盐酸中Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑19.过量苏打溶液滴入盐酸中Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑20.小苏打溶液滴入盐酸中NaHCO 3+HCl=NaCl+H 2O+CO 2↑21.等物质的量的小苏打溶液滴入澄清石灰水中NaHCO 3+Ca(OH)2=CaCO 3↓+NaOH+H 2O 22.二氧化碳通入苏打溶液中CO 2+Na 2CO 3+H 2O=2NaHCO 323.足量二氧化碳通入饱和苏打溶液中CO 2+Na 2CO 3+H 2O=2NaHCO 3↓24.少量二氧化碳通入氢氧化钠溶液CO 2+2NaOH=Na 2CO 3+H 2O25.足量二氧化碳通入氢氧化钠溶液CO 2+NaOH=NaHCO 3一、钠及其化合物△/点燃电解△。

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
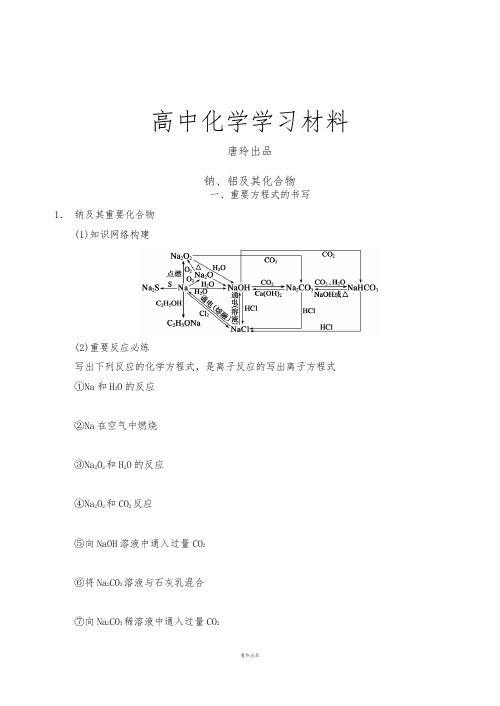
高中化学学习材料唐玲出品钠、铝及其化合物一、重要方程式的书写1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式①Na和H2O的反应②Na在空气中燃烧③Na2O2和H2O的反应④Na2O2和CO2反应⑤向NaOH溶液中通入过量CO2⑥将Na2CO3溶液与石灰乳混合⑦向Na2CO3稀溶液中通入过量CO2⑧向饱和Na2CO3溶液中通入过量CO2气体⑨将NaHCO3溶液和NaOH溶液等物质的量混合⑩将NaHCO3溶液与澄清石灰水等物质的量混合⑪将NaHCO3溶液与少量澄清石灰水混合⑫电解饱和食盐水2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应②Al(OH)3和NaOH溶液的反应③Al(OH)3和盐酸的反应④Al2O3和NaOH的反应⑤Al2O3和盐酸的反应⑥NaAlO2和过量盐酸的反应⑦向NaAlO2溶液中通入过量CO2气体⑧将NaAlO2与NaHCO3混合⑨将NaAlO2与AlCl3溶液混合⑩向AlCl3溶液中加入过量NaOH溶液⑪向AlCl3溶液中加入过量氨水⑫将AlCl3溶液与NaHCO3溶液混合二、值得强化记忆的实验现象1.钠和水反应的实验现象2.钠和乙醇反应的实验现象3.钠和水、煤油混合物反应的实验现象4.将水滴入用脱脂棉包住的Na2O2中,有什么现象?5.向AlCl3溶液中逐滴加入NaOH溶液,有什么现象?6.将NaHCO3溶液与AlCl3溶液混合7.将一小块钠放入CuSO4溶液中,有什么现象?8.将过量Na2O2粉末逐渐加入到AlCl3溶液中,有什么现象?三、简答类语言规范再落实1.怎样从试剂瓶中取用金属钠?2.焰色反应的操作步骤是什么?怎样观察钾的焰色反应?3.不用试剂,怎样鉴别Na2CO3溶液和稀盐酸?4.试用一种试剂鉴别NaCl、AlCl3、MgCl2三种溶液,简述操作步骤。

高三化学一轮复习方程式专练钠及其化合物1.钠与氧气:常温:点燃:钠与氯气:2.钠与硫反应(加热)3.钠与水反应:_________ ___________离子方程式:_______________ _____________4.钠与硫酸反应:离子方程式:__________ _____________5.钠与硫酸铜溶液反应:离子方程式:__________ _____________ 钠与氢氧化钙溶液反应:离子方程式:__________ _____________6.工业上制取金属钠:___________ ___7.氧化钠与水反应:_______________ ____________8.过氧化钠与二氧化碳反应:9.过氧化钠与水反应: _离子方程式:______ ______ ____ 10.NaOH溶液中通入少量CO2:离子方程式:__ 11.NaOH溶液中通入过量CO2:离子方程式:___________ __ ________12. NaOH溶液与氯化铵溶液共热:离子方程式:__________ _ __________ 13. NaOH溶液中加入少量氯化铝溶液:离子方程式:__________ _ __________ 14. 氯化铝溶液中加入少量NaOH溶液:离子方程式:___________15.NaOH溶液中吸收氯气:离子方程式:___________ ________16.NaOH溶液中加入铝片:离子方程式:___________ _ _________ 氢氧化钠不能用玻璃塞的玻璃瓶存放:离子方程式:__________ _ __________ 17.氢氧化钠的制取(氯碱工业)离子方程式:___________ __________ 18.向碳酸钠溶液滴入少量稀盐酸:离子方程式向稀盐酸滴入少量碳酸钠溶液:离子方程式19.除去碳酸氢钠溶液中混有的碳酸钠:离子方程式:20.碳酸钠与氢氧化钙:离子方程式:21.碳酸氢钠与盐酸:离子方程式:22.少量碳酸氢钠溶液滴入氢氧化钙溶液中:离子方程式:少量氢氧化钙溶液滴入碳酸氢钠溶液中:离子方程式:23.除去碳酸钠溶液中的碳酸氢钠:离子方程式:24.除去碳酸钠固体中的碳酸氢钠:离子方程式:25.鉴别碳酸钠和碳酸氢钠溶液:离子方程式:26.碳酸氢钠溶液与氯化铁溶液反应离子方程式:27.碳酸氢钠溶液与氯化铝溶液反应离子方程式:。
2021届高三化学一轮复习——钠及其重要化合物目标要求 1.结合真实情景中的应用实例或通过实验探究,了解钠及其重要化合物的主要性质,了解其在生产、生活中的应用。
2.结合实例认识钠及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。
2.从钠原子的原子结构认识钠的化学性质——还原性Na――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +(1)与非金属单质(如O 2、Cl 2)的反应O 2⎩⎨⎧常温:4Na +O 2===2Na 2O加热:2Na +O 2=====△Na 2O 2Cl 2:2Na +Cl 2=====点燃2NaCl (2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡或煤油中。
4.钠的用途(1)钠钾合金(液态)可用于原子反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na +TiCl 4=====熔融4NaCl +Ti 。
(1)在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na 2O 2( ) (2)金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( ) (3)钠表面自然形成的氧化层能够保护内层金属不被空气氧化( ) (4)金属钠具有强还原性,可与TiCl 4溶液反应制取金属Ti( ) (5)根据反应Na +KCl熔融NaCl +K ↑,知Na 的金属性强于K( )(6)实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶( )(7)钠能置换出醇羟基中的氢,所以将一小块钠放入乙醇中,能产生气泡( ) (8)将钠放入盛有水和煤油的烧杯中,钠处于煤油和水的交界上下浮动( ) 答案 (1)√ (2)× (3)× (4)× (5)× (6)√ (7)√ (8)√题组一 钠与氧气反应的特点 1.下列叙述正确的是( )A .切开的金属Na 暴露在空气中,光亮表面逐渐变暗2Na +O 2===Na 2O 2B .一定条件下,2.3 g 的Na 完全与O 2反应生成3.6 g 产物,失去的电子数为0.2N AC .钠在空气中受热时,熔化为银白色的小球,产生黄色的火焰,生成白色粉末D .钠在空气中长期放置,最终主要生成物为碳酸钠 答案 D解析 钠在通常条件下反应生成氧化钠,点燃条件生成过氧化钠,故A 错误;2.3 g 钠的物质的量为0.1 mol ,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1 mol 钠失去0.1N A 电子,故B 错误;钠在空气中加热,生成了淡黄色的过氧化钠,故C 错误;钠在空气中长期放置,开始生成氧化钠,最终变成了碳酸钠,故D 正确。
钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠122Na2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-2O SiO32-2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
第1节 钠及其化合物[考试说明] 1.掌握钠的主要性质及其用途。
2.了解钠的重要化合物的主要性质及其用途。
3.了解钠及其重要化合物的制备方法。
[命题规律] 钠及其化合物是高考化学中的基本知识之一,是高考的常考点,主要的考查形式有:结合阿伏加德罗常数、氧化还原反应以选择题形式考查Na 与H 2O 、Na 与O 2及Na 2O 2与H 2O 、CO 2反应的特点及电子转移情况;以选择题型考查Na 2O 2与H 2O 、CO 2反应的有关计算和Na 2CO 3与NaHCO 3稳定性的比较等;以Na 2O 2与H 2O 、Na 2O 2与CO 2、Na 2CO 3和NaHCO 3与盐酸反应为载体,设计实验以填空题型考查。
考点1 钠的性质及应用知识梳理 1.钠的物理性质2.钠的化学性质从原子结构认识钠的化学性质:Na――→Cl 2、O 2、H 2O 、H +等Na +(1)主要化学性质(2)钠与水(含酚酞)反应的实验现象及解释3.钠的制取及保存(1)制取:化学方程式为□232NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在□24煤油中。
4.钠的用途(1)制取Na 2O 2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作□25高压钠灯。
(4)冶炼某些金属。
金属钠具有强的□26还原性,熔融状态下可以用于制取金属,如4Na+TiCl 4=====熔融4NaCl +Ti 。
5.焰色反应(1)金属钠着火,不能用水、泡沫灭火器灭火,应用干燥的沙土盖灭。
(2)钠与水、酸、盐溶液反应的本质与顺序:本质上均是与H +的反应,反应顺序是“有酸酸在前、无酸水为先”。
(3)工业上在850 ℃,钠与熔融状态的KCl 反应可以制取金属钾:Na(l)+KCl(l)=====850 ℃NaCl(l)+K(g),反应发生是因为在反应温度下,体系中只有钾是气体,能从体系中逸出,利于反应进行,该反应不能说明金属钠的还原性强于金属钾。
高中化学学习材料(灿若寒星**整理制作)钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O 4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O 14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。