影响电离平衡的因素3
- 格式:doc
- 大小:45.50 KB
- 文档页数:2

【高中化学】高中化学电离平衡与浓度的关系电离平衡是高中化学必修的一个专题,电离均衡与浓度的关系就是比较容易认知的知识点,备考强电解质还难一些,强电解质可以给大家增添很多疑惑,下面就强电解质和强电解质及其电离均衡予以系统剖析,协助大家更好地熟习电离均衡科学知识。
1强电解质和弱电解质(1)电离均衡在一定条件下(如温度、浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,叫电离平衡。
(2)电离均衡特点①动态平衡:电离过程和分子化过程并未停止。
②紧固维持不变:在一定条件下均衡创建后,溶液中弱电解质分子及其电离出来的各离子浓度都将维持维持不变。
③相对性:平衡建立在特定的条件下,当条件发生改变时,平衡发生相应的移动?(3)影响强电解质电离程度大小的因素a、决定因素:弱电解质的相对强弱弱电解质的相对强弱;(决定)电离程度的大小(判断)弱电解质的相对强弱与弱电解质分子结构有关,取决于其分子中共价键的极性强弱,是该电解质分子的“本性”。
b、环境因素①浓度的影响:对于同一强电解质,通常溶液越稀,电离程度越大;将溶液吸收时,电离均衡向着电离方向移动,电离程度变小小,溶液中各离子物质的质变小,但离子浓度变大(溶液体积变小的缘故)②温度影响:弱电解质的电离过程一般是吸热的,△h>0.升高温度电离平衡向着电离方向移动,即电离程度增大。
(讲到电离度时必须指明条件(温度、浓度),温度若不注明,一般为25℃)③重新加入具备相同离子物质(同离子效应)在弱电解质中加入与弱电解质相同离子的强电解质,电离平衡逆向移动?④化学反应(4)电离平衡常数在强电解质溶液中重新加入能够与强电解质电离产生的某种离子出现反应的物质,可以并使电离均衡向电离的方向移动。
a、定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度乘积跟溶液中未电离的分子浓度的比是一个常数,这个常数叫电离平衡常数,简称电离常数,用k表示(酸用ka表示,碱用kb表示)b、电离常数的影响因素①电离常数随其温度变化而变化,但由于电离过程中热效应较小,温度发生改变对电离常数影响并不大,其数量及通常维持不变,所以室温范围内可以忽略温度对电离常数的影响。

高中化学电离平衡九大知识点一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4 为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。
4、影响电离平衡的因素:A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。
)表示方法:ABA++B- Ki=[ A+][B-]/[AB]7、影响因素:a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。
如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO二、水的电离和溶液的酸碱性1、水电离平衡:水的离子积:KW= c[H+]·c[OH-]25℃时,[H+]=[OH-] =10-7 mol/L ; KW= [H+]·[OH-] = 1*10-14注意:KW只与温度有关,温度一定,则KW值一定KW不仅适用于纯水,适用于任何溶液(酸、碱、盐)2、水电离特点:(1)可逆(2)吸热(3)极弱3、影响水电离平衡的外界因素:①酸、碱:抑制水的电离 KW〈1*10-14②温度:促进水的电离(水的电离是吸热的)③易水解的盐:促进水的电离 KW 〉1*10-144、溶液的酸碱性和pH:(1)pH=-lgc[H+](2)pH的测定方法:酸碱指示剂——甲基橙、石蕊、酚酞。


影响电离平衡知识点总结一、电离平衡的基本概念1.1 电离在溶液中,部分物质会发生电离。
电离是指化合物在水溶液中分解成阳离子和阴离子的过程。
比如HCl分解成H+和Cl-。
一般来说,电离是由一些强酸、强碱和强电解质引起的。
1.2 电离平衡当溶质发生电离后,生成的阳离子和阴离子会相互吸引,形成一个平衡状态,这就是电离平衡。
在电离平衡状态下,溶液中的阳离子和阴离子的浓度保持一定的比例。
1.3 离子浓度在电离平衡中,溶液中阳离子和阴离子的浓度是非常重要的参数。
通过测定溶液中离子的浓度,可以计算溶液的pH值、酸度和碱度等重要参数。
1.4 平衡常数电离平衡可以用平衡常数(K)来描述。
平衡常数是指反应达到平衡时,反应物浓度的倒数积与生成物浓度的倒数积的比值。
平衡常数越大,说明反应向生成物的方向偏移得越厉害,平衡越偏向生成物方向;反之,平衡常数越小,说明反应倾向于反应物的方向,平衡越偏向反应物方向。
平衡常数的大小反映了电离平衡的稳定程度。
1.5 影响电离平衡的因素影响电离平衡的因素很多,包括温度、压力、物质浓度等因素。
这些因素会影响溶液中离子的生成和消失速率,从而影响电离平衡的位置和稳定性。
对于了解和控制电离平衡具有重要意义。
二、电离平衡在酸碱中和中的应用2.1 酸碱中和反应在溶液中,酸和碱会发生中和反应,生成盐和水。
在这一过程中,溶液中的氢离子和氢氧根离子的浓度会发生变化,从而影响电离平衡的位置。
通过酸碱中和反应,可以调节溶液的pH值,从而影响化学反应的进行和物质的性质。
2.2 酸度和碱度在酸碱中和过程中,溶液的酸度和碱度会发生变化。
酸度和碱度是描述溶液中酸碱性质的重要指标,它们会影响溶液的化学反应和化学性质。
电离平衡的位置和稳定性对于酸度和碱度都有重要影响。
2.3 pH值pH值是描述溶液酸碱性的重要参数。
pH值与溶液中的氢离子浓度有直接的关系,可以通过测定溶液的pH值来了解电离平衡的状态和溶液的酸碱性质。
控制溶液的pH值对于许多化学反应和生物过程都具有重要的意义。

⾼中化学:离⼦平衡的必考知识点概念(1)电解质:在⽔溶液⾥或熔融状态下能导电的化合物⾮电解质:在⽔溶液⾥和熔融状态下都不能导电的化合物①电解质和⾮电解质均指化合物,单质和混合物既不属于电解质也不属于⾮电解质。
②电解质必须是⾃⾝能直接电离出⾃由移动的离⼦的化合物。
③对于电解质来说,只须满⾜⼀个条件即可,⽽对⾮电解质则必须同时满⾜两个条件。
例如:H2SO4、NaHCO3、NH4Cl、Na2O、Na2O2、Al2O3(2)强电解质:溶于⽔或熔融状态下⼏乎完全电离的电解质弱电解质:溶于⽔或熔融状态下只有部分电离的电解质①电解质的强弱与化学键有关,但不由化学键类型决定。
强电解质含有离⼦键或强极性键,但含有强极性键的不⼀定都是强电解质,如H2O、HF等都是弱电解质。
②电解质的强弱与溶解度⽆关。
如BaSO4、CaCO3等③电解质的强弱与溶液的导电能⼒没有必然联系。
判断(1)物质类别判断:强电解质:强酸、强碱、多数盐、部分⾦属氧化物弱电解质:弱酸、弱碱、少数盐和⽔⾮电解质:⾮⾦属氧化物、氢化物(酸除外)、多数有机物单质和混合物(不是电解质也不是⾮电解质)(2)性质判断:熔融导电:强电解质(离⼦化合物)均不导电:⾮电解质(必须是化合物)(3)实验判断:①测⼀定浓度溶液pH ②测对应盐溶液pH③⼀定pH溶液稀释测pH变化④同等条件下测导电性电解质溶液的导电性和导电能⼒①电解质不⼀定导电(如NaCl晶体、⽆⽔醋酸),导电物质不⼀定是电解质(如⽯墨),⾮电解质不导电,但不导电的物质不⼀定是⾮电解质。
②强电解质溶液导电性不⼀定⽐弱电解质强。
饱和强电解质溶液导电性不⼀定⽐弱电解质强。
弱电解质的电离平衡定义和特征:1.、电离平衡的含义:在⼀定条件(如温度、浓度)下,弱电解质分⼦电离成离⼦的速率与离⼦结合成分⼦的速率相等,溶液中各分⼦和离⼦的浓度都保持不变的状态叫电离平衡状态。
任何弱电解质在⽔溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最⼤电离程度。

考点十六电离平衡知识点讲解【知识讲解】一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中和熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
电解质——离子化合物和部分共价化合物非电解质——大多数共价化合物注意:①电解质、非电解质都是化合物②SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)2、弱电解质的电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程就达到了平衡状态,这叫电离平衡。
3、影响电离平衡的因素:①温度:电离一般吸热,升温有利于电离。
②浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
③同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会抑制电离。
④其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,则促进电离。
4、电离方程式的书写:用可逆符号,多元弱酸的电离要分步写(第一步为主)5、电离平衡常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。
)表示方法:AB A++B- K=电离平衡常数的影响因素:a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响。
c、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。
典例1(2018届山西省大同市第一中学高三11月月考)常温下,有盐酸和醋酸两种溶液,c(Cl-)=c(CH3COO-),下列叙述正确的是A. 用该醋酸和盐酸做导电性实验,盐酸的灯泡更亮。
B. 用水稀释相同倍数后醋酸溶液的pH小于盐酸C. 分别用水稀释相同倍数后,所得溶液中:c(Cl-)=c(CH3COO-)D. 醋酸溶液的pH大于盐酸【答案】B典例2(2019届浙江省杭州市建人高复高三上学期第一次月考)25℃时,甲、乙两烧杯分别盛有5mLpH=1的盐酸和硫酸,下列描述中不正确的是A.物质的量浓度:c甲=2c乙B.水电离出的OH-浓度:c(OH-)甲=c(OH-)乙C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙D.将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1【答案】D【解析】盐酸是一元强酸,硫酸是二元强酸,其pH相等说明氢离子浓度相等。


电离平衡移动的影响因素电离平衡,听起来就有点高大上对吧?但实际上,它和我们的生活息息相关,没那么复杂。
想象一下,你在夏天的海边,阳光明媚,海风轻拂,喝着冰凉的椰子水,心情瞬间好到爆。
这时候,如果把“电离平衡”想象成一个海洋,那就是这个海洋里的水分子在不停地变化,水面上时而波光粼粼,时而又变得平静如镜。
电离平衡就像这个大海,里面的成分在不断地移动,受各种因素的影响,真是活灵活现。
要说的就是温度的影响。
想象一下,冬天的北风瑟瑟,空气冷得让人直打哆嗦。
这时候,你的热水壶里煮水的声音多么诱人啊!一旦水变热,分子们就像是被施了魔法,跳得欢快得不得了。
电离平衡同样如此,温度升高,反应速度加快,分子运动得更加剧烈,电离的程度也随之增加。
要是温度降低,那就像是海水变成了冰,分子们乖乖地呆在原地,不再活跃了。
哎,这可真是电离平衡里的冷暖变化,变化无常,让人琢磨不透。
再来聊聊浓度,这可是影响电离平衡的重要角色。
想象一下,街上人来人往,热闹非凡。
而如果某个地方人特别少,感觉冷清得很。
浓度高的时候,电离反应会更容易发生,就像一大堆人在一起,大家互相交流,气氛热火朝天;反之,当浓度低时,反应就变得慢吞吞的,像是在开慢车,甚至可能让人觉得无聊。
想要提高反应速度,增加浓度就是个不错的主意。
这就像在派对上,如果人人都在热聊,那氛围简直炸裂。
说说压力。
哈哈,听起来像是工作上的烦恼,其实在化学中也有大用处。
对于气体反应来说,压力的变化可不是小事。
想象一下,你在一个小房间里,突然来了一大堆朋友,瞬间空气都变得紧张了。
电离平衡也是一样,压力升高,气体分子被挤得更紧,碰撞频率增加,自然反应也就加速了。
想想看,哪种情况更容易产生化学反应?当然是那种“人多好办事”的局面。
压力低时,气体分子自由得多,反应速度就会放慢,简直是让人懒洋洋的状态。
然后,还有一个不可忽视的因素——催化剂。
这个就像是派对上的DJ,能够调动全场的气氛。
催化剂参与反应,但本身又不被消耗,真是太神奇了。
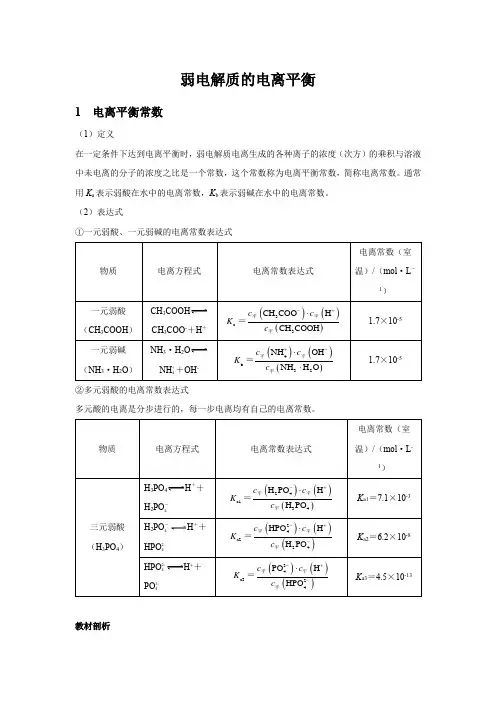
弱电解质的电离平衡1 电离平衡常数(1)定义在一定条件下达到电离平衡时,弱电解质电离生成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数,简称电离常数。
通常用K a表示弱酸在水中的电离常数,K b表示弱碱在水中的电离常数。
(2)表达式①一元弱酸、一元弱碱的电离常数表达式CH3COOHCH3COO-+H+NH3·H2ONH ++OH-4②多元弱酸的电离常数表达式多元酸的电离是分步进行的,每一步电离均有自己的电离常数。
H3PO4H++H2PO-4H2PO-H++4HPO2-4H++HPO2-4PO3-4教材剖析【教材P98】 “多元弱酸的各级电离常数逐级减小。
对于各级电离常数相差很大的多元弱酸,其水溶液中的H +主要是由第一步电离产生的。
”【教材剖析】 多元弱酸第一步电离出H +后,剩余的酸根离子带负电荷,对H +的吸引力增强,使其电离出H +更困难,故一般K a1>>K a2>>K a3……。
因此计算多元弱酸溶液中的c (H+)或比较弱酸酸性的相对强弱时,通常只考虑第一步电离。
(3)意义电离常数表征了弱电解质的电离能力,根据相同温度下电离常数的大小可以判断弱电解质电离能力的相对强弱。
弱酸的电离常数越大,弱酸电离出H +的能力就越强,酸性也就越强;反之,酸性越弱。
如:名师提醒(1)电离常数服从化学平衡常数的一般规律,只受温度的影响。
(2)电离常数相对较大、电离能力较强的弱电解质,其溶液的导电能力不一定强。
这是因为溶液的导电能力与溶液中的离子浓度和离子所带电荷数有关。
(3)相同温度下,等浓度的多种一元弱酸溶液,弱酸的电离常数越大,溶液中c (H +)越大,溶液的导电能力也就越强。
2 电离度(1)定义弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已电离的和未电离的)的百分率称为电离度,通常用α表示。


电离平衡(简化版)一 电离平衡:1 定义:在一定条件下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态。
2 影响电离平衡的因素:⑴浓度:减小溶液浓度,电离程度增大;增大溶液浓度,电离程度减小。
⑵温度:电离过程是一个吸热过程。
升高温度,电离程度增大;降低温度,电离程度减小。
⑶外加试剂:①向弱酸或弱碱溶液中加入强酸或强碱,则抑制电离。
②向弱酸或弱碱溶液中加入能够与其自己电离出来的某种粒子发生化学反应的物质时,就可使其电离平衡向电离的方向移动。
二 水的电离:1 定义:2H2OH 3O ++OH -或H 2OH ++OH -(水的电离过程是可逆的、吸热的。
)由水分子电离出的H +、OH -数目相等2 水的离子积:在一定温度时,水中C(H +)和C(OH -)的乘积是一个常数,称之为水的离子积常数 K w =C(H +)•C(OH -)25℃时,C(H +)=C(OH -)=1×10-7 mol/L, K w =1×10-14 100 ℃时, C(H +)=C(OH -)=1×10-6 mol/L, K w =1×10-12水的离子积是水电离平衡时具有的性质。
如酸、碱、盐溶液中都有K w =C(H +)•C(OH -) =1×10-14。
其中C(H +)、C(OH -)均表示整个溶液中的C(H +)和C(OH -)。
3影响水电离平衡的因素:⑴温度:升高温度,平衡右移。
)()(-+OH C H C 、增大。
⑵加入酸碱:抑制电离,平衡左移。
][)()(-+OH C H C 增大,W K 不变。
⑶加入活泼金属:置出2H ,平衡右移。
⑷加入弱碱阳离子或弱酸根阴离子:促进电离,平衡右移。
)()(-+OH C H C 或降低。
4 溶液的pH 的计算方法:Ⅰ简单的酸碱溶液的pH 的计算pH H C C →→+)()(酸⑴强酸:pH H C OH C C w K →−→−→+-)()()(碱⑵强碱:Ⅱ稀溶液混合后pH 的计算⑴强酸与强酸混合)()(21++→→H C C H C C 强酸Ⅱ:强酸Ⅰ: pH V V V H C V H C H C →+∙+∙=→+++212211)()()(混 若等体积混合,则混合液pH 混=pH 小+0.3 ⑵强碱与强碱混合2211)()(--→→OH C C OH C C 强碱Ⅱ:强碱Ⅰ:pH H C OH C wK →−→−→+-)()(混若等体积混合,则混合液pH 混=pH 大-0.3 ⑶强酸与强碱混合7p =H 反应,溶液成中性,①强酸与强碱恰好完全中和反应的结果,pH 不一定等于7pH OH V H V OH V OH C H V H C H →+-=-+--+++)()()(·)()(·)()(.C 余②酸过量pHOH C K H C OH V H V H V H C OH V OH C OH W →=→+-=-+-+++---余余③碱过量)()()()()(·)()(·)()(.C ⑷酸碱溶液用水稀释n pH pH H C n n+=+原稀减小为原来的倍,①强酸溶液每稀释,101)(10 n pH pH OH C n n -=-混稀减小为原来的倍,②强碱溶液每稀释,101)(10).7(71008)7(71006.7p 不能小于合液倍,混溶液稀释的;不能大于倍,混合液溶液稀释的如稀释时,③强酸与强碱溶液无限≈=≈=≈pH NaOH pH pH HCl pH H n pH pH H C n ++原混<减小的程度比强酸小,倍,④弱酸溶液每稀释)(10 n pH pH OH C n --原混>减小的程度比强碱小,倍,⑤弱碱溶液每稀释)(10⑸酸与碱之和为14,等体积混合①若为强酸与强碱,则pH=7 ②若为强酸与弱碱,则pH >7 ③若微弱酸与强碱,则pH <7⑹pH=a 的强酸与pH=b 的强碱混合呈中性时,二者体积与pH 的关系三 盐类的水解)(141410:1)(:)(,141:10)(:)(,141:1)(:)(,14b a b a V V b a V V b a V V b a ---+=+=+==+碱酸则<③若碱酸则>②若碱酸则①若1 定义:在溶液中电离出来的离子跟水电离出来的-+OH H 或结合生成弱电解质的反应。
电离平衡状态及特征归纳与分析要点一、影响电离平衡的因素。
当溶液的温度、浓度以及离子浓度改变时,电离平衡都会发生移动,符合勒夏特列原理,其规律是:1、浓度:浓度越大,电离程度越小。
在稀释溶液时,电离平衡向右移动,而离子浓度会减小。
2、温度:温度越高,电离程度越大。
因电离过程是吸热过程,升温时平衡向右移动。
3、同离子效应:如在醋酸溶液中加入醋酸钠晶体,增大了CH3COO-浓度,平衡左移,电离程度减小;加入稀HCl,平衡也会左移,电离程度也减小。
4、能反应的物质:如在醋酸溶液中加入锌或NaOH溶液,平衡右移,电离程度增大。
要点诠释:使弱酸稀释和变浓,电离平衡都向右移动,这二者之间不矛盾。
我们可以把HA的电离平衡HA H++A-想象成一个气体体积增大的化学平衡:A(g)B(g)+C(g),稀释相当于增大体积,A、B、C的浓度同等程度地减小即减小压强,平衡向气体体积增大的方向移动,B、C的物质的量增加但浓度减小,A的转化率增大;变浓则相当于只增大A的浓度,v(正)加快使v(正)>v (逆),平衡向正反应方向移动,A、B、C的物质的量和浓度均增大,但A的转化率降低了,A的物质的量分数增大了而B、C的物质的量分数减小了。
A的转化率即相当于弱酸的电离程度。
要点二、电离平衡常数1.概念:在一定条件下,弱电解质的电离达到平衡时,弱电解质电离形成的各种离子的浓度的乘积跟溶液中未电离的分子的浓度的比值是—个常数,这个常数叫做电离平衡常数。
用K表示。
2.数学表达式。
对一元弱酸(HA):HA H++A-。
对一元弱碱(BOH):BOH B++OH-。
3.K的意义:K值越大,表示该弱电解质越易电离,所对应的弱酸(弱碱)越强。
从K a和K b的大小,可以判断弱酸和弱碱的相对强弱,例如弱酸的相对强弱:H2SO3(K a1=1.5×10-2)>H3PO4(K a1=7.5×10-3)>HF(K a=3.5×10-4)>H2S(K a1=9.1×10-8)。
电离平衡是指在一定条件下(如温度、溶液浓度等),弱电解质在水溶液中达到的一种相对稳定状态。
在这种状态下,弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的速率相等。
此时,溶液中各种离子和分子的浓度保持不变,形成一个动态平衡。
电离平衡具有以下特征:
1. 相对性:电离平衡是相对于其他条件下的非平衡状态而言的,当外界条件发生变化时,电离平衡会发生移动,达到新的平衡状态。
2. 暂时性:电离平衡是一种暂时的稳定状态,随着时间的推移,溶液中的离子和分子浓度会发生变化,直至达到新的平衡。
3. 有条件性:电离平衡的实现取决于溶液的温度、浓度等因素,这些条件的变化会影响电离平衡的位置。
4. 动态平衡:电离平衡是一个动态的过程,溶液中的离子和分子在不断地生成和消失,但总体上保持相对稳定。
弱电解质(如部分弱酸、弱碱)在水中溶解时,其分子可以微弱电离成离子。
随着反应的进行,电离速率和结合速率逐渐趋于相等,达到电离平衡。
电离平衡的概念和特征有助于我们理解溶液中离子浓度、pH值等性质的变化,以及如何调控这些性质来满足实际需求。
“影响水的电离平衡的因素分析”几点浅谈平果高中刘晓云“化学平衡原理”实际上是从化学热力学角度对化学反应进行研究,研究对象仅适用于可逆反应,现行中学化学教材中,有一个平衡理论体系,包括溶解平衡、化学平衡、电离平衡、水解平衡、络合平衡等。
化学平衡是这一平衡理论体系的核心。
系统掌握化学平衡的概念、理论及应用对于深入认识其他平衡,重要的酸、碱、盐的性质和用途,化工生产中适宜条件的选择等,具有承上启下的作用;对于深入掌握元素化合物的知识,具有理论指导意义。
在一次听本学科老师的课时,他正好在上《水的电离》一课,其中就讲到了往纯水中加入少量盐酸或氢氧化钠溶液对水的电离平衡有何影响。
当时他说,“到底是‘同离子效应’使水的电离平衡向左移动,还是加入酸溶液中和了氢氢根(或加入碱溶液中和了氢离子)使平衡向右移动这就不好说了。
大多数资料是讲加酸(或加碱)抑制水的电离,我们就按这样的观点来理解加酸加碱对水的电离平衡的影响吧!”我对这位老师的说法还是没有讲到实质。
作为一种原理如果不在课堂上跟学生讲清楚,肯定会让学生在理解知识方面存在肓区,甚至是误区,在做到相关习题时,就会有很多同学认为往纯水中加入少量的盐酸或氢氧化钠溶液对水的电离平衡有两种互相矛盾的影响。
如何解决这一矛盾呢?我认为,这完全可以用“平衡移动原理”来解释。
在高中化学选修四《化学反应原理》第28页“如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动”。
如果把加酸(或加碱)看成是中和了水电离出来的氢氧根离子(或氢离子),那么加入的酸(或碱)中的氢离子(或氢氧根离子)每中和一个氢氧根离子(或氢离子),水电离出的氢离子(或氢氧根离子)就会增加一个,这样溶液中的氢离子(或氢氧根离子)的量并没有发生改变,在忽略溶液体积变化的条件下,溶液中的氢离子(或氢氧根离子)的溶液实际上并没有发生改变,这与“平衡移动原理”相矛盾;而如果用“同离子效应”来解释,就很好理解了,在水的电离平衡中,加入少量的盐酸(或氢氧化钠),溶液中由于增大了氢离子(或氢氧根离子)浓度,水的电离平衡逆向移动,减弱了氢离子(或氢氧根离子)浓度的增加,这与“平衡移动原理”吻合。