最新弱电解质电离平衡的影响因素(5稿)上课讲义
- 格式:ppt
- 大小:360.00 KB
- 文档页数:13


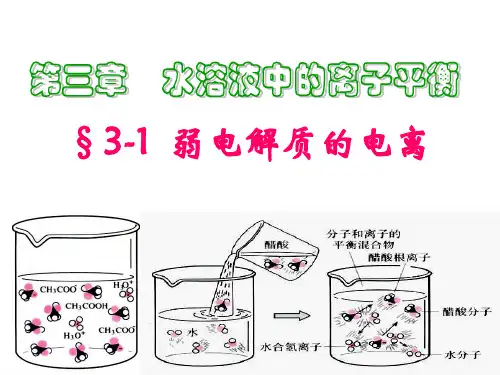



《弱电解质的电离平衡》讲义一、什么是弱电解质在我们探讨弱电解质的电离平衡之前,首先要清楚什么是弱电解质。
电解质,是指在水溶液或熔融状态下能够导电的化合物。
而弱电解质,则是在水溶液中只有部分电离的电解质。
常见的弱电解质包括弱酸(如醋酸、碳酸)、弱碱(如氨水)和水等。
以醋酸(CH₃COOH)为例,它在水溶液中并非完全电离成氢离子(H⁺)和醋酸根离子(CH₃COO⁻),而是存在一个电离平衡的过程。
二、弱电解质的电离平衡特点1、动态平衡弱电解质的电离过程是一个动态的过程。
在一定条件下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各粒子的浓度保持不变,但电离和结合仍在不断进行。
2、条件改变平衡移动电离平衡会受到外界条件的影响而发生移动。
比如,当温度升高时,一般电离平衡会向右移动,电离程度增大;而当浓度改变时,如增加弱电解质的浓度,电离平衡也会向右移动,但电离程度不一定增大。
3、存在电离常数对于每一种弱电解质,都有一个特定的电离常数(Ki)来表示其电离程度的大小。
电离常数只与温度有关,温度不变,电离常数不变。
三、影响弱电解质电离平衡的因素1、温度温度对电离平衡的影响较为显著。
通常,温度升高,电离平衡向右移动,电离程度增大。
这是因为电离过程一般是吸热的,升高温度会提供更多的能量,促进分子的电离。
2、浓度(1)弱电解质浓度增大弱电解质的浓度,电离平衡向右移动,但电离程度减小。
这就好比一个容器中原本有一定数量的分子在进行电离和结合,当加入更多的分子时,虽然有更多的分子会电离,但新加入的分子更多地处于未电离状态,所以整体的电离程度反而降低。
(2)离子浓度当增大离子的浓度时,电离平衡向左移动,抑制电离;减小离子的浓度时,电离平衡向右移动,促进电离。
3、同离子效应在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,会抑制弱电解质的电离。
例如,在醋酸溶液中加入醋酸钠,由于醋酸钠完全电离出醋酸根离子,会使醋酸的电离平衡向左移动。

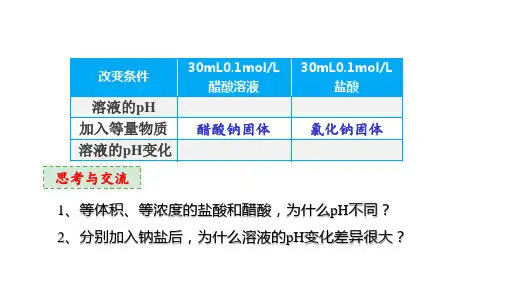
一、电解质与非电解质定义物质类别电解质 在水溶液或熔融状态下能够导电的化合物 酸、碱、盐、金属氧化物、水 非电解质在水溶液里和熔融状态下都不导电的化合物大部分有机化合物、非金属氧化物二、强电解质与弱电解质 1. 实验探究——盐酸和醋酸的区别取相同体积、0.1mol/L 的盐酸和醋酸, 比较它们pH 的大小,试验其导电能力,并分别与等量镁条反应。
观察、比较并记录现象。
酸 1.0 mol·L-1盐酸1.0 mol·L-1醋酸pH _____ _____ 导电能力 __________与镁 反应 现象 反应_______,产生气体反应_______,产生气体结论盐酸反应快,表明盐酸中c (H +)较____,说明盐酸的电离程度______醋酸的电离程度【答案】小(pH=1) 大(pH ≈3)强 弱 剧烈 缓慢 大 大于2.强、弱电解质的定义、物质类别与比较第14讲 弱电解质与电离平衡知识导航知识精讲只有离子①强酸,如HCl、H SO三、电离方程式第一步完全电离,第二步弱酸酸根部分电离,如NaHCO3=== Na+ + HCO3-,HCO3-⇌H+ + CO32-部分电离,如CH COOH ⇌CH COO- + H+四、弱电解质的电离平衡1. 含义一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率与离子重新结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化时,电离过程就达到了平衡状态,如下图所示。
2. 特征3.电离平衡的影响因素(1)温度:弱电解质的电离一般是______过程,升高温度,电离平衡______移动,电离程度______。
(2)浓度:①稀释电解质溶液,电离平衡__________移动,电离程度__________。
②加入同一电解质,电离平衡__________移动,电离程度__________。
(3)外加电解质:①同离子效应:加入与弱电解质具有相同离子的电解质,电离平衡______移动,电离程度______。

