人教版初三化学下册课题2酸碱中和反应
- 格式:docx
- 大小:73.44 KB
- 文档页数:7

导学案
酸和碱的中和反应班级姓名
一、知识复习
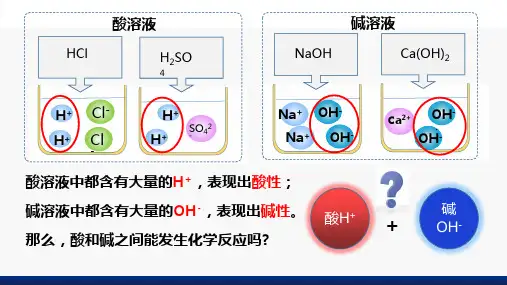
电离出的阳离子都是的化合物叫酸
电离出的阴离子都是的化合物叫碱
二、探究酸和碱的反应
实验探究过程
三、完成下列方程式
KOH + H2SO4
Ca(OH)2 + HCl
Ca(OH)2 +H2SO4
四、叫盐。
的反应叫中和反应。
五,中和反应在实际生活中的应用
1,改变土壤的酸碱性
如经常下酸雨形成的酸性土壤可以加入中和酸性。
(如土壤中含硫酸)反应方程式为
2,处理工厂的废水:如硫酸厂的污水可以用进行中和处理 3,用于医药
如胃酸过多时可服用含等碱性物质的药物,夏天蚊虫叮咬后可涂氨水、牙膏等碱性物质中和蚊虫分泌的蚁酸。
(如胃酸为盐酸)反应方程式为
六、课堂练习
1.下列关于中和反应的说法错误的是( )。
A.中和反应要放热 B.中和反应一定有盐生成
C.有盐和水生成的反应都是中和反应
D.中和反应一定有水生成
2.小烧杯中盛有含石蕊的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是( )
A.紫色—红色—蓝色 B.蓝色—紫色—红色
C.蓝色—红色—紫色 D.紫色—蓝色—红色
七,小结本课知识归纳整理。



酸和碱之间会发生什么反应(九年级化学人教版)授课人:灯塔市实验中学唐敏一、[教学目标]知识与技能:1.知道酸和碱之间能发生中和反应2.了解中和反应在生活中的应用过程与方法:1.会利用酸碱指示剂来判断酸碱发生反应2.从宏观到微观解释中和反应,培养学生的思维能力3. 使学生能灵活运用所学知识解决实际问题情感态度与价值观1.逐步建立微观世界观,提高学科素养。
2.体会化学与人类生产、生活和人体健康的密切联系。
二、[教学重点难点]重点:中和反应的概念及科学探究方法中和反应在生活中的应用难点:能运用微观知识解释中和反应的实质三、[教学方法手段]实验探究、讨论分析、总结归纳、迁移拓展等形式并运用多媒体课件、实物投影仪四.[教学用品]实验仪器:小烧杯、玻璃棒、胶头滴管、试管实验药品:NaOH溶液、稀盐酸、稀硫酸、酚酞溶液、紫色石蕊溶液、CuSO4溶液五.[教学过程]课前展示:主持人:高子涵课前展示是必答题,抢答题。
以小组为单位,增强学生的竞争意识。
[新课引入]在轻松愉快的音乐中欣赏一组图片,引出生活经历(蜜蜂蛰伤、蚊子叮咬及处理方法,思考:为什么?)导入新课。
[板书]课题2:酸与碱之间会发生什么反应[新授课](一)实验探究:酸与碱之间会发生什么反应?提出问题:酸与碱会发生反应吗?(是什么反应?)作出假设:会?不会?学生探究实验1:取10mLNaOH溶液和稀盐酸直接混合并观察现象。
学生得出:无明显现象[设问]:同学们是不是认为NaOH溶液和稀盐酸没有发生反应呢?如果反应我们怎么来判断呢?[小组讨论]:设计证明稀盐酸与氢氧化钠发生反应的实验方案。
各小组代表阐述自己的方案:(多种)其中一种如下所述:向NaOH溶液中滴加2滴无色酚酞溶液,溶液会变红,再逐滴滴加稀盐酸,观察到红色逐渐消失,就说明氢氧化钠与稀盐酸发生反应。
学生探究实验2:稀盐酸与氢氧化钠溶液混合是否发生反应(借助指示剂-酚酞)取10mLNaOH溶液,滴加2滴无色酚酞溶液,溶液变红,逐滴滴加稀盐酸,观察现象并做好记录。


酸和碱的中和反应(第1课时)一、教学目标1.知识与技能:(1)认识酸和碱之间会发生中和反应;(2)了解中和反应在实际中的应用。
2.过程与方法:(1)通过在氢氧化钠溶液中加入盐酸的实验探究,掌握烧杯实验的操作,强化实验及生活中的安全意识;(2)通过对反应后溶液酸碱性的探究,培养学生严谨实验的科学态度及良好的学习习惯。
3.情感态度与价值观:通过中和反应的实验探究和实际应用,加深对中和反应的理解,同时体会化学与人类生产、生活等的密切联系。
二、学情分析通过本单元课题1的学习,学生对酸和碱的性质和用途有了初步认识,课题2提出酸和碱之间会发生什么反应的问题,激发了学生继续探究的欲望。
在此之前,学生已经知道酸、碱在水溶液中能解离出自由移动的离子,为认识中和反应的实质准备了条件。
另外学生已经学习了溶液酸碱性的概念,并学会了用指示剂检验溶液酸碱性的方法,为本课题的学习奠定了基础。
从教育目的来看,中和反应在生活、生产上具有广泛的应用,研究它更具有现实意义,能更好体现化学走向生活的理念。
从研究方法来看,本课题采用实验探究,然后对实验进行分析、讨论、归纳,能较好地培养学生的分析探究能力。
因此本节课既是本章的重点,也是初中化学的重点之一。
三、教学重难点重点:中和反应的定义、实质和应用。
难点:书写酸和碱反应的化学方程式。
四、课前准备实验仪器:试管实验药品:NaOH溶液、盐酸溶液。
五、教学过程知识回顾:(多媒体展示)通过复习上个课题的知识,为学习本课题的知识做准备。
提问:联系生活实际,被蚊虫叮咬后怎么办?学生:涂花露水、肥皂水……教师总结:被蚊虫叮咬后一般会涂抹肥皂水等碱性的物质,来反应蚊虫叮咬后留下的酸性物质。
那么其他酸和碱能否发生反应?(引入本节课的内容。
)介绍本节课的学习目标。
实验演示:将无色透明的NaOH溶液倒入试管中,在向试管中倒入适量的稀盐酸,观察现象。
学生:无明显现象。
提问:这是否能证明氢氧化钠溶液和稀盐酸发生了反应?学生:反应无明显现象不能证明。



一、知识梳理
知识点一
中和反应:
(1) 定义:酸和碱作用生成盐和水的反应,叫做中和反应。
(2) 本质:氢离子(H +)和氢氧根(0H -)相互反应。
(3) 常见的中和反应:
NaOH+HCl = NaCI+H 2O ; Ca (OH )2+2HCI = CaCI 2+2HCI ; 2NaOH+H 2SO 4 = Na 2SO 4+2H 2O
(4 )盐:由金属离子(或铵根离子)和酸根离子构成的一类化合物。
(5)中和反应在实际生活中的应用:
① 改变土壤的酸碱性,如经常下酸雨形成的酸性土壤可以加入熟石灰中和酸性 ② 处理工厂的废水,如硫酸厂的污水可以用熟石灰进行中和处理
③ 用于医药:如夏天蚊虫叮咬后可涂氨水、牙膏、肥皂等碱性物质中和蚊虫分泌的蚁酸, 胃酸过多时可服用含氢氧化铝等碱性物质的药物( AI (OH ) 3 + 3HCI =AICI 3+ 3出0)。
1、下列反应中属于中和反应的是 ( )
A.
Na 2CO 3+2HCI — 2NaCI+H 2O+CO 2 t
B.2NaOH+H 2SO 4— Na 2SO 4+2H 2O
2、物质X 可发生"X +酸T 盐+ H 2O ”的反应,贝U X 可能是( )
3、下列有关物质用途 的说法中,错误的是(
知识点二 溶液酸碱度的表示方法-pH
(1 )溶液的酸碱度
用
pH 表示,范围为0 —14
酸性溶液 pH<7 , pH 值越小酸性越强
中性溶液 pH=7
碱性溶液
D H>7 ,pH 值越大碱性越强
温馨提示
手旦浪 /片殊访 伯浪 /片殊访
1 .酸溶液 定是酸性溶液,但酸性溶液不 定是酸溶液
2•碱溶液 定是碱性溶液,但碱性溶液不 定是碱溶液
第十单元酸和碱 课题2酸和碱的中和反应
备注(反
思)
C.CO 2+2NaOH — W2CO 3+H 2O
D.Fe+CuSO 4—Cu+FeS°4
A. Fe
B. CO 2
C. H 2SO 4
D. NaOH
A .二氧化锰作过氧化氢制取氧气的催化剂
B .用氢氧化钠改良酸性土壤
C .氢氧化铝用于治疗胃酸过多
D •用稀盐酸除去金属表面的锈
4、盐溶液不一定都呈中性,如Na2CO3溶液就呈碱性.下列有关实验中,
能够证明Na2CO3溶液呈碱性的是()
A. 观察Na2CO3溶液呈无色
B. 向Na2CO3溶液中滴加2滴无色酚酞溶液,溶液变红
C. 向Na2CO3溶液中滴加稀盐酸,有气泡产生
D. —定温度下,向Na2CO3饱和溶液中加入固体,溶液变浑浊
(2)测定pH的方法
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,
读出溶液的pH (读数为整数)。
温馨提示 1.用pH试纸测得的pH值只能为正整数,不能为小数及零。
2.用pH试纸测pH值时,不能先用蒸馏水润湿pH试纸。
若先用蒸馏水润湿后再测会
影响结果:使酸性溶液的pH值增大;使碱性溶液的pH值减小;中性溶液的pH值不
变。
5、下列物质中,碱性最弱的是()
A. 鸡蛋清(pH:7~8)
B.牙膏(pH:8~9)
C.肥皂(pH:10~11)
D.炉具清洁刘(pH:12~13)
6、下列说法正确的是()
A. 在化学反应中,镁原子易得到电子,它的化学性质比较活泼
B. 用玻璃棒蘸取待测液体滴到干燥的pH试纸上,测定液体的pH
C. 催化剂就是加快化学反应速率的物质
D. 生成盐和水的反应一定是中和反应
二、拓展提升
1、将下列不同pH的各组溶液混合,得到溶液的pH可能为7的是()
A. pH =3 pH =4
B. pH =11 pH =7
C. pH =6 pH =8
D.pH =0 pH =5
2、以下是一些食物的近似pH,对于胃酸过多的人比较适宜吃的食物是()
A.橘子2.9〜3.5
B.泡菜3.0〜4.
C.葡萄3.5〜4.5
D.玉米粥6.8〜8.8
3、如图表示氢氧化钠溶液与稀盐酸恰好全反应,由此得出的结论错误的是()
A. 反应结束时溶液的pH=7
B. 反应前后元素的种类没有变化
C. 反应后溶液中存在的粒子只有Na+和Cl
D. 该反应的实质是H +和OH —结合生成水
4、关于氢氧化钠与盐酸的反应,下列说法正确的是
pH不断减小,说明两者发生了反应
A.将一定量的稀盐酸逐滴滴入氢氧化钠溶液中,
B. 将一定量的稀盐酸滴入滴有酚酞的氢氧化钠溶液中,溶液仍为红色,说明两者不反应
C. 将一定量的盐酸与 pH=12的氢氧化钠溶液混合后溶液的
pH=7,说明两者发生了反应
D. 将氢氧化钠固体放入稀盐酸中,放出热量,说明两者发生了反应 5、 pH 是水质检测的重要指标之一,下列水样酸性最强的是 ( )
A.pH = 1.3的工业废水
B.pH = 4.5的雨水
C.pH = 7.0的蒸馏水
D.pH = 7.3的矿泉水
6、实验小组探究盐酸和氢氧化钠反应过程中溶液 下列有关说法正确的是(
)
A. 该实验是将氢氧化钠溶液滴入盐酸中
B. A 点时的溶液能使酚酞试液变红
C. B 点表示此时液体为纯净物
D. C 点时,溶液中的溶质只有氯化氢 7、 下列应用一定与中和反应原理无关是 ( )
A.施用熟石灰改良酸性土壤
B.服用含/
C.实验室用浓硫酸做干燥剂
D.用NaOH 溶液洗涤石油产品中的残余硫酸
8、在pH 为1的稀H2SO4溶液中逐滴滴加 BaCl2溶液至过量,下列各示 意图中,
9、 “类推”是学习化学过程中常用的思维方法。
现有以下类推结果,其中错误的是 (
)
① 酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应; ② 氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物; ③ 金属铝与盐酸反应生成 AICI3和H2,所以金属铁与盐酸反应生成 FeCI3和H2 ;
④ 浓盐酸试剂瓶敞口久 置后变稀且质量减轻,所以浓硫酸敞口久置 也变稀且质量减轻.
A.①
B.①③
C.①②④
D.全部
10、 下列实际应用中,禾U 用中和反应原理的是 ( )
①用氢氧化钠溶液洗涤石油产品中的残余硫酸
②用碳酸氢钠治疗胃酸过多
pH 的变化规律得到如图所示曲线。
3的药物治疗胃酸过多
③用熟石灰改良酸性土壤④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒.
A.①②
B.②③④
C.②③
D.①③④
11、在研究酸和碱的化学性质时,某小组同学想证明:稀 H 2SO 4与NaOH 溶液混合后,
虽然仍为无色溶液,但确实发生了化学反应•请与他们一起完成实验方案的设计、 实施和评价。
(1 )方案一:测定稀 H 2SO 4与NaOH 溶液混合前后的pH (20C)
测定某NaOH 溶液的pH , pH _________7 (选填“大于”、“等于”或“小于”)。
将一定量的稀H 2SO 4加入该NaOH 溶液中,混合均匀后测定其 pH , pH 小于7. 结论:稀H 2SO 4与NaOH 溶液发生了化学反应,并且 _________________ 过量. (2)方案二:向盛有 NaOH 溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸至过量,
结论:稀H 2SO 4与NaOH 溶液发生了化学反应, 反应的化学方程式为
(3)下列图像表示稀硫酸和氢氧化钠溶液发生反应过程中溶液的
家长签字: _______________
pH 变化。
则曲线上
C 点表示 ______ 。
实验结束后烧杯中溶液的溶质是
____ (填化学式)。