(技术规范标准)核酸、蛋白技术参数资料、分子量标准及常用试剂的配制
- 格式:doc
- 大小:165.57 KB
- 文档页数:8

核酸提取与纯化试剂配方核酸提取和纯化是分子生物学研究中常用的重要步骤。
核酸提取与纯化试剂包括溶解、提取、纯化和测定等步骤。
下面将详细介绍核酸提取与纯化试剂的配方和使用方法。
1. 细胞裂解缓冲液的配方:- 25mM Tris-HCl pH 8.0- 50mM EDTA- 1% SDS- 100μg/ml RNase A将以上试剂按比例混合制备成细胞裂解缓冲液,用于裂解细胞并保护核酸的完整性。
2. 提取缓冲液的配方:- 0.1M Tris-HCl pH 8.0- 0.14M NaCl- 0.001M EDTA- 1% SDS将以上试剂按比例混合制备成提取缓冲液,用于将细胞裂解液中的核酸与蛋白质分离。
3. 过滤缓冲液的配方:- 5M ammonium acetate- 100% isopropanol将5M乙酸铵与等量的100%异丙醇混合制备成过滤缓冲液,用于将核酸从提取液中沉淀。
4. 洗涤缓冲液的配方:- 70% ethanol将绝对乙醇与等量的去离子水混合制备成洗涤缓冲液,用于洗涤核酸沉淀,去除残留的盐类和蛋白质。
5. 纯化缓冲液的配方:- 10mM Tris-HCl pH 8.0- 1mM EDTA将以上试剂按比例混合制备成纯化缓冲液,用于重溶核酸并去除污染物。
使用步骤如下:1. 将待提取的细胞悬浮在细胞裂解缓冲液中,彻底裂解细胞膜。
2. 加入RNase A,在室温下孵育30分钟,酶解RNA。
3. 加入等体积的提取缓冲液,混合均匀后离心,将上清液转移至新离心管,保留上清液,其中含有DNA。
4. 加入等体积的过滤缓冲液,混合均匀后离心,将上清液抽取并丢弃,沉淀中包含核酸。
5. 加入洗涤缓冲液,混合均匀后离心,将上清液抽取并丢弃,重复一次洗涤步骤,确保去除残留的盐类和蛋白质。
6. 倒掉洗涤缓冲液,将离心管倒置在吸水纸上,待离心管底部的液滴完全干燥,避免残留的洗涤缓冲液影响纯化后的核酸。
7. 加入适量的纯化缓冲液,将沉淀重溶,确保核酸的完整性。

实验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g1pg=10-12g1ng=10-9g 1fg=10-15g(2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH 值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
3.电泳缓冲液测序凝胶加样缓冲液98%去离子甲酰胺10mol/L EDTA(pH8.0)0.025%二甲苯青FF0.025%溴酚蓝甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。

核酸检验试剂配制方案核酸检验是一项非常重要的实验室技术,用于检测和分析DNA和RNA的序列和结构。
核酸检验试剂的配制是核酸检验工作中的关键环节,下面是一个700字的核酸检验试剂配制方案。
一、试剂准备1. Tris-HCl缓冲液:将121.14g Tris-HCl溶解在800ml去离子水中,调pH至7.5,加去离子水至1L。
2. EDTA溶液:将186.1g EDTA二钠溶解在800ml去离子水中,加去离子水至1L。
3. NaCl溶液:将58.44g NaCl溶解在800ml去离子水中,加去离子水至1L。
4. Lyse Buffer溶液:将10ml Tris-HCl缓冲液、1ml EDTA溶液、8ml NaCl溶液混合,加去离子水至50ml。
5. 2×载脂体缓冲液:将40ml Tris-HCl缓冲液、8ml EDTA溶液、70ml NaCl溶液混合,加去离子水至200ml。
6. 蛋白酶K溶液:将1mg的蛋白酶K溶解在1ml去离子水中。
7. 合成引物:按需要合成引物序列,并与合成公司确认纯度和浓度。
二、试剂配制1. DNA提取试剂配制:将1ml Lyse Buffer溶液和10μl蛋白酶K溶液混合,制成DNA 提取试剂。
2. PCR反应液配制:将50μl 2×载脂体缓冲液、5μl DNA模板、1μl合成引物、3μl MgCl2、1μl dNTP混合,加去离子水至100μl,制成PCR反应液。
3. 电泳缓冲液配制:将242g Tris和36g boric acid溶解在800ml去离子水中,加去离子水至1L,pH调至8.0,加入20ml 0.5M EDTA混合,最终体积调至1L。
4. DNA标记液配制:将1μl DNA样品和9μl DNA加载缓冲液混合,制成DNA标记液。
5. 试剂保存温度:将所有试剂保存在适宜的温度下,避免阳光直射和高温。
三、注意事项1. 试剂配制时要严格按照实验室的操作规程进行,避免实验污染。
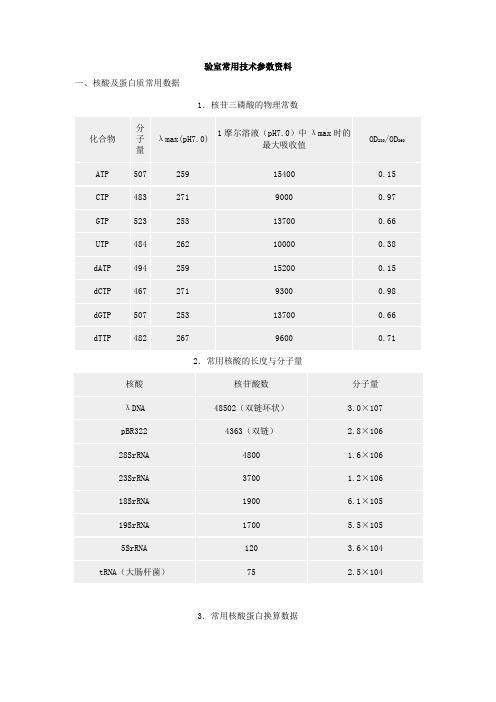
验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g 1pg=10-12g1ng=10-9g 1fg=10-15g (2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg 100pmol分子量50,000蛋白质=5μg 100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch 方程计算其pH值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。

核酸与蛋白质生物计量关键技术及基标准体系创建和应用大家好,今天我们来聊聊一个非常有趣的话题:核酸与蛋白质生物计量关键技术及基标准体系创建和应用。
让我们来解释一下这个话题的背景。
在生物学、医学、食品科学等领域,我们需要对核酸和蛋白质进行定量分析,以便更好地了解它们的结构和功能。
而这些分析结果需要有一个统一的标准体系来进行比较和评估。
因此,研究核酸与蛋白质生物计量关键技术及基标准体系创建和应用就显得尤为重要。
核酸和蛋白质到底是什么呢?简单来说,核酸是生物体内携带遗传信息的分子,包括DNA和RNA两种类型;而蛋白质则是生物体内发挥各种功能的大分子,如酶、抗体、肌红蛋白等。
它们在生物体内的组成和作用非常复杂,因此对其进行定量分析也是一项非常具有挑战性的任务。
为了解决这个问题,科学家们开发出了一些关键技术。
其中之一就是高通量测序技术。
这种技术可以快速地测定大量的核酸序列,从而获得有关其结构和功能的信息。
另一个关键技术是质谱法。
这种方法可以通过测量蛋白质分子的质量和电荷来确定其种类和浓度。
还有一些其他的方法,如荧光光谱法、红外光谱法等,也可以用于核酸和蛋白质的定量分析。
除了这些关键技术之外,还需要建立一套基标准体系来进行定量分析的结果比较和评估。
这个体系需要包括一系列已知浓度的标准品,以及对应的计算方法和参考值。
只有这样才能确保不同实验之间的结果具有可比性和可靠性。
现在,让我们来看看核酸与蛋白质生物计量关键技术及基标准体系创建和应用在实际生活中的应用吧!比如说,在医学领域中,医生们可以使用这些技术来检测患者体内的病毒或细菌感染情况;在食品科学领域中,研究人员可以利用这些技术来评估食品中的营养成分含量;在环境科学领域中,科学家们可以用这些技术来监测大气中的污染物含量等等。
核酸与蛋白质生物计量关键技术及基标准体系创建和应用已经成为了现代科技发展的重要组成部分。
我想说的是,虽然这篇文章使用了比较多的专业术语和技术名词,但其实它也是可以用通俗易懂的方式来表达的。

核酸提取与纯化试剂配方核酸提取与纯化试剂的配方主要包括缓冲液、酶、洗涤剂和溶剂等组分。
缓冲液是核酸提取与纯化试剂的核心组成部分,它提供了适宜的pH和离子浓度,有助于维持核酸的稳定性和纯净性。
常用的缓冲液有Tris-HCl缓冲液、EDTA缓冲液等。
酶是核酸提取与纯化试剂中的重要成分,主要用于消化细胞膜和细胞核膜,释放核酸。
常用的酶有蛋白酶K、RNase A等。
洗涤剂用于去除细胞残渣、蛋白质和其他杂质,保证提取的核酸纯净。
一般常用的洗涤剂有SDS、NaCl等。
溶剂则用于溶解和洗涤核酸,常用的溶剂有乙醇、异丙醇等。
核酸提取与纯化试剂的使用方法如下:1. 准备样品:首先需要准备待提取核酸的样品,可以是细胞、组织或体液等。
样品的获取和保存要遵循一定的规范,以保证提取的核酸质量和纯度。
2. 细胞破碎:将样品加入破碎缓冲液中,使用超声波、机械破碎或冻融等方法破碎细胞,释放核酸。
破碎缓冲液中含有适量的酶,可以帮助破碎细胞膜和细胞核膜。
3. 消化蛋白质:加入蛋白酶K等消化酶,消化样品中的蛋白质,以便更好地分离核酸。
4. 沉淀核酸:加入酒精或其他沉淀剂,使核酸沉淀下来。
离心沉淀后,将上清液倒掉,留下核酸沉淀。
5. 洗涤核酸:用洗涤缓冲液洗涤核酸沉淀,去除杂质和残留的试剂,保证核酸的纯净。
6. 溶解核酸:用适量的溶剂溶解核酸,使其溶解均匀,并保持其稳定性。
7. 储存核酸:将提取纯化的核酸存储在低温下,以保持其稳定性和纯净性,以备后续实验使用。
核酸提取与纯化试剂的配方和使用方法是分子生物学实验中的基础知识,掌握好这些知识对于研究人员的实验顺利进行具有重要意义。
在实验过程中,需要注意各个步骤的操作规范和试剂的质量控制,以确保提取到高质量的核酸样品。
此外,在实际应用中,还可以根据具体的实验需求进行一定的调整和优化,以获得更好的实验结果。
提取与纯化核酸是分子生物学研究中的重要步骤,核酸提取与纯化试剂的配方和使用方法在实验室中得到广泛应用。
核酸、蛋白质杂交用相关试剂、缓冲液的配制方法20×SSC20×SSPE Buffer50×Denhardt’s溶液■组份浓度 3.0 M NaCl,0.3 M 柠檬酸钠■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
NaCl 175.3 g柠檬酸钠·2H2O 88.2 g2. 向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3. 滴加14 N HCl,调节pH值至7.0后,加去离子水将溶液定容至1 L。
4. 高温高压灭菌后,室温保存。
■组份浓度 3.0 M NaCl,0.2 M NaH2PO4,0.02 M EDTA■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
NaCl 175.3 gNaH2PO4·H2O 27.6 gNa2EDTA·2H2O 7.4 g2. 向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3. 加NaOH调节pH值至7.4(约6.5 ml的10 N NaOH)。
4. 加去离子水将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
■组份浓度1%(W/V) Ficoll 4001%(W/V) Polyvinylpyrrolidone1%(W/V) BSA■配制量 500 ml■配制方法 1. 称量下列试剂,置于500 ml烧杯中。
Ficoll 400 5 gPolyvinylpyrrolidone 5 gBSA 5 g2. 加去离子水约400 ml,充分搅拌溶解。
3. 加去离子水将溶液定容至500 ml。
4. 用0.45 μm滤器过滤后,分装成每份25 ml。
5. -20℃保存。
0.5 M磷酸盐BufferSalmon DNA (鲑鱼精DNA)DNA变性缓冲液■组份浓度 0.5 M Na2HPO4■配制量 1 L■配制方法 1. 称量134 g Na2HPO4·7H2O置于1 L烧杯中。
常见实验用溶液的配制方法一 . 常用贮液与溶液1mol/L亚精胺(Spermidine : 溶解 2.55g 亚精胺于足量的水中,使终体积为10ml 。
分装成小份贮存于 -20℃。
1mol/L精胺(Spermine :溶解 3.48g 精胺于足量的水中,使终体积为 10ml 。
分装成小份贮存于 -20℃。
10mol/L乙酸胺(ammonium acetate :将 77.1g 乙酸胺溶解于水中,加水定容至 1L 后,用 0.22um 孔径的滤膜过滤除菌。
10mg/ml牛血清蛋白 (BSA:加 100mg 的牛血清蛋白(组分 V 或分子生物学试剂级,无 DNA 酶于 9.5ml 水中(为减少变性,须将蛋白加入水中,而不是将水加入蛋白,盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。
不要涡旋混合。
加水定容到 10ml ,然后分装成小份贮存于 -20℃。
1mol/L二硫苏糖醇(DTT :在二硫苏糖醇 5g 的原装瓶中加 32.4ml 水,分成小份贮存于 -20℃。
或转移 100mg 的二硫苏糖醇至微量离心管,加 0.65ml 的水配制成 1mol/L二硫苏糖醇溶液。
8mol/L乙酸钾(potassium acetate :溶解 78.5g 乙酸钾于足量的水中,加水定容到100ml 。
1mol/L氯化钾(KCl :溶解 7.46g 氯化钾于足量的水中,加水定容到 100ml 。
3mol/L乙酸钠(sodium acetate :溶解 40.8g 的三水乙酸钠于约 90ml 水中,用冰乙酸调溶液的 pH 至 5.2,再加水定容到 100ml 。
0.5mol/L EDTA:配制等摩尔的 Na2EDTA 和 NaOH 溶液(0.5mol/L,混合后形成EDTA 的三钠盐。
或称取 186.1g 的 Na2EDTA·2H2O 和 20g 的 NaOH ,并溶于水中,定容至 1L 。
1mol/L HEPES :将 23.8gHEPES 溶于约 90ml 的水中,用 NaOH 调 pH (6.8-8.2,然后用水定容至 100ml 。
新冠快速核酸检测系统技术参数1、样本容量:&16*0.2ml离心管(5-100ul),适应常规0.2ml8联管及单管。
2、反应灵敏度:10-lOlOCopies。
3、荧光染料:Fl:FAM、SYBRGreenI;F2:HE*、VIC、JOE、TET、YE1.1.OW;F3:R0*;F4:CY5。
4、通道数:四通道。
5、光学系统:高亮度1.ED扫描,光电传感器扫描检测,免校准。
6、热盖温度范围:30—110°C。
7、检测试剂:开放式检测试剂耗材(通用常规PCR项目)。
8、温控范围:30°C・100°C。
9、均匀性:W±0」°C。
10、温控精度:《士0.19。
11、升温速率:28°C/s(MA*)。
12、荧光强度检测重复性:CVW0.5%。
13、荧光线性:线性回归系数一、20.995。
14、仪器通讯接口:USB2.0(可进行文件导入、导出)。
15、软件:仪器可直接进行结果及数据分析,并配套电脑版专用分析软件。
16、触控屏独立操作,无需连接电脑即可操作分析。
17、具有NMPA注册认证。
新冠核酸检测技术方案为落实《国务院应对新冠疫情联防联控机制关于做好新冠疫情常态化防控工作的指导意见》(国发明电(202x)14号)和省应对新冠疫情应急指挥部要求,进一步提升全省新冠核酸检测能力,全面推进扩大核酸检测,使新冠核酸检测保“量”保“质”保“安全”,为做好常态化疫情防控工作提供有力技术支撑,制订此技术方案。
一、适用范围适用于**省区域内开展新冠核酸检测的实验室。
二、生物安全防护要求(一)防护用品。
医用外科口罩、N95及以上防护口罩、全面型呼吸防护器或护目镜和面屏、医用防护服、防水隔离衣、工作服、工作鞋、乳胶手套、防水靴套、医用防护帽。
(二)相关操作过程人员生物安全防护要求。
样本采集、样本核酸提取人员须三级生物安全防护:N95口罩(必要时可在外加戴医用外科口罩)、医用防护帽、工作服、外着防护服(必要时加戴穿防水隔离衣)、工作鞋、防水靴套、双层乳胶手套、护目镜(必要时可加戴面屏)或全面型呼吸防护器。
核酸、蛋白技术参数资料、分子量标准及常用试剂的配制•一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g 1pg=10-12g 1ng=10-9g 1fg=10-15g (2)分光光度换算:1A260双链DNA=50μg/ml 1A260单链DNA=30μg/ml 1A260单链RNA=40μg/ml (3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol 1pmol 1000bp DNA=0.66μg 1pmol pBR322=2.8μg 1kb双链DNA(钠盐)=6.6×105道尔顿1kb 单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg 100pmol分子量50,000蛋白质=5μg 100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA 30,000MW蛋白质=810bp DNA 50,000MW蛋白质=1.35kb 100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物a:以水为溶剂的抗生素贮存液通过0.22μm滤器过滤除菌。
以乙醇为溶剂的抗生素溶液无须除菌处理。
所有抗生素溶液均应放于不透光的容器保存。
b:镁离子是四环素的拮抗剂,四环素抗性菌的筛选应使用不含镁盐的培养基(如LB培养基)。
五、常用贮存液的配制1.30%丙烯酰胺溶液【配制方法】将29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中。
加热至37℃溶解之,补加水至终体积为100ml。
用Nalgene滤器(0.45μm孔径)过滤除菌,查证该溶液的pH值应不大于7.0,置棕色瓶中保存于室温。
【注意】丙烯酰胺具有很强的神经毒性并可以通过皮肤吸收,其作用具累积性。
称量丙烯酰胺和亚甲双丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能会含有少量未聚合材料。
一些价格较低的丙烯酰胺和双丙烯酰胺通常含有一些金属离子,在丙烯酰胺贮存液中加入大约0.2体积的单床混合树脂(MB-1Mallinckrodt),搅拌过夜,然后用Whatman 1号滤纸过滤以纯化之。
在贮存期间,丙烯酰胺和双丙烯酰胺会缓慢转化成丙烯酰和双丙烯酸。
2.40%丙烯酰胺【配制方法】把380g丙烯酰胺(DNA测序级)和20g N,N’-亚甲双丙烯酰胺溶于总体积为600ml的蒸馏水中。
继续按上述配制30%丙烯酰胺溶液的方法处理,但加热溶解后应以蒸馏水补足至终体积为1L。
【注意】见上述配制30%丙烯酰胺的说明,40%丙烯酰胺溶液用于DNA序列测定。
3.放线菌素D溶液【配制方法】把20mg放线菌素D溶解于4ml 100%乙醇中,1:10稀释贮存液,用100%乙醇作空白对照读取OD440值。
放线菌素D(分子量为1255)纯品在水溶液中的摩尔消化系数为21,900,故而1mg/ml的放线菌素D溶液在440nm处的吸光值为0.182,放线菌素D的贮存液应放在包有箔片的试管中,保存于-20℃。
【注意】放线菌素D是致畸剂和致癌剂,配制该溶液时必须戴手套并在通风橱内操作,而不能在开放在实验桌面上进行,谨防吸入药粉或让其接触到眼睛或皮肤。
药厂提供的作治疗用途的放线菌素D制品常含有糖或盐等添加剂。
只要通过测量贮存液在440nm波长处的光吸收确定放线菌素D的浓度,这类制品便可用于抑制自身引导作用。
4.0.1mol/L腺苷三磷酸(ATP)溶液【配制方法】在0.8ml水中溶解60mg ATP,用0.1mol/L NaOH调至pH值至7.0,用蒸馏水定容1ml,分装成小份保存于-70℃ 5.10mol/L乙酸酰溶液【配制方法】把770g乙酸酰溶解于800ml水中,加水定容至1L后过滤除菌。
6.10%过硫酸铵溶液【配制方法】把1g过硫酸铵溶解于终量为10ml的水溶液中,该溶液可在4℃保存数周。
7.BCIP溶液【配制方法】把0.5g的5-溴-4-氯-3-吲哚磷酸二钠盐(BCIP)溶解于10ml 100%的二甲基甲酰胺中,保存于4℃ 8.2×BES缓冲盐溶液【配制方法】用总体积90ml的蒸馏水溶解1.07g盐溶液BES[N,N-双(2-羟乙基)-2-氨基乙磺酸]、1.6g NaCl和0.027g Na2HPO4,室温下用HCl调节该溶液的pH值至6.96、然后加入蒸馏水定容至100ml,用0.22μm滤器过滤除菌,分装成小份,保存于-20℃。
9.1mol/L CaCl2溶液【配制方法】在200ml蒸馏水中溶解54g CaCl2·6H2O,用0.22μm滤器过滤除菌,分装成10ml小份贮存于-20℃。
【注意】制备感受态细胞时,取出一小份解冻并用蒸馏水稀释至100ml,用Nalgene滤器(0.45μm孔径)过滤除菌,然后骤冷至0℃。
10.2.5mol/L CaCl2溶液【配制方法】在20ml蒸馏水中溶解13.5g CaCl2·6H2O,用0.22μm 滤器过滤除菌,分装成1ml小份贮存于-20℃。
11.1mol/L二硫苏糖醇(DTT)溶液【配制方法】用20ml 0.01mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,过滤除菌后分装成1ml小份贮存于-20℃。
【注意】DTT或含有DTT的溶液不能进行高压处理。
12.脱氧核苷三磷酸(dNTP)溶液【配制方法】把每一种dNTP溶解于水至浓度各为100mmol/L左右,用微量移液器吸取0.05mol/l Tris碱分别调节每一dNTP溶液的pH值7.0(用pH试纸检测),把中和后的每种dNTP溶液各取一份作适当稀释,在下表中给出的波长下读取光密度计算出每种dNTP的实际浓度,然后用水稀释成终浓度为50mmol/L的比色杯光径为1cm时,吸光度=εM 13.0.5mol/l EDTA(pH8.0)溶液【配制方法】在800ml水中加入186.1g二水乙二胺四乙酸二钠(EDTA-Na·2H2O),在磁力搅拌器上剧烈搅拌,用NaOH调节溶液的pH值至8.0(约需20g NaOH颗粒)然后定容至1L,分装后高压灭菌备用。
【注意】EDTA二钠盐需加入NaOH将溶液的pH值调至接近8.0,才能完全溶解。
14.溴化乙锭(10mg/ml溶液)【配制方法】在100ml 水中加入1g溴化乙锭,磁力搅拌数小时以确保其完全溶解,然后用铝箔包裹容器或转移至棕色瓶中,保存于室温。
【注意】小心:溴化乙锭是强诱变剂并有中度毒性,使用含有这种染料的溶液时务必戴上手套,称量染料时要戴面罩。
15.2×HEPES缓冲盐溶液【配制方法】用总量为90ml的蒸馏水溶解1.6g NaCl、0.074g KCl、0.027g Na2PO4·2H2O、0.2g葡聚糖和1gHEPES,用0.5mol/l NaOH调节pH值至7.05,再用蒸馏水定容至100ml。
用0.22μm滤器过滤除菌,分装成5ml小份,贮存于-20℃。
16.IPTG 溶液【配制方法】IPTG为异丙基硫代-β-D-半乳糖苷(分子量为238.3),在8ml 蒸馏水中溶解2g IPTG后,用蒸馏水定容至10ml,用0.22μm滤器过滤除菌,分装成1ml 小份贮存于-20℃。
17.1mol/L乙酸镁溶液【配制方法】在800ml水中溶解214.46g四水乙酸镁,用水定容至1L过滤除菌。
18.1mol/L MgCl2溶液【配制方法】在800ml水中溶解203.4g MgCl2·6H2O,用水定容至1L,分装成小份并高压灭菌备用。
【注意】MgCl2极易潮解,应选购小瓶(如100g)试剂,启用新瓶后勿长期存放。
19.β-巯基乙醇(BME)溶液【配制方法】一般得到的是14.4mol/L 溶液,应装在棕色瓶中保存于4℃。
【注意】BME或含有BME的溶液不能高压处理。
20.NBT溶液【配制方法】把0.5g氯化氮蓝四唑溶解于10ml 70%的二甲基甲酰胺中,保存于4℃。
21.酚/氯仿溶液【配制方法】把酚和氯仿等体积混合后用0.1mol/L Tris·HCl(pH7.6)抽提几次以平衡这一混合物,置棕色玻璃瓶中,上面覆盖等体积的0.01mol/l Tris·HCl(pH7.6)液层,保存于4℃。
【注意】酚腐蚀性很强,并可引起严重灼伤,操作时应戴手套及防护镜,穿防护服。
所有操作均应在化学通风橱中进行。
与酚接触过的部位皮肤应用大量的水清洗,并用肥皂和水洗涤,忌用乙醇。
22.10mmol/L苯甲基磺酰氟(PMSF)溶液【配制方法】用异丙醇溶解PMSF成1.74mg/ml(10mmol/L),分装成小份贮存于-20℃。
如有必要可配成浓度高达17.4mg/ml 的贮存液(100mmol/L)。
【注意】PMSF严重损害呼吸道粘膜、眼睛及皮肤,吸入、吞进或通过皮肤吸收后有致命危险。
一旦眼睛或皮肤接触了PMSF,应立即用大量水冲洗之。
凡被PMSF污染的衣物应予丢弃。
PMSF在水溶液中不稳定。
应在使用前从贮存液中现用现加于裂解缓冲液中。
PMSF在水溶液中的活性丧失速率随pH值的升高而加快,且25℃的失活速率高于4℃。
pH值为8.0时,20μmmol/l PMSF水溶液的半寿期大约为85min,这表明将PMSF溶液调节为碱性(pH>8.6)并在室温放置数小时后,可安全地予以丢弃。
23.磷酸盐缓冲溶液(PBS)溶液【配制方法】在800ml蒸馏水中溶解8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,用HCl调节溶液的pH值至7.4加水定容至1L,在15lbf/in2(1034×105Pa)高压下蒸气灭菌20min。
保存于室温。
24.1mol/L乙酸钾(pH7.5)溶液【配制方法】将9.82g乙酸钾溶解于90ml纯水中,用2mol/L 乙酸调节pH值至7.5后加入纯水定容到1L,保存于-20℃。
25.乙酸钾溶液(用于碱裂解)【配制方法】在60ml 5mol/L乙酸钾溶液中加入11.5ml冰乙酸和28.5ml 水,即成钾浓度为3mol/L而乙酸根浓度为5mol/L的溶液。
26.3mol/L乙酸钠(pH5.2和pH7.0)溶液【配制方法】在80ml水中溶解408.1g三水乙酸钠,用冰乙酸调节pH值至5.2或用稀乙酸调节pH值至7.0,加水定容到1L,分装后高压灭菌。