无机推断与无机综合训练4、21
- 格式:doc
- 大小:196.85 KB
- 文档页数:4

2020-2021高考化学《高无机综合推断的综合》专项训练及答案一、无机综合推断1.已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
甲、乙、丙三种化合物的分子中含有相同数目的电子;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,化合物丁与C的某种单质在常温下反应可生成红棕色气体;B、C、D三种元素的单质与甲、乙、丁三种化合物之间存在如图所示的转化关系(反应条件已略去):(1)D在元素周期表中的位置为________________。
(2)B、C、D的原子半径的大小关系为________(用元素符号表示)。
(3)丁与C的单质在常温下反应的化学方程式为______________。
(4)甲、乙、丙分子中的电子数均为________,实验室如何检验丙_______ 。
(5)C的单质+丙→乙+丁的化学方程式为_______________。
【答案】第2周期ⅤA族 N>O>F 2NO+O2===2NO2 10 能使湿润的红色石蕊试纸变蓝色 5O2+4NH36H2O+4NO【解析】【分析】本题有几个重要的突破口:①甲、乙、丙三种化合物的分子中含有相同数目的电子;②丙为无色有不同刺激性气味的物质;③化合物丁与C的某种单质在常温下反应可生成红棕色气体,说明丁为NO,C的某种单质可能为O2。
【详解】A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种化合物:甲、乙、丙。
化合物丁与C的某种单质在常温下反应可生成红棕色气体,则丁为NO、C为O元素;丙与甲、乙均能发生化学反应,且甲、丙为无色有不同刺激性气味的物质,由图中信息可知,丙与O元素的单质反应生成NO,也可以由O的单质与D的单质化合而得,则丙为NH3、D为N元素,乙为H2O;甲、乙、丙三种化合物的分子中含有相同数目的电子,则其都有10个电子,结合图中信息,B的单质可以与H2O反应生成甲和O 元素的单质,故甲为HF、B为F元素。

2020届高三化学二轮复习实验题必练-无机综合推断1.锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如图:(1)1mol焦炭在过程Ⅰ中失去______ mol电子.(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为______ .(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为______ .(4)整过生产过程必须严格控制无水,回答下列问题:①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为______ .②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中.冷却的作用是______ .(5)Zn还原SiCl4的可逆反应如下:SiCl4(g)+2Zn(s)=Si(s)+2ZnCl2(g)△H<0下列说法正确的是______A.还原过程需在无氧的气氛中进行B.投入1molZn可生成14g还原产物C.增加SiCl4(g)的量,该反应平衡常数不变D.若SiCl4(g)过量可增大△H的值(6)有一种由硅制作的材料中常加入Ag2SO4,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的K sp=______ ;(两位有效数字)2.[化学——选修2:化学与技术](15分)磷矿石主要以磷酸钙[Ca3(PO4)2·H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。
图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。
图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。
图(a)图(b)部分物质的相关性质如下:熔点/℃沸点/℃备注白磷44280.5PH3−133.8−87.8难溶于水,有还原性SiF4−90−86易水解回答下列问题:世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的%。

备战高考化学高无机综合推断综合题一、无机综合推断1.X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。
请回答下列问题:(1)元素X的名称是______,丙分子的电子式为______。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。
丙在一定条件下转化为甲和乙的反应方程式为____________________________________________。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键【答案】氢 NO 4NH3+5O24NO+6H2O C【解析】【分析】由X、Y、Z三种主族元素,原子序数依次增大且原子序数小于10,它们的单质在常温下都是常见的无色气体可知,三种气体单质为氢气、氮气、氧气,X为H元素、Y为N元素、Z 为O元素,由在适当条件下,三者之间可以两两发生反应生成分别是双原子、三原子和四原子的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3可知,甲为NO、乙为H2O、丙为NH3。
【详解】(1)元素X为H元素,名称为氢;丙为共价化合物NH3,电子式为,故答案为氢;;(2)甲为无色气体NO,NO与氧气反应生成红棕色的二氧化氮;氨气与氧气发生催化氧化反应生成一氧化氮和水,反应的化学方程式为4NH3+5O2 4NO+6H2O,故答案为4NH3+5O24NO+6H2O;(3)由化合物丁是一种含H、O、N三种元素的强酸可知,丁为HNO3,HNO3与NH3按物质的量之比1:1混合反应生成NH4NO3,NH4NO3为离子化合物,含有离子键和共价键,故答案为C。

2020-2021高考化学高无机综合推断综合题及详细答案一、无机综合推断1.下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。
各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):(1)A的电子式:___________________;(2)写出甲与C反应的化学方程式:________________________________;(3)在F和E的混合溶液中用___________试剂(填化学式)检验E中阳离子;(4)整个转换过程中属于氧化还原反应的有___________个;(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式___________________。
【答案】3Fe + 4H2O(g) Fe3O4 + 4H2KMnO46个6Fe2+ + 3Na2O2 + 6H2O = 4Fe(OH)3↓ + 2Fe3+ + 6Na+【解析】【分析】由题意可知,G为淡黄色固体化合物,J为生活中常见的调味品,则G是Na2O2, J为NaCl;I为红褐色固体,则I是氢氧化铁,甲是Fe单质;B、D分别为黑色粉末和黑色晶体,Fe与物质C发生置换反应生成另一种非金属单质,根据Fe与水蒸气在高温条件下反应生成氢气和黑色固体四氧化三铁可知C是水,乙是氢气,D是Fe3O4;A与B反应生成水和一种非金属单质,且①是实验室制取丁的反应之一,判断A是过氧化氢,B是二氧化锰,过氧化氢在二氧化锰做催化剂作用下发生分解反应生成水和氧气,所以丁是氧气;四氧化三铁与K反应生成两种物质E、F,可以相互转化,则K是盐酸,盐酸与四氧化三铁反应生成氯化亚铁和氯化铁,F与Fe反应生成E,则F是氯化铁,E是氯化亚铁,氯化铁与过氧化钠反应生成氢氧化铁、氯化钠、氧气,氯化亚铁与一定量的过氧化钠反应生成氯化铁、氢氧化铁、氯化钠。
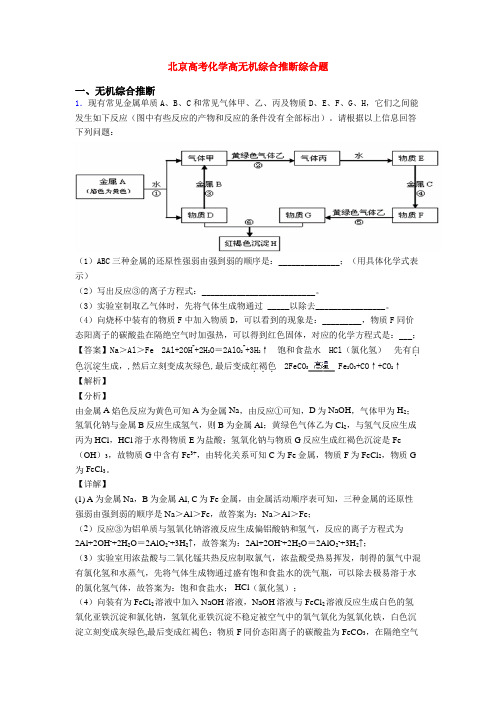

高考化学高无机综合推断(大题培优易错难题)一、无机综合推断1.现有H、N、O、Na、S、Cl、Fe、Cu八种常见元素,回答下列问题:(1)Cl在周期表中的位置____________________;(2)Na+离子的结构示意图为__________________;(3)能说明非金属性Cl比S强的事实是_____________(用化学方程式表示);(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。
F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。
它们有如下图所示的关系(部分反应条件及产物已略去):①C的化学式为____________________;②D的电子式为____________________;③L的稀溶液与H反应的离子方程式为_________________;④反应(a)的化学方程式为_______________。
【答案】第3周期ⅦA族 Cl2+H2S=S↓+2HCl Cu3N 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10H2O = 4Fe(OH)3↓+8NaOH + 3O2↑【解析】【分析】前三问考查了元素周期表中“位构性”三者关系,后一问为无机推断大题,其推导思路: B 是最常见的液体则为水;E呈红褐色为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠;F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为Cu,C 中两元素的质量比为96:7,C分解得到G和H,可知生成Cu和氮气,故C为Cu3N,G为氮气;氮气与氧气放电生成NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸;I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。
2021年高考化学真题分项解析专题14《无机综合与推断》1.【xx新课标Ⅰ卷理综化学】(14分)硼及其化合物在工业上有许多用途。
以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:回答下列问题:(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用的磁性,可将其从“浸渣”中分离。
“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。
然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。
以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
【答案】(1) Mg2B2O5·H2O+2H2SO42MgSO4+2H3BO3;减小铁硼矿粉粒径、提高反应温度。
(2) Fe3O4; SiO2和CaSO4;(3)将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物而除去。
(4)(七水)硫酸镁(5)(6) 2H3BO3 B2O3+3HO B2O3+3Mg 3MgO+2B【考点定位】元素及其化合物知识;化学工艺常识;物质结构。
本题是以化学工艺为素材,选材冷僻,试题难度为很难等级。
【名师点晴】我认为这道题是一道好题,层次分明,有区分度。
本题有考查“双基”——提速措施;四氧化三铁的磁性;制单质硼的反应。
也有考查知识综合运用能力——Mg2B2O5·H2O与硫酸反应;净化除杂两步实验操作的作用;两处成分的判断。
2020-2021高考化学高无机综合推断(大题培优易错难题)及详细答案一、无机综合推断1.现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的名称:丙-_______________;(2)写出下列物质的化学式:F________________;(3)气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。
请你根据所学知识回答下列问题:① 把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因__________________。
② 某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。
其反应原理为:(用化学方程式表示)______________。
【答案】氯化氢 Ca(ClO)2先变红后褪色氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色 Cl2+2NaOH=NaCl+NaClO+H2O 【解析】【分析】金属单质A和氧气反应生成淡黄色固体G,所以A是钠、G是过氧化钠;乙是黄绿色气体,乙是氯气;钠与水反应生成氢气和氢氧化钠;氢气和氯气生成氯化氢,氯化氢溶于水生成盐酸;浓盐酸与二氧化锰加热生成氯气;氯气与石灰乳反应生成漂白粉;氢氧化钠与氯气生成次氯酸钠。
据此分析解答。
【详解】(1)根据以上分析,丙是氯化氢;(2)F是Ca(ClO)2;(3)①把氯气通入紫色石蕊溶液中,氯气与水生成盐酸和次氯酸,溶液呈酸性,石蕊变红色,次氯酸具有漂白性,所以石蕊褪色,可以观察到的现象是:先变红后褪色;②氢氧化钠与氯气生成次氯酸钠的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
2.A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。
中考期间无机推断专题练习二1、右图示,A 为一种常见的单质,B 、C 、D 、E 是含A 元素的常见化合物,它们的焰色反应均为黄色,反应①的条件为加热。
填写下列空白:⑴写出B 电子式: ,B 中含有的化学键类型:C 的电子式 。
⑵写出下列反应化学反应方程式:① 。
③ ⑥ 。
⑶写出下列反应的离子方程式:② ,⑤ 。
⑷写出反应④的化学方程式并找出氧化剂还原剂以及单线桥标出电子转移的数目和方向。
⑸工业上如何制取物质A?用方程式表示:⑹可通过重要的工业反应来制取C ,用离子方程式表示:2、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁四种化合物有如图所示的转化关系,已知C 为密度最小的气体,甲是电解质。
根据以上转化关系回答:⑴写出下列物质的化学式: A________,B________,乙________⑵组成A 的元素的原子结构示意图_____________,丙的电子式为______________。
⑶写出下列变化的方程式:①A 与NaOH 溶液反应的离子方程式:_________________ __。
②乙与适量的HCl 反应的离子方程式:______________________________ _______。
如将HCl 改为其它气体,则不需控制气体的量,写出相应的离子方程式:③甲与NaOH 溶液反应的化学方程式:_________________ ____________________。
④工业上如何制取A 物质,其方程式:⑤写出其丁的电离方程式: ⑥写出A 与氧化铁反应的化学方程式: 。
如何引发该反应? ⑷写出A 的两种用途: 、3、下图是部分元素的单质及其化合物的转化关系图(有关反应的条件及部分反应物或生成物已略去);已知:C 、D 、F 均为单质,其中C 、D 在常温、常压下是气体;反应②是化工生产中的重要反应,生成物E 具有漂白性;J 、K 均为不溶于水的沉淀,其中J 为红褐色。
年级高三学科化学版本苏教版内容标题无机推断与综合【本讲教育信息】一、教学内容:无机推断与综合二、教学目的掌握无机推断题的解题思路和方法,信息的理解和分析三、教学重点、难点无机推断题的解题思路和方法,信息的理解和分析四、教学过程:无机推断题是高考常见题型之一,其集根本概念、根本理论、元素及其化合物等知识于一体,几乎覆盖了大纲要求的全部知识点,具有考察面广、综合性强、考虑容量大等特点,能较好地考察学生对已学过的知识进展重组、转换、迁移和解决问题的才能、逻辑推理才能以及分析综合才能。
〔一〕无机推断题的分析思路由于无机推断题综合性强,涉及面广,对思维才能要求较高,所以必须先理清思路。
按以下步骤分析题目,往往能迅速理清思路,高效解题。
审题→挖掘、挑选信息→联络已学知识→寻找打破点→推理判断→得出结论→正向求证审题,就是阅读题目的过程。
先阅读全题形成一个整体印象,再仔细领会题意,反复推敲、认真辨析,注意题目所给的限制性语句,把条件找准、找全。
条件找出来以后,经过与大脑中储存的知识信息相比拟,对信息、条件进展加工、挑选,目的是找出解决问题的打破点。
打破点可以是物质的特殊性质、反响所需的特殊条件、反响所产生的特殊现象等。
找到打破点后再联络已学过的知识,进展推断,推断时既可正向推断,又可逆向推断,通过挑选、论证,然后得出结论。
最后按正向顺序代入推断结果进展检验以确保答案的准确性。
〔二〕根本解题方法: “打破点〞法找准打破点是解无机推断题的关键,也是解无机推断题的根本方法。
根据“打破点〞的类型不同,可分为以下几种:1. 以特殊现象为打破点[例1]以下图每一方框中的字母代表一种反响物或生成物。
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。
试填写以下空白:〔1〕L的化学式为__________________〔2〕F的化学式为__________________〔3〕J受热分解反响的化学方程式为___〔4〕H和G之间反响的化学方程式为_______解析:此题的打破点是:D是淡黄色固体单质,且可以在空气中燃烧,那么D应是单质硫,G应是SO2,H应是H2S,L应是H2O。
无机推断与无机综合训练1、V 、W 、X 、Y 、Z 是由周期表中1~29号部分元素组成的5种化合物,其中V 、W 、X 、Z 均为两种元素组成。
上述5种化合物涉及的所有元素的原子序数之和等于35。
它们之间的反应关系如下图:(1)5种化合物分别是V__________、W__________、X__________、Y__________、Z__________;(填化学式)(2)由上述5种化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合中的所有元素,生成该化合物的化学方程式是_________________。
(3)V 的电子式是____________________。
2、已知A 、B 、C 、D 四种不同的粒子,它们之间存在如图所示的关系:(1)如果A 、B 、C 、D 均是10电子的粒子,则C 的结构式为____________________;D 的电子式为____________________。
(2)如果A 为一种金属阳离子,且A 、B 、D 均为10电子粒子,C 为30电子粒子。
试写出:A 与B 在溶液中反应生成C 和D 的离子方程式____________________;C 与H +反应生成A 的离子方程式____________________。
3、已知A~F 是中学化学中的常见物质,其中A 、C 、E 、F 为气体,B 、D 为液体,D 的消费量常作为一个国家工业发达水平的一种标志,F 的浓溶液与X 共热,通常用于实验室制备单质C ,X 是一种黑色粉末,B 分子中有18个电子。
反应中部分生成物已略去,试回答下列问题。
(1)根据图中信息,B 、C 、D 、X 氧化性由强到弱的顺序是__________。
(2)B 的电子式是__________。
(3)写出反应②的化学方程式:____________________。
(4)写出反应①、②的化学方程式: ①______________________________。
②______________________________。
4、18世纪中期欧洲人在寻找金矿时发现了一种金光闪闪的黄色矿石B 误以为发现了露天金矿,但将矿石B 隔绝空气加强热后发现,金光闪闪的矿石B 转化为黑色固体A 和另一种难溶于水而易溶于CS 2的淡黄色单质,故后来矿石B 被戏称为“愚人金”实验测A 、B 有如下转化关系:根据上述框图所示的转化关系回答:(1)写出化学式:A___________;B:___________;(2)写出高温煅烧A 、B 的化学方程式___________。
(3)写出下列反应的化学方程式:K 烯烧生成D :____________________________________________。
G 溶液和溴水反应:______________________。
(4)用离子反应方程式表示A 和I 溶液反应生成G 和K 的过程: ______________________________________________________________ ______________________________________________________________ 5、已知B 、C 为常见的两种金属单质,E 、I 为常见的两种非金属单质,反应②为D 的浓溶液与C 在加热条件下的反应。
P 溶液和G 溶液中具有相同的阳离子。
请根据要示求回答下列问题:(1)写出I 的化学式____________________________。
H+CAB D H+ V (固体) W (白色固体) Y (白色固体) OH + + X (无色无味气体) Z (无色气体) O X+H 2OH O D E +水 ①A B CEF D+X ④③ ⑤+X ⑥ ②△+Cu TNT 溶液 NaOH 煅烧 C DK A I C D 煅烧 H E F 溴水 I 浓硝酸 甲苯 G B 煅烧 燃烧(2)写出反应①中阴极发生的电极反应式__________;写出反应①的化学方程式____________________。
(3)写出反应④的离子方程式____________________;写出反应⑤的离子方程式____________________;写出反应⑥的离子方程式__________________。
(4)每生成1molK ,反应放出98.3kJ 热量,该反应的热化学方程式为____________________ __________。
6、如图中各物质均由常见元素(原子序数≤20)组成。
已知A 、B 、K 为单质,且在常温下A 和K 为气体,B 为固体。
D 为常见的无液体。
I 是一种常用的化肥,在其水溶液中滴加AgNO 3溶液有不溶于稀HNO 3的白色沉淀产生。
J 是一种实验室常用的干燥剂。
它们的相互转化关系如下图所示(图中反应条件未列出) 请回答下列问题: (1)I 的化学式为________;J 的电子式为________。
(2)反应①的化学方程式为________________________。
(3)F 的水溶液与氯气反应的离子方程式为________________。
7、中学化学几种常见物质的转化关系如下(有些生成物已略去):其中A 、a 是单质,其余为化合物,E 在溶液中是红褐色沉淀,请回答下列问题: (1)写出指定物质的化学式:A_________、C_________、a_________。
(2)写出下列反应的离子方程式:①D+b →E+F :__________________, ②C 与等物质的量的Na 2O 2在溶液中反应:___________________________。
(3)由D 的饱和溶液可以制得E 为分散质的胶体,该胶体中E 粒五直径的大小范围是_________;若要提纯E 为分散质的胶体,采用的操作方法叫_______。
(4)D 的水溶液呈_________性(填“酸”“碱”或“中”),为抑制这一变化,通常在配制D 溶液时,采取的方法是___________________________。
8、下图为中学化学中常见物质之间化学反应关系的图示,其中A 的焰色反应呈黄色,F 为有刺激性气味的气体,E 为黄绿色气体,G 为强酸性溶液,H 为既难溶于水,也难溶于稀酸的白色固体。
试回答:(1)写出化学式:A 、________,B 、________。
①C →E :________________________。
②E+F+H 2O →G :________________________。
9、某厂的酸性工业废水中含有一定量的Fe 3+、Cu 2+、Au 3+等离子。
有人设计了如下图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白: (1)图中标号处需放入的相应物质分别是①________②________③________④________⑤________。
(2)写出①处发生反应的离子方程式________________;写出③处发生反应的化学方程式________________;(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________;氧化铜________________。
10、中学化学中几种常见物质的转化关系如下:将D 溶液入沸水中可得到以F 为分散质的红褐色胶体。
请回答下列问题: (1)红褐色胶体中F 粒子直径大小的范围:____________。
(2)A 、B 、H 的化学式:A______、B______、H______。
(3)①H 2O 2分子的电子式:______。
D +S A +HCl B C +HCl + a + b F+H O 电解E I C D E B点烯 ② △ N M A F H ④H NaOH 一定条件 PE ③A 的 水溶液 电解 ① B ⑤ NaOHG XY E 工业废水 ① E A ② F B C 金 D 氧化铜 铁红 ④ ③ Na OA B C D 氨水 EF 过量浓硫酸硫 △ 稀硫酸A+H②写出C的酸性溶液与双氧水反应的离子方程式:__________________。
(4)写出鉴定E中阳离子的实验方法和现象:__________________。
(5)在C溶液中放入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:________________________。
11、A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。
下述为相关实验步骤和实验现象:请回答:(1)写出A、B和C的化学式:A_________,B_________,C_________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_________。
(4)写出F→H的化学方程式:____________________________________。
12、A、B、C、D均为短周期元素,B与A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18;A、B、D可形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性。
请回答:(1)元素符号:A_________,B_________,C_________,D_________。
(2)写出化学方程式:A2和X反应______________________________________________________。
(3)B4A3D2的化学式为_________,其水溶液呈酸性的离子方程式为____________________________________。
(4)X是_________分子(填“极性”或“非极性”),它的空间构型是_________;液态X能电离(可根据B2A电离推知),写出其电离方程式:___________________________。
13、铝、铁和氯是三种运用广泛的元素。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:________________;若将此反应设计成原电池,写出电极反应式:正极反应__________________,负极反应___________________________。
(2)工业上用电解饱和食盐水的方法制取氯气,制得的氯气与另一电解产物在一定条件下反应生成两种盐A和B,其物质的量之比为5:1,则盐A和B的化学式依次为_________,盐B在酸性条件下可与草酸(H2C2O4)反应制得气体ClO2,写出该反应的离子方程式:___________________________,ClO2是当前对饮用水进行消毒的一种高效消毒剂,物质的量相等的ClO2和Cl2相比较,ClO2的消毒杀菌能力是Cl2的_________倍。