IL-10在无瘢痕再生愈合中的作用
- 格式:doc
- 大小:1.41 MB
- 文档页数:9

il-10和il-1β趋势一样IL-10和IL-1β是两种常见的细胞因子,在机体的免疫调节过程中具有重要的作用。
IL-10被认为是一种抗炎细胞因子,而IL-1β则是一种炎性细胞因子。
虽然两者的功能截然不同,但它们的分泌趋势是相似的,这为我们深入了解免疫反应提供了线索。
IL-10是一种由多种免疫细胞分泌的细胞因子,包括T细胞、巨噬细胞、树突状细胞和B细胞。
IL-10的主要作用是抑制炎性反应,它可以抑制各种细胞因子(如TNF-α、IL-1β、IL-6等)的产生,促进细胞因子的降解,从而缓解炎症反应。
此外,IL-10还可以抑制T细胞的活化,减少细胞毒性T细胞(CTLs)的杀伤作用,保护机体正常细胞的完整性。
IL-10一般在机体遭受某些细菌、病毒或致病微生物侵入时被激活。
当机体的免疫系统检测到有外来物质(抗原)侵入时,T细胞会分泌多种细胞因子,从而引起细胞的炎性反应,这是机体自我保护的一部分。
但过度的炎性反应会导致组织损伤和疾病进展。
IL-10的分泌可以抑制炎性反应,保护组织免受过度的炎性破坏。
与IL-10不同,IL-1β是一种炎性细胞因子。
它由单核细胞、树突状细胞和T细胞等多种免疫细胞分泌。
IL-1β的主要作用是激活炎症反应,在组织损伤、细菌感染和肿瘤发生等情况下起作用。
IL-1β的分泌能够吸引白细胞、单核细胞和中性粒细胞等炎性细胞浸润到组织中,从而导致组织损伤和炎性疾病。
IL-1β的分泌过程比IL-10更加复杂。
当机体检测到外来抗原时,可以通过T细胞和巨噬细胞重组IL-1β基因,从而产生IL-1β蛋白质。
IL-1β的分泌受到内源性信号分子的调控,例如肿瘤坏死因子(TNF-α)和IL-6。
这些信号分子会激活巨噬细胞,从而促进IL-1β的产生和分泌。
此外,也有一些微生物能够刺激免疫细胞分泌IL-1β,例如细菌的脂多糖(LPS)。
尽管IL-10和IL-1β具有截然不同的作用,在细胞因子分泌过程中,它们之间存在一定的趋势相关性。

皮肤创伤修复中IL一10、Ik-4时序性表达的实验性研究华中科技大学同济医学院法医学系研究生:张慧导师:秦启生教授吴焕明教授摘要TE确推断损伤时问在法医学检案中具有重要的司法鉴定意义。
由于机体对损伤的反应受多种因素的影响,加之检测方法和“标志物”等原因限制,损伤时间推断至今仍为法医学界关注的热点及难题。
目前资料表明,创伤局部的细胞因子在创伤修复过程中表达多有一定变化,不同细胞因子表达的时序和峰值也各不相同。
由于这种动态变化规律与损伤时间相关,因而可考虑作为推断损伤时间的参数。
近来研究发现,抗炎症细胞因子IL—10、IL一4、TGF等具有抑制促炎症细胞因子的产生、影响单核细胞的功能和激活结缔组织细胞等生物活性,在创伤修复的不同时程发挥作用,保证创伤修复的顺利进行。
为了解抗炎症细胞因子在创伤修复过程中的表达变化与损伤时问的关系,本研究对小鼠皮肤切创愈合过程中IL一10和IL一4的表达变化进行了探讨。
本课题选用成年清洁级昆明小鼠,建立小鼠臀背部皮肤切创动物模型,应用常规病理组织切片和免疫组织化学SABC法,观察实验小鼠不同时程的生前伤(0.5—168小时)及死后伤(1~6小时)皮肤切创局部的IL-10和1L4表达情况:并结合计算机图像分析技术对IL-10和IL4表年中科技土学弼湃t学盹挂区学蠢删-碛士舛宽t牛^格文摹,直杀嚣i达变化的规律与皮肤损伤时间的关系进行定量分析。
生前损伤组动物在臀背部的脊柱旁做一纵行的皮肤全层切口。
分别于伤后不同存活时间点处死,取创缘及周围的皮肤组进行观察。
死后伤组于动物处死后按照上述方法造创,在死后不同时间点取材。
对照组不做任何手术处理直接处死动物,在与损伤组臀背部相同部位取材。
标本经HE染色和免疫组化染色观察,对创伤局部皮肤整体表达IL一10和IL一4免疫组化染色结果进行计算机图像分析;同时,皮肤切创组织中IL—lO不同部位(表皮细胞及表皮下组织的浸润细胞)的表达变化分别进行定量分析,实验所得数据经统计学分析处理。


性激素促进创面愈合的相关研究和进展皮肤创面的愈合过程十分复杂,影响因素颇多,其中性激素的作用越来越受到关注。
伴随着社会老龄化的来临,老年患者延迟创面愈合的发病人数亦日益增多。
而老年男性患者急性皮肤损伤的愈合速度明显慢于同年龄的女性患者,且更容易转变为慢性溃疡的研究提示,内源性性激素对创面修复主要起重要作用,在组织修复中充当重要的角色。
临床观察中发现,不同性别之间的愈合能力存在差别,其中女性创面愈合的能力较强[1]。
若绝经后妇女接受激素替代治疗(hormone replacement therapy, HRT),创面愈合的能力将得到明显提高[2]。
动物实验也观察到类似的结果,Blankenhorm 等[3]研究发现,雌性鼠的愈合速度较雄性鼠快,各类数据表明,性别可能影响哺乳动物的创面愈合过程。
进一步研究发现,雌激素通过炎症反应,再上皮化,血管发生,基质沉积和组织重建等环节对皮肤愈合产生影响[4]。
雌激素可以通过调节细胞因子的水平增强皮肤的愈合能力,局部应用雌激素不仅加强女性也加强男性患者创面愈合能力[5]。
Merlo等[6]认为长时间应用雌激素确实可以刺激细胞增殖,但对细胞迁移的影响主要发生在治疗的前几个小时内。
选择性激活雌激素-β受体能在不增加转化生长因子-β(transforming growth factor,TGF-β)的前提下有效刺激创面愈合。
这都说明雌激素及其受体在创面愈合中发挥作用。
雄激素作为另一种重要的性激素,同样对创面愈合有一定作用。
临床观察中发现,青年患者、老年男性患者及接受HRT治疗的老年女性患者,当循环系统中雄激素水平降低时,创面愈合速率加快[1]。
在大鼠实验中,通过去势或阻断雄激素受体也可以加速创面愈合[7-8]。
在老年女性患者,雄激素高水平可以减弱炎症反应,加速创面愈合[9]。
因此,有个别学者认为,创面愈合的时间与雌激素及雄激素的水平并没有非常强的相关性[1]。
本文通过对雌雄激素与创面愈合文献的回顾,希望加深人们对性激素与创面愈合相关关系的理解,深入研究创面愈合的机制,并以此促进老年性创面难愈问题的解决。

・374・武警医学院学报ActaAeademiaeMedicinaeQ皤第18卷第4期2009年4月V01.18No.4Apt.2009胚胎创面无瘢痕修复的研究进展ProceedingOilthesearlessfetalwoundrepainnent陈伟综述,白晓东审校(武警总医院烧伤科,北京100039)关键词:端粒;端粒酶;羊水干细胞【文章编号】1008.5041(2009)04-0374-03【中图分类号】Q71【文献标识码】B胚胎创面无瘢痕修复是复杂的过程,除受到胚胎所处的羊水环境影响外,还受到胚胎细胞的端粒、细胞外成分、细胞因子等决定性因素的影响,羊水干细胞可能在胎儿无瘢痕修复过程中起到非常重要的作用。
瘢痕是皮肤损伤到达一定程度后组织修复的结果,然而人类和某些哺乳动物(小鼠、大鼠、兔、猪和羊等)胚胎的皮肤创伤,愈合后并不伴有瘢痕组织的形成…。
研究胚胎皮肤无瘢痕创伤修复的生物学机制,将为瘢痕及纤维化疾病的防治提供广阔的思路。
下面就胚胎皮肤创伤修复进行综述。
1胚胎皮肤伤口的细胞特性对一些动物胚胎皮肤创伤愈合的观察发现,无瘢痕修复并非贯穿妊娠期全程,对人类而言,胚儿(胎龄8—28周)伤口无急性炎症反应,无肉芽组织形成和无伤口收缩等特点,愈合后不伴有瘢痕形成【2]。
在妊娠晚期的创伤也可形成类似于成年的瘢痕组织。
因此在无创修复期的胚胎细胞应有其区别于其它细胞的特性。
1.1胚胎皮肤伤口的细胞染色体端粒胚胎是由精子和卵子受精后形成的受精卵不断分裂而来,正常睾丸里的精母细胞和卵巢里的卵母细胞都有染色体端粒的复制能力,无论分裂多少代都保留了端粒的原始结构¨J。
胚胎细胞染色体端粒仍然较完整的保留了性细胞端粒末端的结构,使胚胎创伤处的细胞增生迅速,随着胎龄的增长,细胞增生速度减慢形成类似于成人的瘢痕修复,推测与端粒结构在细胞分裂中逐渐缩短,失去原始末端结构有关。
1.2胚胎皮肤伤口细胞中的端粒酶端粒酶是一种能延长端粒末端并保持端粒长度的核糖【收稿日期】2008—11—21;【修回日期】2009—03—16【作者简介】陈伟(1981一),女,籍贯河北省承德市,硕士在读,研究方向为烧伤外科学。
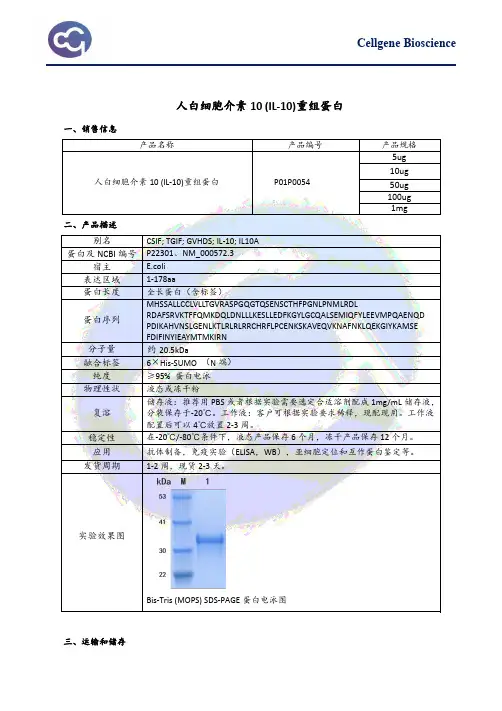
人白细胞介素10(IL-10)重组蛋白一、销售信息产品名称产品编号产品规格人白细胞介素10(IL-10)重组蛋白P01P00545ug 10ug 50ug 100ug1mg二、产品描述别名CSIF;TGIF;GVHDS;IL-10;IL10A 蛋白及NCBI编号P22301、NM_000572.3宿主 E.coli表达区域1-178aa蛋白长度全长蛋白(含标签)蛋白序列MHSSALLCCLVLLTGVRASPGQGTQSENSCTHFPGNLPNMLRDL RDAFSRVKTFFQMKDQLDNLLLKESLLEDFKGYLGCQALSEMIQFYLEEVMPQAENQD PDIKAHVNSLGENLKTLRLRLRRCHRFLPCENKSKAVEQVKNAFNKLQEKGIYKAMSE FDIFINYIEAYMTMKIRN分子量约20.5kDa融合标签6×His-SUMO(N端)纯度≥95%蛋白电泳物理性状液态或冻干粉复溶储存液:推荐用PBS或者根据实验需要选定合适溶剂配成1mg/mL储存液,分装保存于-20℃。
工作液:客户可根据实验要求稀释,现配现用。
工作液配置后可以4℃放置2-3周。
稳定性在-20℃/-80℃条件下,液态产品保存6个月,冻干产品保存12个月。
应用抗体制备,免疫实验(ELISA,WB),亚细胞定位和互作蛋白鉴定等。
发货周期1-2周,现货2-3天。
实验效果图Bis-Tris(MOPS)SDS-PAGE蛋白电泳图三、运输和储存2-8℃运输。
从收到之日起,在-20℃至-80℃的无菌条件下保存。
四、注意事项本产品仅作科研用途。
请穿实验服并戴一次性手套操作。
五、背景信息IL-10是由B细胞、Th1、Th2等适应性免疫细胞产生的多价生物因子。
IL-10激活巨噬细胞/单核细胞的广泛功能,包括单核细胞因子的合成,一氧化氮(NO)的产生,以及主要组织相容性复合体类Ⅱ(MHCⅡ)共刺激分子的表达,如IL-12和CD80/CD86。

IL-10(白细胞介素-10)是一种细胞因子,具有抗炎和免疫调节的作用。
IL-10受体是指与IL-10结合并传递信号的受体分子。
IL-10受体可以分为两类:IL-10R1和IL-10R2。
1. IL-10R1:IL-10R1是IL-10受体的主要亚单位,它与IL-10结合后形成高亲和力的复合物。
IL-10R1是一种细胞膜上的受体,广泛分布在多种免疫细胞表面,如单核细胞、巨噬细胞、树突状细胞和B细胞等。
IL-10R1的结构包括外膜区、跨膜区和胞浆区,胞浆区与信号传递相关。
2. IL-10R2:IL-10R2是IL-10受体的辅助亚单位,它与IL-10R1共同形成功能完整的IL-10受体复合物。
IL-10R2主要存在于细胞膜上,与IL-10R1结合后增强了IL-10与细胞膜的亲和力。
IL-10R2的结构也包括外膜区、跨膜区和胞浆区,胞浆区与信号传递相关。
IL-10受体的结合和信号传递可以调节多种免疫细胞的功能,抑制炎症反应和免疫应答,起到抗炎和免疫调节的作用。
研究IL-10受体的分类和功能有助于深入理解免疫调节的机制,并为相关疾病的治疗提供新的思路。

IL10升高的临床意义
IL-10(白细胞介素-10)是一种免疫调节因子,它起着重
要的抗炎作用。
IL-10的升高在临床上可能具有以下几个意义:
1. 抑制免疫反应:IL-10能够抑制炎症反应和免疫细胞的活化,减少炎症介质的释放,从而降低免疫反应。
在炎症性
疾病如风湿性关节炎、炎症性肠病等中,IL-10的升高可以减轻炎症症状,缓解疾病的进展。
2. 免疫耐受:IL-10能够促进免疫系统对自身抗原的耐受,抑制自身免疫反应。
在自身免疫性疾病如系统性红斑狼疮、多发性硬化症等中,IL-10的升高可以减少自身免疫攻击,缓解疾病的发展。
3. 对肿瘤的抑制作用:IL-10能够抑制肿瘤细胞的生长和扩散,并促使肿瘤细胞凋亡。
IL-10的升高在肿瘤治疗中可能有助于增强免疫反应,抑制肿瘤生长。
4. 预后评估:IL-10的升高在某些疾病中可能与预后有关,如感染性疾病、重症肺炎等。
通过监测IL-10水平的变化,可以评估疾病的进展和治疗效果。
综上所述,IL-10的升高在临床上可能与炎症调节、免疫耐受、肿瘤抑制和预后评估等方面有关。
然而,IL-10的升高在临床上的具体意义还需要进一步的研究和证实。
医生应综合考虑患者的病情和其他指标来综合评估。

第59卷 第2期2023年04月青岛大学学报(医学版)J O U R N A LO FQ I N G D A O U N I V E R S I T Y (M E D I C A LS C I E N C E S)V o l .59,N o .2A pr i l 2023[收稿日期]2021-03-25; [修订日期]2023-03-31[基金项目]山东省新旧动能转换重大工程重大课题攻关项目(鲁发改重大办[2018]1268号);山东省重大科技创新工程项目(2018C X G C 1404)[第一作者]王贞丽(1971-),女,硕士,副主任药师㊂E -m a i l :q d -w z h e n l i @163.c o m ㊂[通信作者]丁会芹(1987-),女,博士,高级工程师㊂E -m a i l:d i n g h u i q i n @k l t ph a r m.c n ㊂白细胞介素-10的免疫双重作用及抗炎应用进展王贞丽1,秦欢2,王建刚3,丁会芹2,3(1 中国人民解放军海军青岛特勤疗养中心质量管理科,山东青岛 266071;2 青岛大学基础医学院;3 康立泰生物医药(青岛)有限公司)[摘要] 白细胞介素-10(I L -10)是抗炎细胞因子,近年来,大量研究显示I L -10兼具免疫刺激和免疫抑制的双重作用㊂本文分析了I L -10发挥双重免疫调节作用的机制与主要抗炎作用通路,综述了I L -10在炎性疾病中的治疗潜力及I L -10的药物开发方向㊂[关键词] 白细胞介素10;免疫调节;炎症;基因治疗[中图分类号] R 979.5 [文献标志码] A [文章编号] 2096-5532(2023)02-0313-04d o i :10.11712/jm s .2096-5532.2023.59.061[开放科学(资源服务)标识码(O S I D )][网络出版] h t t ps ://k n s .c n k i .n e t /k c m s 2/d e t a i l /37.1517.R.20230522.1154.011.h t m l ;2023-05-23 17:09:07A D V A N C E S I NT H ED U A LI MM U N O R E G U L A T O R YR O L EO FI N T E R L E U K I N -10A N DI T SA P P L I C A T I O NI N A N T I -I N F L A M -M A T I O N WA N GZ h e n l i ,Q I N H u a n ,WA N GJ i a n g a n g ,D I N G H u i qi n (Q u a l i t y M a n a g e m e n tS e c t i o no fQ i n g d a oS p e c i a l S e r v i c eS a n a t o r i u m C e n t e r o f P L A N a v y ,Q i n gd a o 266071,C h i n a )[A B S T R A C T ] I n te r l e u k i n -10(I L -10)i s a na n t i -i nf l a mm a t o r y c y t o k i n e ,a n d i n r e c e n t y e a r s ,a l a r gen u m b e r o f s t u d i e sh a v e s h o w n t h a t I L -10h a s t h e d u a l r o l e o f i mm u n o s t i m u l a t i o n a n d i mm u n o s u p p r e s s i o n .T h i s a r t i c l e a n a l yz e s t h em e c h a n i s mo f t h e d u a l i mm u n o r e g u l a t o r y r o l e o f I L -10a n d t h em a i n a n t i -i n f l a mm a t o r y p a t h w a y s o f I L -10a n d r e v i e w s t h e t h e r a p e u t i c p o t e n t i a l o f I L -10i n i n f l a mm a t o r y d i s e a s e s a n d t h e f u t u r e d i r e c t i o n f o r d r u g d e v e l o pm e n t .[K E Y W O R D S ] i n t e r l e u k i n -10;i mm u n o m o d u l a t i o n ;i n f l a mm a t i o n ;g e n e t i c t h e r a p y30年前,人们首次发现白细胞介素-10(I L -10),认为其是T h 2细胞分泌的标志性细胞因子㊂在I L -10发现初期,人们便证明它可以抑制T h 1细胞产生炎性细胞因子[1],以及通过下调主要组织相容性复合体Ⅱ(MH C -Ⅱ)抑制单核细胞的抗原递呈能力,从而阻止T 细胞特异性增殖[2]㊂但随着研究的深入,人们逐渐发现I L -10不仅具有抗炎的免疫抑制作用,同时又有免疫刺激作用,这可能是阻碍I L -10临床应用的重要原因㊂本文通过对I L -10免疫双重作用的分析及抗炎作用的机制研究进展进行综述,分析I L -10抗炎方面的治疗潜力,旨在为I L -10抗炎作用的临床应用和药物开发提供参考依据㊂1 I L -10结构与来源I L -10是由两个非共价键结合的单体组成的同型二聚体分子,分子量约36000,每个单体由160个氨基酸组成,在单体之间存在两个二硫键连接㊂I L -10主要由活化的T 细胞㊁单核细胞㊁巨噬细胞㊁树突状细胞㊁自然杀伤细胞和B 细胞分泌,其中T 细胞是I L -10的主要来源[3]㊂值得注意的是,近年来研究显示,一些非造血细胞(如上皮细胞)也能够产生I L -10,当内源性和外源性递质(例如脂多糖㊁儿茶酚胺和c AM P 升高药物)激活这些细胞时,I L -10就会释放出来[4]㊂2 I L -10在免疫反应中的双重作用及影响因素早先的研究认为,I L -10的主要作用是抑制炎症反应㊂然而,近些年的研究结果却表明I L -10可能存在免疫双重作用,即在某些情况下促进炎症反应的发生而非抗炎,这一作用可能是阻碍I L -10在炎症性疾病中应用的原因之一㊂例如,R E N N I C K 等[5]研究发现,I L -10缺陷型小鼠自发性发展为炎症性肠病(I B D ),体内产生大量促炎细胞因子;而过表达I L -10的小鼠可以抵抗葡聚糖硫酸钠诱导的结肠炎,这表明内源性I L -10能够预防I B D 的发生㊂此外,I L -10在胰腺炎[6]㊁糖尿病[7]㊁脓毒症[8]动物模型中均表现出了抑制炎症作用㊂然而临床研究结果却与预期相反,给予重组人源I L -10(r h I L -10)病人临床症状并没有显著地改善,且疗效在病人间存在较大差异,r h I L -10对疾病严重程度高㊁内源性I L -10血清水平低病人的疗效高于疾病严重程度低㊁I L -10血清水平高的病人[9];此外,低至中剂量的r h I L -10给药可改善病人临床症状,而高剂量r h I L -10全身给药促进疾病进展,这与血清促炎细胞因子水平升高有关[10]㊂以上研究结果提示,I L -10的免疫双重作用取决于炎症程度和I L -10剂量,此外还与靶细胞类型㊁免疫反应阶段等有关系㊂2.1 I L -10作用于不同靶细胞介导不同的免疫效应I L -10在免疫系统中的作用可以分为固有免疫与适应性免疫两个方面㊂在固有免疫中I L -10作用于抗原递呈细胞Copyright ©博看网. All Rights Reserved.314青岛大学学报(医学版)59卷(A P C s),主要诱导免疫抑制反应㊂A P C s如巨噬细胞(Mø)和树突状细胞(D C s)表达高水平的I L-10受体(I L-10R),并在激活后进一步上调其表达[11],A P C s中I L-10信号通路的一般功能是维持免疫稳态,抑制促炎反应㊂因此,在固有免疫中I L-10发挥抗炎作用㊂而适应性免疫中I L-10发挥免疫双重作用,这取决于T 细胞的异质性㊂T细胞主要参与适应性免疫,不同于A P C s 本身高表达I L-10R,T细胞一般在激活后才上调I L-10R,即在幼稚T细胞中表达最低,在记忆T细胞中表达最高[12]㊂因此,I L-10影响T细胞在不同炎症阶段的功能㊂一方面, I L-10在炎症过程中直接抑制C D4+T细胞亚群的促炎效应[13]㊂F o x p3高表达的C D4+T细胞是重要的促炎细胞,其表面表达C D40L蛋白,能够激活B细胞从而促进炎症的发生[14]㊂此外I L-10还可影响F o x p3+调节性T细胞(F o x p3+ T r e g)的稳定性,抑制炎症的发生㊂而1型调节T(T R1)细胞是一类F o x p3低表达的C D4+T细胞,其特征是表达多种共抑制受体(L A G-3㊁T I M-3㊁P D-1㊁C T L A-4㊁T I G I T)但不表达C D40L,研究发现I L-10能促进T R1细胞的稳定性和功能,发挥抗炎作用[15]㊂此外,I L-10还能够抑制T h17细胞的分化[16]㊂另一方面,I L-10调控C D8+T细胞可能发挥相反的效应,肿瘤内C D8+T细胞经I L-10诱导后释放I F N-γ和颗粒酶/穿孔素,I F N-γ一般可促进炎症,但也有报道认为其与I L-10可能在免疫抑制中起协同抗炎作用;另外,I L-10还刺激C D8+T细胞的细胞毒性功能以及记忆免疫的形成,发挥促炎作用[17]㊂2.2 T细胞中I L-10的浓度与功能的关系在健康志愿者体内进行的I L-10临床试验显示,在脂多糖(L P S)诱导内毒素血症的情况下,高剂量的r h I L-10除了能够抑制A P C s和C D4+T细胞活化外,还可诱导细胞毒性C D8+T细胞活化[18]㊂提示I L-10的双重功能不仅依赖于靶细胞,还依赖于I L-10的浓度,即A P C s和C D4+T细胞在低浓度和高浓度I L-10水平时均可以被控制,而C D8+T细胞则需要高浓度I L-10才能被激活㊂但是I L-10在什么情况下激活相同靶细胞(如C D8+T细胞㊁T h1细胞和T h17细胞)的促炎或抗炎信号还需要进一步的研究㊂此外,I L-10的细胞来源和辅助因子(如其他细胞因子)是否会影响I L-10的双重功能尚不清楚㊂在肿瘤治疗研究方面,N A I N G等[19]选择晚期实体瘤病人作为研究对象,聚乙二醇修饰的I L-10(P E G-I L-10)以1~ 40μg/k g剂量每日一次皮下给药,研究药物安全性和耐受性,结果表明P E G-I L-10可激活全身免疫反应,免疫刺激细胞因子升高,血清中转化生长因子β降低,其中1例葡萄膜黑色素瘤病人和4例肾细胞癌病人以20μg/k g剂量治疗8周后病情缓解㊂而在炎症性疾病的研究方面,F E D O R A K 等[20]应用r h I L-10(1~20μg/k g)治疗轻度至中度活动性克罗恩病病人,结果显示5μg/k g剂量的治疗效果最佳㊂此外T I L G等[21]研究显示,应用20μg/k g剂量r h I L-10皮下注射治疗克罗恩病会导致病人血清I F N-γ水平升高,不仅没有观察到对克罗恩病的临床疗效,反而观察到发热㊁头痛等副作用㊂以上结果提示低剂量I L-10可抑制C D4+T细胞发挥抗炎作用,用于治疗炎症疾病;而高剂量I L-10可诱导C D8+T 细胞活化,抗炎作用减弱,但可用于抗肿瘤治疗㊂3I L-10抗炎作用相关级联通路I L-10作用于靶细胞后发生何种反应取决于细胞表面I L-10R的参与和细胞内的信号级联[22]㊂I L-10R由α㊁β两个亚基组成,I L-10Rα主要表达于白细胞,与I L-10高亲和性结合,而I L-10Rβ则是广泛表达的,与I L-10辅助性结合㊂与I L-10Rα亚单位相关的J a n u s激酶(J A K)和与I L-10Rβ亚单位相关的酪氨酸激酶(T Y K)在I L-10的作用下发生磷酸化,然后激活信号转导蛋白和转录激活蛋白(S T A T s)同源/异源二聚化并移位到细胞核中,进而调节免疫反应,如降低MH C-Ⅱ的表达,减少A P C s分泌促炎细胞因子,以及上调参与调节巨噬细胞失活的肌腱膜纤维肉瘤基因B型蛋白,从而抑制炎性因子的表达㊂研究表明,除经典的J A K-S T A T 级联通路外,I L-10还可以通过激活磷脂酰肌醇-4,5-二磷酸-3-激酶(P I3K)/A k t级联通路,增强抗凋亡因子B c l-2和B c l-x l的表达,同时降低c a s p a s e-3的表达水平,从而阻止细胞凋亡[23]㊂E D D I E I P等[24]提出了另一条与I L-10代谢有关的机制通路:I L-10抑制L P S诱导的葡萄糖摄取和糖酵解,并促进氧化磷酸化;此外,I L-10通过激活S T A T-D D I T4通路抑制雷帕霉素靶蛋白(m T O R)靶点的活性来控制细胞代谢,并认为I L-10的这种代谢控制对炎症的控制至关重要㊂因此,与其多重来源一样,I L-10也靶向多种细胞和通过多种分子途径来抑制或刺激免疫反应[22]㊂4I L-10的抗炎应用研究进展4.1外源性I L-10蛋白治疗鉴于I L-10具有广泛的抗炎作用,人们首先想到通过应用外源性I L-10治疗疾病,目前已在多种动物模型或临床试验中证实了重组I L-10蛋白对疾病的疗效㊂MA Z E R等[25]通过建立小鼠脓毒症模型研究显示,I L-10一方面抑制单核细胞产生T N F-α,降低炎症反应;另一方面激活适应性免疫促进T细胞产生I F N-γ,激活机体抗感染反应,表明I L-10不论是对先天性免疫的抑制作用还是对适应性免疫系统的刺激作用均对脓毒症具有积极的治疗作用㊂K R I S HN A-MU R T H Y等[26]对小鼠急性心肌梗死模型研究显示,造模后第0㊁1㊁3㊁5㊁7天皮下注射50μg/k g重组I L-10可改善心室功能,减轻心肌纤维化,降低小鼠死亡率㊂HO S等[27]建立了角膜缝线诱导的大鼠角膜新生血管模型,结膜注射小鼠重组I L-10蛋白10μg/L治疗,结果表明I L-10可以抑制炎症反应并抑制血管生成,证明I L-10具有治疗病理性角膜炎的潜力㊂T I N S L E Y等[28]的研究显示,连续向孕鼠腹腔注射r h I L-10可减轻其子痫样症状㊂Z HA O等[29]用不同浓度I L-10处理小鼠视网膜色素上皮细胞(R P E),结果显示I L-10可抑制R E P细胞增殖和迁移,下调炎症因子分泌,表明I L-10Copyright©博看网. All Rights Reserved.2期王贞丽,等.白细胞介素-10的免疫双重作用及抗炎应用进展315具有改善风湿性视网膜脱离的潜力㊂尽管外源性I L-10蛋白治疗在动物实验中表现出了不错的效果,然而在临床试验中却并未表现出良好的疗效㊂原因可能是由于I L-10半衰期短,药代动力学不确定,作用机制复杂,很难通过简单地提供外源性I L-10蛋白来达到临床需求㊂4.2I L-10抗体药物治疗I L-10全身性给药不仅治疗效果不佳,还容易引起不良反应,新的开发策略倾向于I L-10的靶向给药㊂例如,由意大利P h i l o g e n公司开发的单克隆抗体-细胞因子融合蛋白F8-I L-10(D e k a v i l)就是基于抗体的药物传递策略,由人F8抗体(靶向纤维连接蛋白结构域A)与I L-10融合,能够在疾病部位传递和积累细胞因子,在治疗类风湿性关节炎(R A)和I B D中很有前景[30]㊂F R A N Z等[31]研究显示,F8/I L-10在慢性排斥反应发展过程中有治疗效果㊂G A L E A Z Z I等[32]在临床试验中应用F8/I L-10与甲氨蝶呤联合治疗R A,与安慰剂组相比显示出较好的疗效㊂Q I A O等[33]则开发了基于西妥昔单抗的I L-10融合蛋白,能够延长I L-10半衰期并有助于I L-10肿瘤靶向递送,具有更好的抗肿瘤效果㊂I L-10抗体药物解决了单独使用重组I L-10蛋白给药特异性差的问题,是未来新药开发的一个有效途径㊂4.3I L-10基因治疗基因治疗和基因编辑(基因的功能修饰)代表了人类疾病治疗的未来方向㊂I L-10的基因治疗同样成为了近年来主要的研究方向㊂C Y P E L等[34]在肺移植前使用编码I L-10的腺病毒载体(A d h I L-10)进行基因治疗以修复原发性移植物功能障碍导致的供体肺损伤,结果显示A d h I L-10治疗后肺功能(动脉氧压和肺血管阻力)有显著改善,促炎细胞因子表达向抗炎细胞因子表达转变,肺泡-血液屏障恢复完整性㊂O I S H I等[35]研究也显示,慢病毒I L-10基因疗法增加了肺移植模型小鼠I L-10的表达,具有积极作用㊂为了对抗移植排斥反应,J E O N G等[36]构建了携带巨细胞病毒I L-10(v I L-10)基因重组腺病毒载体,治疗供体大鼠1h后进行皮肤异体移植,结果证明移植物中的v I L-10基因提高了移植物存活率并减少急性排斥反应,证明I L-10基因治疗是预防移植排斥反应的一种有效的免疫抑制方法㊂此外,结肠炎小鼠模型直肠给药编码I L-10的慢病毒载体和腹腔注射编码I L-10的质粒均安全地穿透局部黏膜组织,对小鼠结肠炎有治疗作用[37]㊂将编码h I L-10质粒注入去卵巢大鼠牙龈,能抑制牙槽骨吸收,抑制促炎细胞因子的表达,治疗牙周炎[38]㊂不同于以上研究中直接使用I L-10基因载体,有研究构建了慢病毒C X C L10载体,以C X C L10启动子基因间接调节I L-10的过表达,结果显示R A病人滑膜细胞产生的炎症细胞因子减少,该研究提供了一种适用于R A的诱导型局部基因治疗方法㊂综上所述,I L-10是一种具有抗炎和促炎特性的多效细胞因子,炎症程度㊁I L-10剂量㊁靶细胞类型㊁免疫反应阶段等均可影响I L-10的抗炎效应㊂外源性重组I L-10蛋白已经在众多炎症性疾病动物模型中表现出了良好的药理作用,近年来,随着抗体药物与基因治疗的发展,研究者们开始致力于I L-10融合蛋白药物㊁抗体药物或基因治疗药物的开发㊂本综述聚焦在I L-10免疫调节双重作用的因素与I L-10成药性研究上,旨在为I L-10抗炎药物开发提供参考㊂[参考文献][1]F I O R E N T I N O DF,Z L O T N I K A,MO S MA N N T R,e ta l.I L-10i n h i b i t sc y t o k i n e p r o d u c t i o nb y a c t i v a t e d m a c r o p h a g e s[J].T h e J o u r n a l o f I mm u n o l o g y,1991,147(11):3815-3822.[2]N E UMA N N C,S C H E F F O L D A,R U T Z S.F u n c t i o n sa n dr e g u l a t i o no fTc e l l-d e r i v e d i n t e r l e u k i n-10[J].S e m i n a r s i n I m-m u n o l o g y,2019,44:101344.[3]WA N GXT,WO N G K,O U Y A N G WJ,e t a l.T a r g e t i n g I L-10f a m i l y c y t o k i n e s f o r t h et r e a t m e n to fh u m a nd i s e a s e s[J].C o l dS p r i n g H a r b o rP e r s p e c t i v e si n B i o l o g y,2019,11(2):a028548.[4]O U Y A N G W J,O G A R R A A.I L-10f a m i l y c y t o k i n e s I L-10a n d I L-22:f r o mb a s ic s c i e n c e t o c l i n i c a l t r a n s l a t i o n[J].I mm u-n i t y,2019,50(4):871-891.[5]R E N N I C K D M,F O R T M M.L e s s o n s f r o m g e n e t i c a l l y e n g i-n e e r e da n i m a lm o d e l s.Ⅻ.I L-10-d e f i c i e n t(I L-10(-/-)m i c ea n d i n t e s t i n a l i n f l a mm a t i o n[J].A m e r i c a n J o u r n a l o fP h y s i o l o-g y G a s t r o i n t e s t i n a la n d L i v e r P h y s i o l o g y,2000,278(6):G829-G833.[6]林荣贵.白介素-10对重症急性胰腺炎大鼠血脑屏障损伤的影响及机制研究[D].福州:福建医科大学,2018.[7]赵辉.过表达I L-10的脂肪间充质干细胞促进糖尿病小鼠慢性创面愈合的研究[D].北京:北京协和医学院,2019. [8]翁金森,林静萍,叶勇,等.I L-10对脓毒症大鼠心肌损伤保护作用的实验研究[J].福建医药杂志,2019,41(6):148-149, 162.[9]F E D O R A K R N,G A N G L A,E L S O N C O,e t a l.R e c o m b i-n a n t h u m a ni n t e r l e u k i n10i nt h et r e a t m e n to f p a t i e n t s w i t hm i l d t om o d e r a t e l y a c t i v eC r o h n s d i s e a s e.T h e I n t e r l e u k i n10I n f l a mm a t o r y B o w e l D i s e a s e C o o p e r a t i v e S t u d y G r o u p[J].G a s t r o e n t e r o l o g y.2000,119(6):1473-1482.[10]王佳丽,刘丽华.I L-10对肿瘤免疫双向调节的研究进展[J].中国肿瘤生物治疗杂志,2016,23(1):130-134.[11]WA N G W W,WA N GY M,L IK,e t a l.I L-10f r o md e n d r i t i cc e l l s b u t n o t f r o m Tr e g u l a t o r y c e l l s p r o t e c t s a g a i n s t c i s p l a t i n-i n d u c e d n e p h r o t o x i c i t y[J].P L o SO n e,2020,15(9):e0238816.[12]B E D K ET,MU S C A T EF,S O U K O U,e t a l.T i t l e:I L-10-p r o-d u c i n g Tce l l s a n d t h e i r d u a lf u n c t i o n s[J].S e m i n a r s i n I mm u-n o l o g y,2019,44:101335.[13]K UMA RR,N GS,E N GW E R D AC.T h e r o l e o f I L-10i nm a-l a r i a:ad o u b l ee d g e ds w o r d[J].F r o n t i e r si nI mm u n o l o g y, 2019,10:229.[14]V O G E LI,V E R B I N N E NB,MA E SW,e t a l.F o x p3+r e g u l a-t o r y Tc e l l s a r e a c t i v a t e d i n s p i t e o f B7-C D28a n dC D40-C D40Lb l oc k ad e[J].E u r o pe a nJ o u r n a l of I mm u n o l og y,2013,43(4):1013-1023.Copyright©博看网. All Rights Reserved.316青岛大学学报(医学版)59卷[15]B R O C KMA N N L,G A G L I A N IN,S T E G L I C H B,e t a l.I L-10r e c e p t o r s i g n a l i n g i s e s s e n t i a l f o rT R1c e l l f u n c t i o n i nv i v o [J].J o u r n a lo fI mm u n o l o g y(B a l t i m o r e,M d:1950),2017, 198(3):1130-1141.[16]L IQ S,A N D E R S O N C D,E G I L M E Z N K.I n h a l e dI L-10s u p p r e s s e s l u n g t u m o r i g e n e s i sv i aa b r o g a t i o no f i n f l a mm a t o r y m a c r o p h a g e-T h17c e l l a x i s[J].J o u r n a l o f I mm u n o l o g y(B a l t i-m o r e,M d:1950),2018,201(9):2842-2850.[17]B A T C HU R B,G R U Z D Y N O V,K O L L IB K,e t a l.I L-10s i g n a l i n g i n t h e t u m o rm i c r o e n v i r o n m e n t o f o v a r i a n c a n c e r[J].A d v a n c e s i nE x p e r i m e n t a lM e d i c i n ea n dB i o l o g y,2021,1290:51-65.[18]L A UW FN,P A J K R TD,H A C KCE,e t a l.P r o i n f l a mm a t o-r y e f f e c t s o f I L-10d u r i n g h u m a ne n d o t o x e m i a[J].J o u r n a l o fI mm u n o l o g y(B a l t i m o r e,M d:1950),2000,165(5):2783-2789.[19]N A I N G A,P A P A D O P O U L O S K P,A U T I O K A,e ta l.S a f e t y,a n t i t u m o r a c t i v i t y,a n d i mm u n e a c t i v a t i o n o f p e g y l a t e d r e c o m b i n a n t h u m a n i n t e r l e u k i n-10(AM0010)i n p a t i e n t sw i t ha d v a n c e d s o l i d t u m o r s[J].J o u r n a l o fC l i n i c a lO n c o l o g y:O f f i-c i a lJ o u r n a lo ft h e A m e r i c a n S o c i e t y o f C l i n i c a l O n c o l o g y,2016,34(29):3562-3569.[20]F E D O R A K R N,G A N G L A,E L S O N C O,e t a l.R e c o m b i-n a n t h u m a ni n t e r l e u k i n10i nt h et r e a t m e n to f p a t i e n t s w i t h m i l d t om o d e r a t e l y a c t i v eC r o h n s d i s e a s e.T h e I n t e r l e u k i n10I n f l a mm a t o r y B o w e l D i s e a s e C o o p e r a t i v e S t u d y G r o u p[J].G a s t r o e n t e r o l o g y,2000,119(6):1473-1482.[21]T I L G H,V A N MO N T F R A N SC,V A N D E N E N D E A,e ta l.T r e a t m e n t o fC r o h n s d i s e a s ew i t h r e c o mb i n a n t h u m a n i n-t e r l e u k i n10i n d u c e st h e p r o i n f l a mm a t o r y c y t o k i n e i n t e r f e r o ng a mm a[J].G u t,2002,50(2):191-195.[22]S A R A I V A M,V I E I R AP,O G A R R A A.B i o l o g y a n d t h e r a-p e u t i c p o t e n t i a lo f i n t e r l e u k i n-10[J].T h eJ o u r n a lo fE x p e r i-m e n t a lM e d i c i n e,2020,217(1),e20190418.[23]L I N LZ,C H E N H B,Z H A N G Y X,e ta l.I L-10p r o t e c t sn e u r i t e s i no x y g e n-g l u c o s e-d e p r i v e dc o r t i c a ln e u r o n st h r o u g h t h eP I3K/A k t p a t h w a y[J].P L o S O n e,2015,10(9): e0136959.[24]E D D I E I P W KE,H O S H IN,S HO U V A LDS,e t a l.A n t i-i n-f l a mm a t o r y e f f e c t o f I L-10m e d i a t e db y m e t a b o l i c r e p r og r a m-m i n g o fm a c r o p h a g e s[J].S c i e n c e(N e w Y o r k,N Y),2017, 356(6337):513-519.[25]MA Z E R M,U N S I N G E RJ,D R E WR Y A,e ta l.I L-10h a sd i f fe r e n t i a l ef f e c t s o n t h e i n n a t e a n d a d a p t i v e i mm u n e s y s t e m so f s e p t i c p a t i e n t s[J].J o u r n a l o f I mm u n o l o g y(B a l t i m o r e,M d: 1950),2019,203(8):2088-2099.[26]K R I S H N AMU R T H Y P,R A J A S I N G H J,L AM B E R SE,e ta l.I L-10i n h ib i t s i n f l a mm a t i o na n da t t e n u a t e s l e f tv e n t r ic u l a rr e m o d e l i n g a f t e rm y o c a r d i a l i n f a r c t i o nv i a a c t i v a t i o n o f S T A T3a n d s u p p r e s s i o no fH u R[J].C i r c u l a t i o n R e s e a r c h,2009,104(2):e9-e18.[27]H O SD,B U C H E RF,R E G E N F U S SB,e t a l.I L-10i n d i r e c t l yr e g u l a t e s c o r n e a l l y m p h a n g i o g e n e s i sa n dr e s o l u t i o no f i n f l a m-m a t i o nv i am a c r o p h a g e s[J].T h eA m e r i c a n J o u r n a l o f P a t h o l o-g y,2016,186(1):159-171.[28]T I N S L E YJH,S O U T HS,C H I A S S O N VL,e t a l.I n t e r l e u-k i n-10r e d u c e si n f l a mm a t i o n,e n d o t h e l i a l d y s f u n c t i o n,a n db l o o d p r e s s u r ei n h y p e r t e n s i v e p r e g n a n tr a t s[J].A m e r ic a nJ o u r n a l o fP h y s i o l o g y R e g u l a t o r y,I n t e g r a t i v ea n d C o m p a r a-t i v eP h y s i o l o g y,2010,298(3):R713-R719.[29]Z H A O Q,J I M L,WA N G X M.I L-10i n h i b i t sr e t i n a l p i g-m e n t e p i t h e l i u mc e l l p r o l i f e r a t i o n a n dm i g r a t i o n t h r o u g h r e g u-l a t i o n o fV E G F i n r h e g m a t o g e n o u s r e t i n a l d e t a c h m e n t[J].M o-l e c u l a rM e d i c i n eR e p o r t s,2018:17(5):7301-7306. [30]B R U I J N E N S T G,C H A N D R U P A T L A D M S H,G I O-V A N O N N IL,e t a l.F8-I L10:an e w p o t e n t i a l a n t i r h e u m a t i cd r u ge v a l u a t e d b y a P E T-g u i d e dt r a n s l a t i o n a la p p r o a c h[J].M o l e c u l a rP h a r m a c e u t i c s,2019,16(1):273-281.[31]F R A N Z M,D O L LF,G RÜN K,e t a l.T a r g e t e dd e l i v e r y o fi n t e r l e u k i n-10t o c h r o n i c c a r d i a c a l l o g r a f t r e j e c t i o nu s i n g ah u-m a na n t i b o d y s p e c i f i c t o t h e e x t r a d o m a i nAo f f i b r o n e c t i n[J].I n t e r n a t i o n a l J o u r n a l o fC a r d i o l o g y,2015,195:311-322.[32]G A L E A Z Z I M,B A Z Z I C H IL,S E B A S T I A N IG D,e ta l.Ap h a s e I Bc l i n i c a l t r i a lw i t hD e k a v i l(F8-I L10),a n i mm u n o r e-g u l a t o r y a r m e d a n t i b o d y f o r t h e t r e a t m e n t o f r h e u m a t o i d a r-t h r i t i s,u s e d i nc o m b i n a t i o nw i I hm e t h o t r e x a t e[J].T h e I s r a e l M e d i c a lA s s o c i a t i o n J o u r n a l,2014,16(10):666.[33]Q I A OJ,L I UZD,D O N GCB,e t a l.T a r g e t i n g t u m o r sw i t hI L-10p r e v e n t sd e n d r i t i cc e l l-m e d i a t e dC D8+Tc e l l a p o p t o s i s[J].C a n c e rC e l l,2019,35(6):901-915.e4.[34]C Y P E L M,L I U M Y,R U B A C H A M,e t a l.F u n c t i o n a l r e p a i ro fh u m a n d o n o rl u n g s b y I L-10g e n et h e r a p y[J].S c i e n c e T r a n s l a t i o n a lM e d i c i n e,2009,1(4):4r a9.[35]O I S H IH,J U V E TSC,MA R T I N U T,e t a l.An o v e l c o m-b i n e d e x v i v oa n d i n v i v o l e n t i v i r a l i n t e r l e u k i n-10g e n ed e l i v e r ys t r a t e g y a t t h e t i m eo f t r a n s p l a n t a t i o nd e c r e a s e sc h r o n i c l u n ga l l o g r a f t r e j e c t i o ni n m i c e[J].T h eJ o u r n a lo fT h o r a c i ca n dC a r d i o v a s c u l a r S u r g e r y,2018,156(3):1305-1315.[36]J E O N G Y,P A R KJK H,E U NS.V i r a l v e c t o rm e d i a t e d i n-t e r l e u k i n-10g e n e t r a n s f e r i n s k i n a l l o g r a f t[J].T r a n s p l a n t a t i o n P r o c e e d i n g s,2020,52(6):1864-1868.[37]MA T S UMO T O H,HA G A K,O H N OI,e t a l.M u c o s a l g e n et h e r a p y u s i n g a p s e u d o t y p e d l e n t i v i r u s v e c t o r e n c o d i n g m u r i n ei n t e r l e u k i n-10(m I L-10)s u p p r e s s e st h ed e v e l o p m e n ta n dr e-l a p s e o f e x p e r i m e n t a lm u r i n e c o l i t i s[J].B M C G a s t r o e n t e r o l o-g y,2014,14:68.[38]L IYF,MASZ,G U OJB,e t a l.E f f e c t o f l o c a l h I L-10g e n et h e r a p y o ne x p e r i m e n t a l p e r i o d o n t i t i si n o v a r i e c t o m i z e dr a t s [J].A c t aO d o n t o l o g i c aS c a n d i n a v i c a,2017,75(4):268-279.(本文编辑黄建乡)Copyright©博看网. All Rights Reserved.。

Reconstr Surg,2007,119(7):2080-2087.[26]王晓军,朱琳,刘志飞,等.岛状皮瓣一期修复眼睑分裂痣的设计与技巧[J].中华整形外科杂志,2010,26(1):15-17.[27]Jacobs SM,Couch SM,Custer PL.Divided eyelid nevus: a lid-sparing, staged surgical approach[J].Am J Ophthalmol,2013,156(4):813-818.[28]黄丹平,程浩,余佯洋,等.眼睑分裂痣的手术方式探讨[J].中华眼科杂志,2009,45(12):1089-1092.[29]任敏,滕利,靳小雷,等.全厚皮片游离移植矫治大面积眼睑分裂痣[J].中国美容医学,2009,18(1):15-16.[30]Yoo DB,Azizzadeh B,Massry GG.Injectable 5-FU with or without added steroid in periorbital skin grafting: initial observations[J].Ophthalmic Plast Reconstr Surg,2015,31(2):122-126.[31]张鲜英,刘毅,张诚,等.眼睑不同部位分裂痣的修复方法[J].中国美容整形外科杂志,2017,28(7):433-435.[32]Yamamichi K,Kosaka M.A novel reconstructive procedure for the divided nevus of the eyelids using a tissue expander[J].PlastReconstr Surg Glob Open,2016,4(12):e1160.[33]宋成,殷培培,孙颖.皮肤软组织扩张技术在面颈部瘢痕手术中的应用效果及对瘢痕恢复的影响研究[J ].中国医疗美容,2019,9(2):48-52.[34]Alfano C,Chiummariello S,De Gado F,et al.Divided nevus of the eyelids: three case studies[J].In Vivo,2007,21(1):137-139.[35]Bhattacharjee K,Singh M,Bhattacharjee H.Amniotic membrane graft to reconstruct divided nevi of eyelids[J].BMJ Case Rep,2015,2015: Bcr201420902.[36]赵素焱,王薇,田彦杰.成年人眼睑分裂痣的微创手术治疗[J].中国中医眼科杂志,2012,22(5):363-365.[收稿日期]2020-05-25本文引用格式:张冬雪,刘国锋.眼睑分裂痣治疗方法的研究现状[J].中国美容医学,2021,30(5):166-169.通信作者:齐淑静,河北工程大学附属医院整形外科,副主任医师;研究方向:整形外科;E-mail:****************第一作者:李文珂,河北工程大学临床医学院,硕士研究生;研究方向:整形外科;E-mail:****************自体脂肪移植在抑制瘢痕形成中的研究进展李文珂1 孙宇航2 综述,齐淑静2 吴泽义1 袁好军2 审校(1.河北工程大学临床医学院 河北 邯郸 056000;2.河北工程大学附属医院整形外科 河北 邯郸 056000)[摘要]瘢痕是机体创伤修复后的必然产物。

咪喹莫特调节Th1、Th2细胞相关趋化因子对兔耳增生性瘢痕创面愈合和瘢痕增生的影响陈方【摘要】目的:探讨咪喹莫特调节Th1、Th2细胞相关趋化因子对兔耳增生性瘢痕创面愈合时间和瘢痕增生的影响.方法:选取健康清洁级新西兰大耳实验兔40只,随机分为空白组、模型组、凡士林组以及咪喹莫特组,每组10只.模型组、凡士林组以及咪喹莫特组建立兔耳瘢痕模型,14d创面完全上皮化后,凡士林组涂抹凡士林软膏0.1g,1次/d;咪喹莫特组外用咪喹莫特软膏0.1g,1次/d,连续42d.观察并比较各组实验兔的大体情况,瘢痕增生指数,Th1、Th2 细胞相关趋化因子CXCL10、CXCL12、CCL2、CCL3、CCL5、CCL7、CCL13水平,完全上皮化时间及创面愈合时间.结果:模型组与凡士林组28d达到增生巅峰;与模型组相比,凡士林组及咪喹莫特组的瘢痕增生指数、创面愈合时间均较低,且咪喹莫特组低于凡士林组,差异有统计学意义(P<0.05).与模型组相比,凡士林组及咪喹莫特组的CCL2、CCL3、CCL5、CCL7、CCL13水平较低,CXCL10、CXCL12水平升高,差异有统计学意义(P<0.05);与凡士林组相比,咪喹莫特组的CCL2、CCL3、CCL5、CCL7、CCL13水平降低,CXCL10、CXCL12水平较高(P<0.05).三组实验兔完全上皮化时间比较,差异无统计学意义(P>0.05).结论:咪喹莫特能够调节Th1、Th2细胞相关趋化因子,缩短兔耳增生性瘢痕创面的愈合时间.%Objective To investigate the effect of imiquimod regulating Th1 and Th2 cell-associated chemokines in wound healing and scar proliferation in rabbits. Methods 40 healthy and clean New Zealand white rabbits were selected and randomly divided into the blank group, the model group, the vaseline group and the imiquimod group, 10 rabbits in each group. The model group, the vaseline group andthe imiquimod group set up rabbit ear scar model. The vaseline group and the imiquimod group were given the appropriate treatment after 14 days of surgery, the vaseline group were treated with vaseline ointment 0.1g, 1 time/d, and the imiquimod group were treated with imiquimod ointment, treatment for 42 consecutive days. The level of scar hyperplasia index (SEI), the levels of Th1 and Th2 cell-associated chemokines CXCL10, CXCL12, CCL2, CCL3, CCL5, CCL7 and CCL13, the complete epithelialization time and wound healing time were observed and compared. Results The model group and the vaseline group reached the peak of hyperplasia in 28 days. The scar proliferation index and wound healing time of the vaseline group and the imiquimod group were lower than those of the model group, and the imiquimod group was lower than that of the vaseline group, the difference were statistically significant(P<0.05). Compared with the model group, the levels of CCL2, CCL3, CCL5, CCL7 and CCL13 in the vaseline group and the imiquimod group were decreased, CXCL10 and CXCL12 levels were increased(P<0.05). Compared with the vaseline group, the levels of CCL2, CCL3, CCL5, CCL7 and CCL13 in the imiquimod group were lower, and the level of CXCL10 and CXCL12 was higher(P<0.05). There were no statistical difference in the time of complete epithelialization between the three groups (P>0.05). Conclusion Imiquimod can regulate Th1 andTh2 cell-associated chemokines and shorten the healing time of the wound of hypertrophic scar in rabbit ears.【期刊名称】《中国美容医学》【年(卷),期】2018(027)003【总页数】4页(P100-103)【关键词】咪喹莫特;趋化因子;兔耳瘢痕模型;创面愈合时间;增生性瘢痕【作者】陈方【作者单位】临沂市中心医院医学美容科山东临沂 276400【正文语种】中文【中图分类】R619+.6增生性瘢痕是创伤愈合过程中皮肤上皮化后,局部组织继续增生,皮肤纤维化,胶原大量沉积,是外科临床的常见病,在各种创伤如烧伤、手术后常见[1]。
白细胞介素—10检测及其临床意义250?Labeledlmmunoassays&ClinMed.Dec咖ber2001.V ol8.N0.4检测技歹了白细胞介素一10检测及其临床意义董晓军(解放军总医院科技开发由一,北京100853)白细胞介素一10(简称白介素10,inlet—leukin一10,IL一10)是具有多种生物功能的细胞因子,它与机体自身免疫疾病,感染性疾病和肿瘤等有着密切关系.IL10主要由单核细胞,巨噬细胞,肥大细胞,T,B淋巴细胞和激活的角质细胞产生.人的IL1O是一种单肽链的.由160个氯基酸组成的酸性蛋白,分子量为18.7kD(不包括N端18个氨基酸构成的信号肽序列),等电点为8.1,通常为二聚体(39kD)人IL一1O和鼠II~10核苷酸序列同源性达81%,氯基酸序列同源性达73%.人IL1O对人细胞和小鼠细胞均有作用,小鼠IL一10只对鼠细胞有作用,而对人细胞无作用.白介素的基因是单拷贝基因,其位置在第一染色体上.IL~1O基因的核苷酸序列或蛋白质氯基酸顺序和其他的细胞因子无明显的顺序同源性而IL一10基因和EBV基因组中有一段开放读码区的BCRF1有大于80%的明显同源性.IL1O是一种具有免疫抑制和免疫刺激作用的细胞因子,人IL一10在单核细胞存在下,能直接抑制T细胞增殖和白介素的产生.当它作为免疫抑制因子时,能抑制多种细胞合成其他细胞因子ll10抑制细胞性免疫应答,主要是通过抑制T1产生IL一2,干扰素一(IFN一)等,抑制II2R的作用.在机体免疫应答中,既有对机体起保护作用的一面,也有不利于机体的一面.IL一10 能增强体液免疫应答IL1O在机体多种自身免疫疾病的产生过程中起着重要的作用,与白血病关系较为密切.IL10与11,3和IL一4协同因子能刺激未成熟的肥大细胞增殖内源性IL一10也能抑制同种异体MLR表达IL一10和转化生长收稿日期:2001—02—18:修回日期:2001'05—28 因子(TGF)可通过抑制一氧化氮的产生而干扰IFN一对单核细胞活化.IL1O对NK细胞的抑制作用是间接的而非直接,IL10抑制NK细胞产生IFN—I1一10不抑制LAK细胞活性.成熟的B细胞才能分泌IL一10,IL1O是B细胞有效的增殖和分化因子,它对B细胞活化和增殖有着效应.在TGF口存在下,IL—l0能提高lgA分泌能力,在IL4存在下IL10能提高IgE生物活性.IL10检测对疾病的临床诊断,免疫病理和免疫调节等方面的研究都是必需的.IL一1O的检测方法和临床意义:1放射免疫分析法和酶免疫吸附法这类检测方法简称为RIA和ELISA法,检测特异性高,较生物活性检测方法快速,其灵敏度可达Pg水平.可测患者的血,细胞液和尿液等标本中的IL1O水平,已有成套试剂盒可供使用,操作也十分方便和简单.2斑.杂交法用地高辛甙标记的eDNA作为探针的点杂交方法,可检测系统红斑狼苍(SLE)患者IL一1O mRNA的含量.实验结果表明,LES患者IL一1O mRNA表达量比正常人高二倍,提示IL一10与SLE发病有直接关系,并表明了IL10拮抗剂有可能用于SLE病的治疗.这种方法操作简便,并有助于SLE疾病的临床治疗和用于选择合适的免疫调节剂.3反转录一PCR检测法这种检测法简称为RT—PCR,检测IL1O特定基因转录产物RNA的表达水平.它可以从血清,血浆,细胞,腹水和组织液等,一步处理,快速分离样品中的RNA,可从50pgRNA中扩增出所需片段,最大扩增片段超过2kb,因此具有高特异记免疫分析与临床2001年l2月第8卷第4期性和高灵敏度.4免提荧光法采用双标记免疫荧光法,可检测唾液腺炎患者唾液腺组织中IL—l0,IL—l2和IFN一的表达水平,而大部分IL—l0表达阳性的单个核细胞, CD4也阳性,又称双阳性免疫荧光标记法采用免疫双染色法可检测类风湿性关节炎和骨关节炎患者的滑膜细胞培养液中IL—l0的水平,结果表明类风湿性关节炎患者II一10水平为358—5501pg/mL,骨关节炎患者Il一l0水平为310—3390pg/mL.这表明IL—l0是由l滑膜里层单核细胞和聚集的淋巴细胞(T细胞)产生的5ELISA一点技术这项技术简称为ELI—SPOT,用ELI—SPOT25l能检测单个细胞水平IL—l0的产生,对研究IL—l0在细胞间进行信息传递的作用,具有重要的意义.操作步骤:将单细胞悬液加到包被抗IL—l0抗体的反应孔中,经诱导产生IL—l0,后者与生物素化的第二抗体产生结合反应,当加入碱性磷酸酶标记的链亲和素和显色剂后,显色反应在覆盖的琼脂胶中进行,最后用倒置显微镜计数蓝色斑点.本法操作简单,可以使细胞处于与体内的状态非常相近的条件.ELI—SPOT法还可用来跟踪疾病产生,调整治疗方案等.如用于重症肌无力患者外周血T细胞分泌IL—l0(和IFN—)的研究;用于检测多发性硬化患者外周单个细胞IL—l0分泌水平.(胨泮藻编委审张增武编辑)用流式细胞仪测定母血中胎儿红细胞含量的新方法周春喜(解放军总医院雕璺宴验锺试中..北京100853)本文介绍一种快速而准确地测量母血中胎儿红细胞含量的方法.它通过流式细胞仪检测母血中胎儿红细胞胞内的血红蛋白(HbF)和红细胞表面i抗原,可以特异地识别母血中胎儿红细胞.这对预防新生儿溶血症和优生优育具有重要意义.材料与方法l样品处理方法(1)静脉采血lmL,用EDTA抗凝,室温保存备用.(2)用血球计数仪计数并计算抗凝血中红细胞的浓度.(3)用冲洗液将抗凝血稀释成浓度为25x109个/mL的红细胞悬液.(4)取一带盖尖底离fl,管,加入10/~I红细胞悬液及100~-L封闭液,混匀.加入100VI同定液, 混匀,室温温育30rain.收稿日期:2001—05—18;修回B期:2OOl—o8—10 (5)再加2.5mL冲洗液,将离心管颠倒几次洗细胞.1000g离心3min,弃上清,将剩下的细胞混匀.加100/~L破膜液,混匀,室温温育3min. (6)加2.5mL冲洗液,将离心管颠倒几次洗细胞.1000g离心3min,弃上清,用25mL冲洗液再洗细胞一次.离心弃上清,加lmL冲洗液,混匀.2黄光染色方法(1)每份样品取2支流式细胞仪样品管,分别标记为l和2.(2)在l号管中依次加入100/~L细胞悬液,10/~L异硫氰酸荧光素(FITC)标记的抗HbF,10/~L 藻红蛋白(PE)标记的抗i抗原和10/~LDNA染液(LDS751),混匀.(3)在2号管中依次加入100~.L细胞悬液,10~.LFITC标记的IgGl,10vLPE标记的IgM和10t,LLDS751,混匀.(4)将两管于4t避光温育30rain.用2.5mL冲洗液洗1次.。
炎症反应在瘢痕疙瘩形成中的作用机制(完整版)瘢痕疙瘩是皮肤损伤后组织异常修复的结果,发病机制复杂,临床治疗效果不理想。
瘢痕疙瘩形成过程中经历了异常的炎症反应,主要是由炎症细胞、成纤维细胞及炎症因子等相互作用导致的。
探究炎症与瘢痕疙瘩的关系,可能找到有效治疗瘢痕疙瘩的新靶点。
炎症细胞中性粒细胞当皮肤受到损伤时,皮肤屏障功能被破坏,损伤的组织释放警告信号,如趋化因子(CXC)L8、CXCL2、血小板生长因子(PDGF)和血管内皮生长因子(VEGF)等,这些报警信号从血液循环中招募各种免疫细胞,并刺激局部常驻免疫细胞增殖,导致损伤部位集结中性粒细胞、巨噬细胞、肥大细胞和T淋巴细胞等。
中性粒细胞最早到达损伤组织,主要作用是抗感染,通过吞噬和脱颗粒产生高浓度活性氧(ROS)和形成中性粒细胞胞外杀菌网络(NETs),以阻止微生物入侵伤口,但也有可能会造成周围组织的损伤。
早期中性粒细胞产生细胞因子,如IL-1β、IL-6和TNF-α,促进炎症反应和巨噬细胞活化,之后的中性粒细胞,释放VEGF、金属基质蛋白酶(MMP)-9等促进新生血管形成和胶原沉积,以促进组织修复。
中性粒细胞通过凋亡自毁,然后被巨噬细胞迅速识别和清除。
NISHIO等发现,老龄C57BL/6小鼠伤口愈合相对缓慢,用抗粒细胞分化抗原(Gr-1)抗体消耗中性粒细胞显著延迟了老龄小鼠的伤口愈合,静脉注射粒细胞集落刺激因子(G-CSF)增加了中性粒细胞后促进伤口愈合,此处理对幼龄小鼠影响较小。
同样,随着年龄增长,伤口的愈合会变慢,这与中性粒细胞功能下降,清除感染及吞噬等效率降低有关。
中性粒细胞的异常有可能导致瘢痕疙瘩的发生,其对瘢痕疙瘩成纤维细胞的直接和间接作用机制尚需进一步研究。
巨噬细胞巨噬细胞和炎症在伤口修复过程中起着有益的作用,如清除细胞碎片和病原体,直至细胞外基质沉积、血管再形成和伤口再上皮化。
伤口巨噬细胞可分为M1和M2两种表型,M1-M2为连续表型,随着伤口的成熟而进化。
肿瘤细胞表达的免疫抑制蛋白
肿瘤细胞可以表达多种免疫抑制蛋白,以下是一些常见的免疫抑制蛋白:
1.PD-L1:程序性死亡受体-1(PD-1)与其配体PD-L1结合,可以抑制T细胞的免疫活性,从
而抑制免疫反应。
2.B7-H4:B7-H4是一种新的B7家族成员,它可以抑制T细胞的免疫应答,促进肿瘤细胞的
免疫逃逸。
3.FasL:FasL是一种细胞因子,它可以结合并激活Fas受体,从而诱导T细胞凋亡,进而抑制
免疫反应。
4.TGF-β:转化生长因子-β(TGF-β)可以抑制T细胞的增殖和免疫应答,同时还可以促进免疫
抑制性T细胞的分化。
5.IL-10:白细胞介素-10(IL-10)是一种抗炎细胞因子,它可以抑制抗原提呈细胞的功能,从
而抑制免疫应答。
这些免疫抑制蛋白的表达可以促进肿瘤细胞的免疫逃逸和进展,因此它们是肿瘤免疫治疗的重要靶点。
·综述·小胶质细胞在脊髓损伤中的作用机制研究进展夏宇,丁璐,邓宇斌作者单位中山大学附属第七医院科研中心深圳518107基金项目国家自然科学基金项目(No.82071362)收稿日期2022-04-25通讯作者邓宇斌dengyub@摘要脊髓损伤(spinal cord injury ,SCI )是由于外力或非外力作用造成脊柱骨、韧带及神经结构的破坏,并伴随着损伤部位以下躯干与四肢的感觉运动功能障碍,其致残率高。
小胶质细胞作为中枢神经系统固有的免疫细胞,在SCI 后接受损伤信号,发挥分泌因子及吞噬作用,同时和神经元、星形胶质细胞、少突胶质细胞及其它细胞与非细胞成分发生反应。
目前研究显示,小胶质细胞具有多态性和多功能性,参与SCI 的病理生理过程,包括炎症、疤痕形成和疼痛。
本综述结合前期课题组星形胶质细胞研究基础,通过总结近年来小胶质细胞在SCI 过程中功能的研究文献,为SCI 疾病进展研究提供新的思路与方向。
关键词脊髓损伤;小胶质细胞;星形胶质细胞中图分类号R741;R741.02;R744文献标识码A DOI 10.16780/ki.sjssgncj.20220376本文引用格式:夏宇,丁璐,邓宇斌.小胶质细胞在脊髓损伤中的作用机制研究进展[J].神经损伤与功能重建,2023,18(10):593-596.脊髓损伤(spinal cord injury ,SCI )是由于外力或非外力作用造成脊柱骨、韧带及神经结构的破坏,并伴随着损伤部位以下躯干与四肢的感觉运动功能障碍,每年全球约70万例新发病例,致残率高[1,2]。
神经功能障碍是导致SCI 高残障率的基础。
除了神经元的死亡、突触连接的丢失等原发性损伤,小胶质细胞作为胶质细胞的一员参与激活炎症级联反应,造成继发性损伤[3]。
1小胶质细胞的定义小胶质细胞作为中枢神经系统(central nervous system ,CNS )固有的免疫细胞,是神经组织中唯一来源于中胚层的细胞[4]。
IL-10在无瘢痕再生愈合中的作用摘要:众所周知,胎儿伤口在妊娠期可以无瘢痕愈合,而产后伤口愈合则形成伤疤。
研究表明,IL-10在胎儿无瘢痕愈合中起关键作用。
研究IL-10在胎儿愈合中和产后伤口愈合中的作用,可以为生产抗伤疤药物提供依据。
关键词:IL-10;再生愈合;瘢痕1 引言产后伤口愈合形成疤痕,而胎儿伤口愈合是无疤痕的。
目前,胎儿再生愈合的机制尚不清楚。
研究表明细胞因子IL-10在胎儿再生愈合及产后伤疤的治疗中起重要作用。
IL-10通过调节炎症反应、细胞外基质、成纤维细胞和内皮祖细胞来实现再生愈合。
进一步通过体外实验和临床动物实验研究IL-10作用的剂量、途径和时间,为研制抗疤痕药物提供依据。
伤口再生愈合是一个复杂的过程,需要大量的生长因子、不同类型的细胞和细胞外基质的参与。
实验证明胎儿再生愈合是胎儿的内在作用,是一个减毒炎症反应。
抗炎症细胞因子IL-10是胎儿再生愈合必不可少的。
进一步研究,在产后组织中过表达IL-10研究表明,IL-10可以减弱炎症反应、调节细胞外基质、影响纤维母细胞的增殖和分化、增加内皮祖细胞数量等。
有文献报道称IL-10在产后再生愈合中有剂量的依赖性,这一发现对治疗产后疤痕有重要意义,目前IL-10的作用机制尚不完全清楚。
每年有超过一亿伤疤患者,因伤疤造成疾病的发病率很高。
因此无瘢痕愈合对外科手术有重大意思。
目前市场上虽然有很多治疗伤疤的产品,但效果都不是很好。
众所周知,胎儿可以无瘢痕愈合,而IL-10在胎儿再生愈合中起重要作用是毋庸置疑的。
研究IL-10作为新的抗疤痕药物已经进入了起步阶段。
IL-10有抗伤疤的潜在治疗作用,可以皮内注射、局部应用或者作为生物辅料。
2 胎儿再生愈合胎儿再生愈合和产后伤口愈合是一个复杂的过程,分为止血、发炎、细胞增殖和重建四个阶段。
止血阶段是伤口发生的几分钟到几小时之间,之后进入发炎阶段。
发炎阶段有大量的中性粒细胞和巨噬细胞涌入伤口处。
增殖阶段和发炎阶段同时开始,纤维组织母细胞和角化细胞转运到伤口处形成肉芽组织。
一但上皮形成,在几个月内经过改造最终形成伤疤。
从组织形态上观察,伤疤是没有毛囊或者汗腺的厚状类似胶原蛋白的组织。
相反,胎儿愈合可以和正常皮肤一样,这种现象依赖于胎龄和妊娠的第二个三个月,随着胎儿的生长再生能力进入一个过渡的阶段。
再生愈合在多种哺乳动物中发现,如老鼠、羊和猴子。
多种研究证明再生愈合是胎儿的内在能力与子宫环境羊水无关。
用成年羊皮肤移植到胎羊身体上然后返回到子宫的环境中,最终导致伤疤的形成。
把人胎儿皮肤转移到有免疫缺陷的老鼠身上却保留再生能力。
这些都证明,胎儿再生愈合与子宫和羊水环境无关。
3 细胞因子理论胎儿伤口抗炎细胞与产后相比渗透性降低,分离胎儿中中性粒细胞和巨噬细胞在体外实验,它们对炎症有一定的作用。
这些数据说明,胎儿可以降低炎症反应是胎儿的内在性质而不是免疫缺陷。
总的来说,这些发现导致了细胞因子假说的诞生。
胎儿再生愈合期抗炎细胞因子浓度高于促炎细胞因子。
细胞因子假说认为胎儿的伤口能消炎减少中性粒细胞和巨噬细胞及细胞外分泌物。
胎儿再生愈合抑制炎症因子水平高于促炎性细胞因子,总的表现为抑制水平升高(图1)。
图1研究表明,在出生后的伤口环境中,促炎性细胞因子增加,而在产前环境中的伤口促炎细胞因子减少和抗炎细胞因子增加,总促炎性细胞因子水平下降。
在小鼠模型实验中,胎儿皮肤和成人皮肤损伤炎症细胞因子水平都增加,而成人转录至少持续72h。
进一步调查表明,胎儿皮肤有其他炎症细胞因子水平下降,如IL-2,IL-12,γ-干扰素和肿瘤坏死因子-α,强效抗炎细胞因子水平升高。
IL-10是一个强有力的抗炎细胞因子,分子量为35kD的二聚体,可由多种细胞产生,如T细胞、单核细胞、巨噬细胞等。
在皮肤再生愈合过程中,角质形成细胞能够产生IL-10。
细胞因子IL-10也称为合成抑制因子,它强烈地刺激巨噬细胞和降低炎症细胞因子的产生。
除了其潜在的抗炎作用,IL-10还有调节细胞的纤维化,调控生长因子(TGF-β)信号转导途径的作用。
IL-10二聚体可以绑定到一个四聚体受体复合物,包括两分子IL-10R1和两分子IL-10R2,可以磷酸化二聚化STAT3。
磷酸化的STAT3转位核内,激活下游靶基因(图2)。
图2 IL-10信号主要是通过复杂的IL-10Ra四聚体,导致JAK/STAT3的活化。
磷酸化的STAT3移位核中,激活下游靶基因,如透明质酸合酶。
值得注意的是,IL-6也通过STAT3信号起作用。
IL-6是一个已知的炎症细胞因子并且发挥多种作用,与抗炎细胞因子IL-10对立。
IL-6能增加炎性细胞数量。
通过共享的转录因子调节SOCS蛋白家族。
SOCS3有负反馈调节的抗炎作用,能应答多个细胞因子调节作用,包括竞争性抑制STAT目标受体,多聚泛素化和降解。
IL-10和IL-6在调节SOCS蛋白家族机制尚不完全清楚。
更多的研究,SOCS蛋白家族在组织损伤伤口愈合中参与复杂的信号级联传递。
IL-10在胎儿发育中作为一种有效的抗炎细胞因子扮演重要的角色(图3b)。
随着妊娠的进展,IL-10水平降低,在新生儿时期表达量最小(图3A)。
胶原蛋白是皮肤重塑中的一个重要因素。
在胎儿的再生愈合过程中,胶原沉积在胞外形成细网状的结构。
这与产后疤痕中胶原蛋白厚实,沿平行组织阵列形成鲜明对比。
此外,虽然I型胶原是胎儿和产后伤口中重要的组成部分,在胎儿的伤口中Ⅲ型胶原的比例比I型胶原更高。
损伤及重建后,III型胶原占成人总胶原的10–20%,而占胎儿伤口的30–60%。
III型胶原束小于I型且更具弹性。
这种差异在胎儿的网状的沉积组合物中可以证明。
病理性瘢痕疙瘩是由I型胶原过量沉积产生。
IL-10有保护胶原过度沉积的作用。
胎儿再生愈合的另一特点是高水平的多糖,如透明质酸。
透明质酸钠是一种亲水性的糖胺聚糖,有利于细胞外基质扩大和细胞快速迁移。
与晚期妊娠胎儿的伤口形成的瘢痕比较能够无瘢痕愈合的组织有透明质酸水平的增加(图4A,C。
图4b,D。
免疫组化体外器官培养模型说明透明质酸的含量的变化)。
胎儿伤口再生治疗过程中,它们持续性升高,出生后透明质酸水平短暂增加,并迅速返回正常。
实验表明,IL-10能提高胎儿透明质酸的含量。
透明质酸是再生生物学中伤口愈合的早期阶段重要的组成部分,高分子量透明质酸可以促进胎儿III型胶原水平升高和TGF-B3表达,而低分子量的透明质酸有利于瘢痕与I胶原型刺激形成成纤维细胞(图3)。
图3 出生后的小鼠皮肤(一)(棕色),胎儿皮肤(B)。
图4 妊娠期小鼠胎儿切口基质升高(一,蓝色)。
透明质酸(C,棕色)妊娠后胎儿的伤口(B,D)体外器官培养(透明质酸染色)。
肉芽组织成纤维细胞分泌大量的生长因子,从而刺激角质细胞的生长和迁移。
IL-10对上皮细胞再生的影响可能是通过介导成纤维细胞和角质形成细胞之间的相互作用。
角质形成细胞可以刺激产生IL-10。
然而,最近发现的证据表明,IL—10可以介导透明质酸增强,有效地增加成纤维细胞迁移和侵袭,但当透明质酸合成被抑制,增强的成纤维细胞运动下降到基线。
IL-10通过增加透明质酸的生产,能提高成纤维细胞功能。
IL-10在调节EPC的生存中发挥作用。
内皮祖细胞通过生长因子的产生促进血管细胞新生。
进一步研究IL-10在再生伤口愈合的作用表明,IL-10对于无瘢痕胎儿再生愈合必不可少。
研究表明,IL-10产生的使产后伤口再生,然而,伤口短暂的暴露导致IL-10降低而形成瘢痕。
进一步的研究将是IL-10在伤口愈合中的影响机制。
4 展望在发达国家,每年估计有11000000的瘢痕患者和4000000的烧伤疤痕患者。
虽然我们已经知道了胎儿皮肤伤口能无疤痕愈合,其机制尚未完全清楚。
我们运用分子技术来进一步阐明胎儿的再生反应机制,表明细胞因子IL-10起关键作用。
IL-10的过表达能减轻炎症反应,提高成纤维细胞功能,调节细胞外基质,调节干细胞功能。
适用于治疗广泛的疾病,如过度的纤维组织增生,包括肥厚疤痕,腹腔粘连,肺和肾的纤维化等。
IL-10远远超出了其他化妆品的好处,有极大的市场发展潜力。
因此研究IL-10在再生愈合中的作用将会有极大的利益回报,也为治疗伤疤引起的疾病提供了新的方法。
参考文献[1] Leung A, Crombleholme TM, and Keswani SG:Fetal wound healing: implications for minimal scar formation. Curr Opin Pediatr 2012; 24: 371.[2] Gordon A, Kozin ED, Keswani SG, et al.: Permissiveenvironment in postnatal wounds induced by adenoviral-mediated overexpression of the antiinflammatorycytokine interleukin-10 prevents scar formation. Wound Repair Regen 2008; 16: 70.[3] Peranteau WH, Zhang L, Muvarak N, et al.: IL-10overexpression decreases inflammatory mediators and promotes regenerative healing in an adultmodel of scar formation. J Invest Dermatol 2008;128: 1852. [4] King A, Balaji S, Marsh E, et al.: Interleukin-10regulates the fetal hyaluronan-rich extracellular matrix via a STAT3-dependent mechanism. J SurgRes, 2013; 184: 671.[5] Leung A, Balaji S, Le L, et al.: Interleukin-10 and hyaluronan are essential to the fetal fibroblast functional phenotype. J Surg Res 2013; 179: 257.[6] Krishnamurthy P, Thal M, Verma S, et al.:Interleukin-10 deficiency impairs bone marrowderived endothelial progenitor cell survival and functionin ischemic myocardium. Circ Res 2011; 109: 1280.[7] Bayat A, McGrouther DA, and Ferguson MW: Skinscarring. BMJ 2003; 326: 88.[8] Rowlatt U: Intrauterine wound healing in a 20week human fetus. Virchows Arch A Pathol AnatHistol 1979; 381: 353.[9] Reinke JM, and Sorg H: Wound repair and regeneration.Eur Surg Res; Europaische chirurgische Forschung Recherches chirurgicaleseuropeennes 2012; 49: 35.[10] Satterly S, Nelson D, Zwintscher N, et al.: Hemostasis in a noncompressible hemorrhage model:an end-user evaluation of hemostatic agents in a proximal arterial injury. J Surg Educ 2013; 70:206.[11] Martin P: Wound healing—aiming for perfect skin regeneration. Science 1997; 276: 75.[12] Longaker MT, Whitby DJ, Adzick NS, et al.: Studies in fetal wound healing, VI. Second and early third trimester fetal wounds demonstrate rapid collagen deposition without scar formation. J Pediatr Surg 1990; 25: 63.[13] Longaker MT, Whitby DJ, Ferguson MW, et al.:Adult skin wounds in the fetal environment heal with scar formation. Ann Surg 1994; 219: 65.[14] Lorenz HP, Longaker MT, Perkocha LA, et al.:Scarless wound repair: a human fetal skin model. Development 1992; 114: 253.[15] Adzick NS, Harrison MR, Glick PL, et al.: Comparison of fetal, newborn, and adult woundhealing by histologic, enzyme-histochemical, and hydroxyproline determinations. J Pediatr Surg1985; 20: 315.[16] Mast BA, Haynes JH, Krummel TM, et al.: In vivo degradation of fetal wound hyaluronic acid results in increased fibroplasia, collagen deposition, and neovascularization. Plast Reconstr Surg 1992; 89: 503. [17] Mast BA, Albanese CT, and Kapadia S: Tissue repair in the fetal intestinal tract occurs with adhesions, fibrosis, and neovascularization. Ann Plast Surg 1998; 41: 140.[18] Liechty KW, Adzick NS, and Crombleholme TM:Diminished interleukin 6 (IL-6) production during scarless human fetal wound repair. Cytokine.2000; 12: 671.[19] Liechty KW, Crombleholme TM, Cass DL, et al.:Diminished interleukin-8 (IL-8) production in the fetal wound healing response. J Surg Res 1998;77: 80.[20] An L, Dong GQ, Gao Q, et al.: Effects of UVA on TNF-alpha, IL-1beta, and IL-10 expression levels in human keratinocytes and intervention studies with an antioxidant and a JNK inhibitor. Photodermatol Photoimmunol Photomed 2010; 26: 28.河南师范大学生命科学学院考查课程论文年级类别: 13级专业型学科专业:微生物学学号: 1304280308姓名:闫立论课程名称:微生物制药专论授课教师:常翠芳考试分数:IL-10 in scar free healing roleAbstract: As everyone knows, fetal wound during pregnancy can be healed without scar formation and wound healing postpartum scar. Research shows that, IL-10plays a key role in scarless healing in the fetus . Study of IL-10 in fetal wound healingand post natal wound healing, can provide basis for the production of anti scarringdrugs.Keywords: IL-10; regenerative healing; scar。