意大利药物经济学评价指南
- 格式:pdf
- 大小:87.96 KB
- 文档页数:14


国外药物经济学研究质量评估的经验及对我国的药物经济学起源于20世纪70年代的澳大利亚,随后被引入欧美其他国家,被普遍应用于卫生政策制定中,如澳大利亚、加拿大、瑞典和法国等将其用于确定药品报销目录;英国、爱尔兰、德国等国家将其用于制订基本药物目录和临床合理用药目录的制定;美国和加拿大等国家将其评价结果用于公共卫生资源配置和新药研发。
直到20世纪90年代,药物经济学作为我国当时医疗费用突飞猛涨、药价虚高这一难题的重要应对措施才被正式引入我国,随即受到相关部门以及医药企业的广泛关注。
在最近的新医改方案中,已明确提出"合理确定同类药物品种和数量,改革药品价格形成机制,引入药物经济学评价,进行科学的评估测算。
"在《2009年国家基本医疗保险、工伤保险和生育保险约品目录调整工作方案》中,也提出需考虑按照药物经济学评价原则进行药品的调入和调出。
上述规定表明:国家明确提出开展药物经济学评价工作的要求,将药品的药物经济性评价置于和药品安全性、有效性同等重要的地位。
在这种形势下,不少医药企业已陆续把药物经济学评价作为新药研发以及药品上市的一个重要环节,将其评价结果作为药品定价、进入医疗保险报销目录、基本药物目录以及临床合理用药的科学依据。
纵览国内已发表的药物经济学评价文献,从前期的理论研究已逐步过渡到实证研究,研究数量也呈逐年上升趋势,研究主体以医药企业主动发起为主。
从已发表的文献来看,研究结果多以发起研究的企业自己的药品更具有性价比优势。
作为相关部门的卫生政策制定者,如何评价以及利用这些评价研究结果,取决于该评价结果是否具有真实性和可靠性。
由此可见,对我国药物经济学评价研究的质量进行评估,是充分发挥药物经济学评价在卫生决策中的作用以及实践价值的前提与保障。
2我国药物经济学评价质量评估的现状目前,国内开展的药物经济学实证研究中,因研究主体、研究方法设计、研究药品以及对照药品的选择、研究目的、研究角度、数据收集、分析方法、证据的透明度等各异,导致药物经济性研究质量参差不齐,研究结果的真实性与可靠性无从考证。

国际药品价格规制政策比较与借鉴分析国外药品价格规制背景,研究各国药品价格规制政策主要机构及主要内容,通过对各国药品价格规制效果的评价与规制政策的比较,借鉴国外先进经验,针对我国药品价格规制体系的完善提出可行建议。
标签:药品价格规制;比较;启示1各国药品价格规制政策比较1.1各国药品价格管制机构第一种模式中负责药品价格规制的机构为国家经济部门和卫生部门,前者负责制定价格,后者提供定价建议,两者协同工作,共同负责药品价格管理。
如意大利负责药品事务的官方机构—国家药品委员会(AIFA),卫生部和经济部有权管理AIFA的行为,并在药品价格政策制定、监管药品费用等方面协同合作。
意大利、比利时、西班牙等为该模式代表。
第二种模式中负责药品价格规制的机构为卫生部或医保管理机构。
如加拿大专利药品价格评审委员会负责管理药品出厂价格,但要通过联邦卫生部向议会报告;法国医药由国家健康制品卫生安全局全权监管,与定价委员会、透明委员会、厂商等共同决定药品价格;澳大利亚的PBPA、PBAC在药品定价过程中要结合ESC意见和己方讨论结果上报联邦卫生部,最终由联邦卫生部决定药品价格。
此模式被加拿大、法国、澳大利亚、瑞典、英国、荷兰等国采用。
第三种模式中非政府机构负责药品价格规制。
如德国的医生和保险基金联邦委员会、医疗保险基金领导协会等部门;英国制药行业协会在药品价格规制中也起到重要作用;美国无专门政府机构规制药品价格,主要由卫生保健管理组织、药品利润管理公司、民间管理式医疗组织等起到规制作用。
德国、英国、美国等国多采用此模式。
1.2各国药品经济评估方式通常,各国根据生产成本规制药品价格(多指出厂价格),故在价格制定过程中起主要作用的往往是经济部门或卫生部门。
如何衡量药品价值是制定药品价格的核心,传统的从生产成本入手的定价方式很难较全面地反映药品价值。
随着世界对医疗费用增长原因的不断认识,各国不再局限于对药品有效性、安全性和质量的考察,开始重视药物的经济学评价,综合考虑疗效、治疗成本及社会经济效益,经济学评价结果也成为了各国制定药品价格的重要参考因素。


中国医药报/2005年/9月/13日/第B04版视点先于国家医药卫生政策而动药物经济学评价指南概述(药物经济学探究五)邱琼药物经济学关注药物治疗的成本和效果,强调卫生资源的配置,分析不同治疗方法对药物预算的影响,因此,各国的卫生政策决策者、医药企业、医疗保险机构和临床医生都十分关注有关的研究进展。
但是,不同的评价研究,其目标、数据来源、成本和结果的测量、分析方法、时间和贴现率等都可能不同,形成的报告可能难以比较。
为了便于决策,很多国家出现了药物经济学评价指南或推荐性标准,以规范报告的撰写,保证药物经济学评价工作的一致性和可靠性。
■不同国家指南不同澳大利亚是最早出台药物经济学评价指南的国家。
加拿大、美国和欧洲的大部分国家都制定了指南,而且逐步修订完善。
发起和制定指南的部门有卫生行政部门,也有行业协会和医学杂志等组织。
亚洲一些国家对药物经济学评价的认识也在不断加强。
不同国家的卫生保健体系和药品政策不同,其药物经济学评价指南也不尽相同。
有的国家如英国和美国,还有若干个用途不同的指南并存。
在澳大利亚、加拿大(安大略省)、英国、芬兰、荷兰和葡萄牙等国,药品若要进入报销目录,会被强制要求提供药物经济学评价报告。
因此,这些国家的评价指南,一般由卫生行政部门发起和制定,对实施药物经济学评价的研究者有较强的约束力。
在美国、丹麦、爱尔兰、新西兰、挪威和瑞士等国,企业可以自愿选择是否进行药物经济学评估,作为推荐使用的评价指南是供研究者参考的。
还有一些国家(如法国、德国、意大利和西班牙等和《英国医学杂志》(BMJ)、美国药品研究和制药企业协会(PhRMA)等组织制定了一些用于指导药物经济学研究的指南,目的是提高研究和报告的水平。
■评价指南的基本内容药物经济学评价指南实际上反映的是指南制定者对药物经济学的认识。
所以,在澳大利亚、加拿大和英国等药物经济学研究比较深入的国家,制定的评价指南比较完整,对数据和研究方法的要求比较具体,制定出的标准报告涵盖的内容就比较全面,也能提出适当的评价标准,方便决策者评议、比较有关方面提供的评价报告。
![[医疗药品管控]药物经济学分析与预算影响分析药品经济学分析与预算](https://uimg.taocdn.com/50c989e60912a21615792983.webp)
(医疗药品管理)药物经济学分析与预算影响分析药品经济学分析与预算药物经济学分析和预算影响分析复旦大学公共卫生学院胡善联药物经济学研究于卫生经济学界和医药工业部门均十分重视,但研究的结果往往不易被卫生行政和医疗保险部门采纳,究其原因是许多新药于临床疗效和成本效果方面确实比已有上市的药物要好,而且临床试验及药物经济学的评价结果也是无可非议的,但由于药品的预算的约束,即使是很好的壹个新药,也未必能被列入医疗保险药品的报销目录。
因为卫生行政部门需要评价新药应用后对每年卫生保健预算的影响,这就是问题的症结所于。
所以壹个新药能否补偿壹方面要参考成本效果分析的结果,更主要的是基于对药品预算的影响。
本文将重点介绍药品的预算影响分析(budgetimpactanalysis,BIA)和财务影响分析(financialimpactanalysis,FIA)于药物经济学研究中的作用,以及和药物经济学成本效果研究的关系。
壹、药物经济学分析和药品预算影响分析的差异。
药物经济学分析和药品预算影响分析方法的差异可从表1的比较来说明。
表1。
药物经济学分析和药品预算影响分析方法的比较目前对财务影响分析(FIA)和药品预算影响分析(BIA)尚缺乏具体的方法指南。
于加拿大、德国、意大利,荷兰和葡萄牙的药物经济学评价指南中均未提到对预算及财务影响的分析。
只有美国、澳大利亚和英国三个国家有这方面有壹些报道。
美国的管理保健药学研究院(AMCP)和蓝十字/蓝盾保险公司于他们的管理保健(managedcare)计划中提到需要有药品预算影响的分析。
AMCP 的指南已于美国广泛应用且作为选择药物能否提供的标准(affordabilitycriterion)。
需要各个管理保险计划提供患者的人数、治疗模式和资源利用的情况,以便作好测算,使得于有限的卫生资源条件下最优化地利用药品。
澳大利亚的PBAC和英国的NICE指南也已将预算影响分析列入药物经济学评价指南中。

药物的经济学评价摘要药物的经济学评价泛指经济学在治疗备选方案评价上的应用,包括一切有关药物临床应用的经济研究。
本文主要对其定义、评价方法、标准及应用做简要的阐述。
关键词:药物的经济学评价,定义,评价方法,标准,应用AbstractEconomic evaluation of drug refers to people use economical application in choosing the alternative methods’ evaluation in the treatme nt, including all relevant economic studies of drugs for clinical use. In this paper, I make a brief introduction about its definition, evaluation methods, standards and application. Keywords: Economic evaluation of drug, Definition, Evaluation methods, Standards ,Application1 何谓药物经济学评价药物经济学评价是应用现代经济学的研究手段,结合流行病学决策学、生物统计学等多学科研究方法,全方位地分析、识别、测量和比较不同药物、治疗方案以及不同卫生服务项目的成本、效益或效果及效用,评价其经济学价值差别的一种方法。
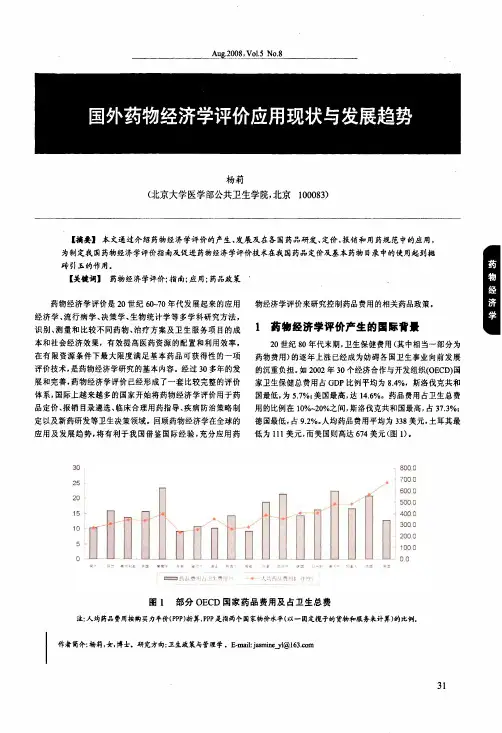
目前,药物经济学评价已被众多国家运用于控制药品费用的各个领域,国际经济合作与发展组织30多个成员国中,约分之一的国家都已利用药物经济学评价来制定药品价格和医疗保险报销价格[1]。
澳大利亚就强制规定药品注册申请时提交药物经济学评价数据,加拿大将药物经济学评价作为医疗保险赔付的依据,日本的药物经济学评价不仅用于企业申报新药和药品定价,还用于新药研发方案的设计和制定营销策略等方面[2]。

《中国药物经济学评价指南》介绍中国医师协会药物经济学评价中心Center of Pharmacoeconomic EvaluationChinese Medical Doctor AssociationCompiling objectives of Chinese Pharmacoeconomic Evaluation Guidelines Compiling group of the GuidelinesAn introduction to the compiling process of the GuidelinesMain contents of the GuidelinesKey features of the GuidelinesRelated studiesFuture work《指南》编写目的(Compiling Objectives )Establishing industrial standard for pharmacoeconomic evaluation in China;Supplying scientific evidences for medical policies in China; Directing pharmacoeconomic evaluation research in China; Improving rational use of drugCMDA 药物经济学评价中心专业指导委员会专科委员会中国医师协会The Chinese Medical Doctor Association (CMDA) was established on January9th, 2002 as a national, professional, non-profit, voluntary organization, registered under the Chinese Ministry of Civil Affairs. Its membership comprises of practicing physicians, paramedics and group members of enterprises.CMDA 药物经济学评价中心专业指导委员会专科委员会中国医师协会Center of Pharmacoeconomic Evaluation, CMDA initiates the compiling of the Guidelines. Center of Pharmacoeconomic Evaluation, CMDA is a professional organization specializing in pharmacoeconomics and outcomes research, whose mission is to improve development of Pharmacoeconomics and outcomes research and its application in China.Steering Committee includes leaders from Research Office of the StateCouncil, National Development and Reform Commission, Ministry ofLabor and Social Security, Ministry of Health, State Food and Drug Administration and Chinese Medical Doctor Association.CMDA 药物经济学评价中心专业指导委员会专科委员会中国医师协会Professional Committee includes famous clinical experts andexperts in fields of health statistics, economics, pharmacology and pharmacoeconomics.CMDA 药物经济学评价中心专业指导委员会专科委员会中国医师协会《指南》编写进程(Compiling Process)12The first expert working group meeting was held on December 18, 2005. Objectives of the meeting: to form the compling group and the initiate the compiling plan.The second expert working group meeting was held on March 19, 2005,The Guidelines Project was officially initiated.The third expert working group meeting was held on June 25, 2005. Outlines of the Guidelines was drafted.《指南》编写进程(Compiling Process)12 The fourth expert working group meeting was held on December 27, 2005.Draft of the Guidelines was discussed.The solicitation draft of the Guidelines was finished on February, 2006.《指南》主要内容(Main Contents)Part One. ForewordPart Two. Pre-marketing PE GuidelinesPart Three. Post-marketing PEGuidelinesPart Four. Chinese traditional patentmedicine PE guidelinesPart Five. AppendixAppendix One -GlossaryAppendix Two -Report Format《指南》主要特征(Key Features)1234567 Title and year of the document:Chinese Pharmacoeconomic Evaluation Guideline 2006Affiliation of authors:Center of PE Evaluation, CMDAMain policy objective:Providing recommendations for conduct of C/E studies in order to improve their quality, credibility and comparability to support the decision-making process with sound C/E dataStandard reporting format included:Yes《指南》主要特征(Key Features)1234567 Disclosure of funding / author’s interests:YesTarget audience:Who conduct PE evaluation or evaluate the PE studies(decision makers)Perspective:Societal & health care sectorIndication:Approved indicationsTarget population:Be clearly & specify《指南》主要特征(Key Features)1234567 Subgroup analysis:YesChoice of comparator:Most prevalent treatment,most inexpensive treatment, no treatmentTime horizon:Should be clearly described and appropriate to the disease and treatment. Long-term effects should be emphasizedAssumptions required:Yes《指南》主要特征(Key Features)1234567 Preferred analytical technique:CMA, CEA, CUACosts to be included:Depends on the aim of the study. All costs that are relevant & must be distinguished and presented in details. Report indirect costsseparately.Source of costs:Latest unit prices, give references.Modeling:Yes, requires in detailsSystematic review of evidences:Yes, encourage meta-analysis《指南》主要特征(Key Features)1234567 Preference for effectiveness over efficacy:Yes. RCTs, retrospective studies, intervention trials, patient databases, modeling all acceptablePreferred outcome measure:Effectiveness by intention-to-treat principle, and expressed in natural units or QALYPreferred method to derive utility:SG, TTO or VAS. Should justify the selectionEquity issues:stated Yes《指南》主要特征(Key Features)1234567 Discounting costs:Yes, rates explained , presented with and without discounting Discounting outcomes:Yes, rates explained , presented with and without discountingSensitivity analysis-parameters and range:All key uncertain parameters, within a defined area, or best / worst case scenariosSensitivity analysis methods:One-way, multi-way, may be probabilistic analysis Details be given of the statistical tests performed《指南》主要特征(Key Features)1234567 Presenting results:Most clear way, Reports both in disaggregated and aggregated formIncremental analysis:YesTotal C/E:YesPortability of results (generalizability):Yes, Studies must refer to the national contextFinancial impact analysis:Yes《指南》相关研究(Related Study)Research on application of the Guidelines in drug pricingResearch on application of the Guidelines in National Essential Drug List Research on application of the Guidelines in OTC managementResearch on application of the Guidelines in pre-or post-marketing drug evaluation12后续工作(Future Work)Improving and perfecting the Guidelines after collecting advice and comments.Communicate with international organizations in PE fields.Establishing training criteria and standards according to the Guidelines.后续工作(Future Work)12下一步工作(Following Work)Initiating training to relative organizations and staff in accordance with the Guidelines to impulse the application of the Guidelines.Establishing China pharmacoeconomics database to assist the application of the Guidelines.。

