实验探究:氯水的成分与性质探究
- 格式:pptx
- 大小:1.23 MB
- 文档页数:7

探究氯水的性质【实验目的】1.通过实验探究氯水的成分,合理推测氯气与水反应的可能产物2.通过探究次氯酸的分解产物,认识到数字化实验对于化学研究的帮助3.体会实验对认识和研究物质性质的重要作用,培养证据推理意识【实验探究】实验1:用矿泉水瓶收集一瓶纯净的氯气,用注射器向瓶中加入适量的水,充分振荡,观察实验现象。
实验2:实验1矿泉水瓶中得到的溶液称为氯水,请设计实验方案探究氯水的成分。
步骤1:观察氯水的颜色,分析推理氯水中存在的成分。
步骤2:若氯气能与水反应,根据元素守恒的原理,你认为Cl2与H2O反应会生成什么?步骤3:参考下列给出的试剂,设计实验方案,验证你的假设。
【实验试剂】可供选择的试剂:pH计、pH试纸、锌粒、AgNO3溶液、碘化钾淀粉试纸、红色纸花、试管、胶头滴管补充:用注射器收集适量氯气,如图所示将氯气缓慢通入集气瓶中,观察实验现象。
【实验内容】①常温下,氯气的水溶液称为氯水,溶于水的部分氯气与水发生反应的化学方程式是Cl2 + H2O == HCl + HClO。
在反应中Cl2是氧化剂,Cl2是还原剂,HClO氧化产物,HCl还原产物。
②新制氯水的成分由于HClO 、H 2O 是弱电解质,存在着微弱的电离。
推测氯水中的微粒为: 三分子:Cl 2、H 2O 、HClO ; 四离子:H +、Cl -、ClO -、OH -。
③漂白原理的探究实验④氯的重要化合物次氯酸的性质a.次氯酸是易溶于水的弱酸,比碳酸酸性弱,写离子方程式时不能拆成离子形式。
氯气和水反应的离子方程式:Cl 2 + H 2O == H + + Cl - + HClO 。
b.次氯酸不稳定,见光易分解,反应的化学方程式:2HClO == 2HCl +O 2↑。
c.次氯酸具有强氧化性,其氧化性比Cl 2强,可用于自来水的杀菌消毒,还可以用作漂白剂,但不能与洁厕灵(主要成分盐酸)混用,会发生反应生成氯气,反应方程式为 HCl + HClO == Cl 2 + H 2O 。




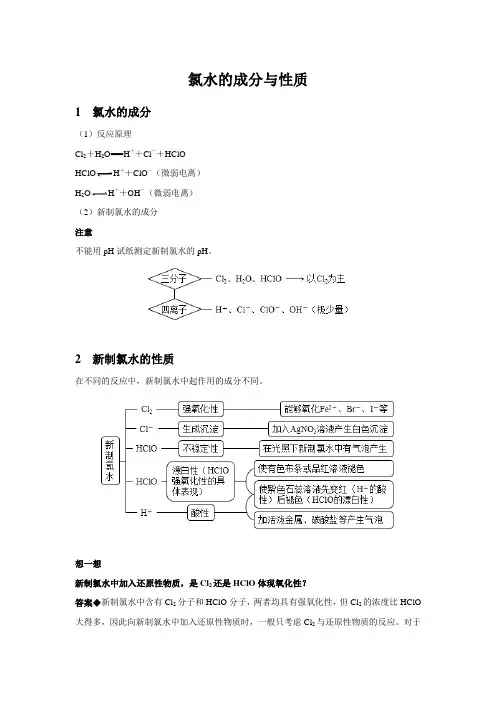
氯水的成分与性质1 氯水的成分(1)反应原理Cl2+H2O===H++Cl-+HClOHClO H++ClO-(微弱电离)H2O H++OH-(微弱电离)(2)新制氯水的成分注意不能用pH试纸测定新制氯水的pH。
2 新制氯水的性质在不同的反应中,新制氯水中起作用的成分不同。
想一想新制氯水中加入还原性物质,是Cl2还是HClO体现氧化性?答案◆新制氯水中含有Cl2分子和HClO分子,两者均具有强氧化性,但Cl2的浓度比HClO 大得多,因此向新制氯水中加入还原性物质时,一般只考虑Cl2与还原性物质的反应。
对于Cl2不能氧化的物质,则考虑HClO的氧化性,如纸张、布条中的有机色素被HClO氧化而褪色。
3 液氯、新制氯水、久置氯水的比较名师提醒(1)长期放置的氯水,由于HClO分解,Cl2全部反应,最终变为稀盐酸。
(2)氯水久置后,溶液颜色变浅、氧化性减弱、酸性增强。
典例详析例4-12(江西南昌七校期末联考)某同学用氯气消毒的自来水配制下列物质的溶液,会产生明显变质的是()①FeCl2②AgNO3③NaHCO3④AlCl3⑤KIA.①②④B.①②③⑤C.①④⑤D.全部解析◆氯气溶于自来水后,自来水中存在的微粒有:H2O、Cl2、H+、Cl-、HClO、ClO-、OH-(极少量)。
①Fe2+会被氧化;②Ag+会与Cl-反应生成AgCl沉淀;③H+会与 3HCO反应;④不受影响;⑤I-会被氧化。
答案◆B例4-13(江苏高考)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO解析◆新制饱和氯水中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-。
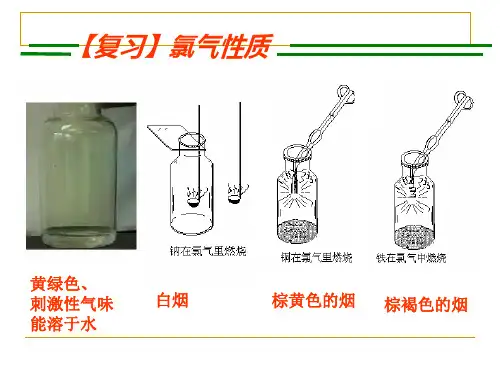


“氯水的成分及性质”教学设计1 教学设计思路分析1.1教材分析本节课是选自江苏教育出版社化学必修1专题2第一单元第三课时氯水的成分及性质。
本节课是在学习了氯气的物理性质及部分化学性质的基础上,分析猜测氯水的成分。
教材通过活动探究中的四个实验来探究氯水的成分及认识和掌握HClO的漂白性,在对氯水成分的探究过程中,由学生自主设计实验探究氯水的成分。
通过对氯水成分探究的学习,可以培养学生实验设计能力、实验操作能力。
通过知识迁移氯气与碱的反应,培养学生学会灵活运用知识、学会迁移知识,同时也能达到学以致用的目的,更能与生产生活紧密联系起来。
1.2学情分析学生的知识背景在初中学生已经学习了酸的通性,上节课又学习了氯气的物理性质及部分化学性质,对氯气的性质有了一定的了解。
但是对于高一的学生,学生对于氯气与水的反应不容易掌握,较难理解氯水的成分,实验设计能力也较弱。
为了突破学习难度,让学生体验化学探究的过程,激发学生的兴趣,促使学生将被动接受转化为主动探究。
因此,采用了“实验探究”的方法,创设问题情景,引导学生积极参与,提高学生学习化学的主观能动性。
1.3教学设计重点和基本思路本节内容重点是氯水成分探究,探究课程的学习主要来自实验、观察、思考、总结。
本节课的教学中,通过学生自主实验探究,交流讨论,共同分析,归纳总结,从而掌握氯水的成分及次氯酸的漂白性。
根据高中化学课程标准的基本概念对本节课进行了以下的教学流程。
教学流程2 教学设计方案2.1课题:氯水成分的探究2.2教学目标1、知识与技能(1)能设计实验探究氯水的成分并认识和掌握次氯酸的漂白性;(2)能完成氯气与水的化学反应及分析新制氯水的成分。
2、过程与方法(1)通过对氯水成分的探究,培养学生科学的学习方法:提出问题—形成猜想—设计实验方案—实验探究—归纳总结;(2)通过观察化学现象和反应事实,学会善于从实验中发现问题、分析问题、解决问题的方法。
3、情感态度与价值观通过自主实验探究,感受化学探究的乐趣,掌握实验探究的一般原理和方法,在获取知识的同时激发学习化学的兴趣,学会大胆猜想、主动思考、分析推理的学习方法,培养善于发现、实事求是、严谨科学的学习态度。

重点解析丨氯水的成分与性质氯水的成分与性质01氯水中的反应氯水中发生的反应主要有02氯水的成分(1)新制氯水少量Cl2与水反应,HClO未分解。
三分子:Cl2、HClO、H2O,溶质分子中以Cl2为主;四离子:H+、Cl-、ClO-、OH-(少量)。
新制氯水成分的确定(2)久置的氯水氯水久置后,HClO分解为盐酸和氧气,Cl2全部反应,氯水最终会变为稀盐酸。
03新制氯水的性质(1)氯水的不稳定性光照氯水,浅黄绿色逐渐褪去,HClO易分解生成强酸HCl,溶液的pH逐渐减小:2HClO=(光照)2HCl+O2↑。
因此,保存氯水时,应避免光照、受热。
次氯酸不稳定,见光易分解,所以氯水要现用现制。
实验室通常将氯水置于棕色试剂瓶中密封保存。
氯水受光照分解(2)表现Cl2的性质氯水中含有Cl2,所以氯水呈浅黄绿色。
由于Cl2具有强氧化性,当向氯水中加入强还原性物质时,可与Cl2发生氧化还原反应。
①氯水能使润湿的淀粉—KI试纸变蓝(用于Cl2收集时验满):2I-+Cl2=I2↓+2Cl-②能与Na2SO3、FeBr2等发生氧化还原反应:Na2SO3+Cl2+H2O=Na2SO4+2HCl、2FeBr2+3Cl2(足量)=2FeCl3+2Br2。
(3)表现HClO的性质①氯水中含有HClO,HClO具有强氧化性,可用来杀菌、消毒。
另外HClO还可将色素氧化而使其褪色,如使湿润的有色布条或品红溶液褪色等。
②HClO不稳定,在强光照射下新制氯水中有气泡产生。
(4)表现H+的性质氯水中含有H+,所以氯水具有酸的性质,如氯水能与镁粉反应放出H2,能与CaCO3反应放出CO2。
敲黑板!!!不能用pH试纸测定新制氯水的pH,应用pH计测定;紫色石蕊溶液或蓝色石蕊试纸遇新制氯水时,先变红后褪色。
(5)具有Cl-的性质氯水中加入硝酸银溶液反应生成白色沉淀。
反应的离子方程式为Ag++Cl-=AgCl↓04液氯、新制氯水和久置氯水的比较【示范例题】例题1.(单选题)新制氯水与久置的氯水相比较,下列结论不正确的是( ) A.颜色相同B.前者能使有色布条褪色C.都含有H+D.加AgNO3溶液都能生成白色沉淀【答案】A【解析】新制氯水中含有三种分子(Cl2、HClO、H2O)、四种离子(H+、Cl-、ClO-、OH-),久置的氯水就是稀盐酸。

通过探究活动让学生体验和感受知识的获取和学习过程,从微观的视角分析和解释氯气溶于水的宏观变化,把对宏观实验现象的观察与对微观世界的想象紧密地结合起来,培养学生对微观世界的想象力,建立物质的微粒观和以微粒观为依托的元素观。
微观世界的想象力,建立物质的微粒观和以微粒观为依托的元素观。
高中化学高中化学 教学设计教学设计 反思反思一、教学目标一、教学目标1.1.认识氯气能溶于水,掌握氯气跟水的反应;了解氯水的成分和性质,认识次氯酸的漂认识氯气能溶于水,掌握氯气跟水的反应;了解氯水的成分和性质,认识次氯酸的漂白性、不稳定性和弱酸性。
白性、不稳定性和弱酸性。
2.2.了解实验探究的一般原理和方法,通过预测物质可能具有的性质――实验和观察――了解实验探究的一般原理和方法,通过预测物质可能具有的性质――实验和观察――解释和结论,学习物质性质的研究方法,体验科学探究的过程。
解释和结论,学习物质性质的研究方法,体验科学探究的过程。
3.3.感受氯气及其化合物与生产、生活的密切联系,体会异常的实验现象中蕴涵的科学道感受氯气及其化合物与生产、生活的密切联系,体会异常的实验现象中蕴涵的科学道理,培养学生严谨求是的科学态度。
理,培养学生严谨求是的科学态度。
二、教学过程二、教学过程复习导入:我们在初中学过,氧气难溶于水且不与水反应;二氧化碳能溶于水且可以和水反应。
那么氯气是否溶于水,是否也能和水反应呢水反应。
那么氯气是否溶于水,是否也能和水反应呢 演示实验:用一支100ml 的针筒抽取80ml 的氯气,然后抽取20ml 的蒸馏水,反复震荡后,观察吸水前后气体体积和颜色的变化。
后,观察吸水前后气体体积和颜色的变化。
教师:展示用无色试剂瓶盛装的饱和氯水,展示用无色试剂瓶盛装的饱和氯水,引导学生观察其颜色。
引导学生观察其颜色。
(解释:(解释:氯水要盛装在氯水要盛装在棕色瓶中,为了便于学生的观察,这里暂时用无色试剂瓶盛装。
)学生:描述实验现象。
氯水的成分及性质探究教案教学目标:1.了解氯水的成分和性质;2.掌握制备氯水的方法;3.了解氯水的应用。
教学重点:教学方法:理论讲解,实验展示。
教学器材:试剂:五氧化二锰、氢氧化钠、次氯酸钠、盐酸、碘液。
器材:玻璃烧杯、滴管、试管、移液管、电子天平等。
教学过程:一、导入(5分钟)请学生回顾,什么是化学反应?哪些因素能够影响化学反应的速度?(温度、浓度、反应物种类和表面积等)1.氯水的定义氯水指的是含有次氯酸离子的溶液,通常是由次氯酸钠和酸或过氧化氢与碱反应而成的。
次氯酸离子具有强氧化性能力。
2.氯水的成分氯水是由次氯酸离子(ClO-)、氢离子(H+)和氯离子(Cl-)组成的溶液。
次氯酸钠 + 碱+ H2O → 氯水 + 盐 + H2O3.氯水的性质(1)次氯酸离子具有氧化性,可作为消毒剂和漂白剂使用。
(2)氯水能够与有机物反应,在反应中产生臭氧和有机氯化合物,具有加氧和卤代反应的性质。
(3)氯水可以作为还原剂,与碘化钠反应,生成碘离子和氯离子。
NaClO + 2NaI → I2 + NaCl + NaClO2三、制备氯水的方法(25分钟)2.方法步骤(1)将5g的次氯酸钠加入50mL蒸馏水中,搅拌均匀。
(2)用滴管将10mL的盐酸慢慢滴入溶液中,搅拌。
(3)用纸巾将溶液过滤。
(5)用滴管将过滤后的溶液滴入五氧化二锰溶液中,产生气味刺鼻的氯气。
(6)用碘液检测氧化物的存在。
将少量碘液滴入制得的氯水中,产生褐色沉淀的氧化物。
四、氯水的应用(10分钟)1.漂白:主要用于纺织品、纸张、药品等行业,去除色素和杂质。
2.消毒:消毒效果强,可用于病菌繁殖较快的场所。
3.制药工业:氯水是制备各种药物的原料。
4.其他:氯水还常用于水处理、污水处理和环境保护等领域,具有重要的应用价值。
五、课堂小结(5分钟)请学生回答如下问题:1.什么是氯水,由哪些成分组成?3.氯水有哪些应用?请学生完成以下任务:1.回顾本节课的内容,并总结所学内容的关键点和难点。
《探究氯水的成分及性质》说课稿一、教材分析(一)教材的地位和作用氯是一种典型的重要的非金属元素,位于人教版必修一第四章第二节。
对氯水成分的探究是在学习了有关氯气性质的基础上,分析猜测氯水的成分,采用分组实验探究的形式,探究存在的微粒及发现和认识新物质。
通过对氯水成分的探究学习,既能提高学生的实验设计能力,实验操作能力,也能达到学以致用的目的,更能与生产生活紧密联系起来。
(二)学情分析:1、知识层面:学生已经掌握了化学实验的基本方法,同时学习了氯气的部分性质,对本节课的学习有较为充足的知识储备。
2、能力层面:通过初中和高中阶段的训练,学生具备了一定的实验操作能力和观察分析问题的能力,但严密的逻辑推理和完整的实验探究能力还有待进一步培养和加强。
3.、心理层面:学生对化学实验、化学现象兴趣浓厚,有较强的探求欲、表现欲和成就欲,但对学生的好奇心、进取心必须做好有利的引导,使学生感受到能力的提升。
(三)教学目标的确定1. 知识与技能(1)通过设计实验探究氯水中的成分并掌握HCIO 的漂白性(2)能完成氯气与水反应方程式的书写(3)会根据实验现象分析氯水的成分(4)能够通过自学掌握HCIO的性质2.过程与方法(1)通过探究氯水的成分及性质培养学生科学的学习方法:提出问题----形成猜想----- 讨论设计方案----实验探究----归纳总结(2)通过对氯水成分的探究,培养学生理论联系实际的能力,学会发现问题、研究问题、解决问题3. 情感态度与价值观通过对化学实验的探究学生感受到探究的乐趣,激发了学生学习的兴趣,培养学生化学实验探究的思想,通过对问题的讨论,让学生能运用已有的知识去发现问题,培养敢于质疑、敢于创新的优良品质。
(四)重、难点分析 重点:氯气与水的反应 难点:新制氯水成分的实验探究 关键:HClO 的漂白性 二、教法分析本节课采用多种教学方法。
一是启发式教学法,在课堂上我充分运用学生已有的知识层层设问,逐步把学生引入到本节课的学习中;二是课堂讨论法,学生是课堂的主体,通过学生小组讨论,能充分调动学生学习的主动性,提高学习效率;三是引导实验探究,即引导学生进行正确的、规范的实验操作,从而培养了学生的实验操作技能和合作探究的能力;四是多媒体辅助教学,多媒体进入课堂,能提高教学的直观性,丰富了课堂内容,拓展了学生的视野,提高了课堂效率。