2019-2020年新人教版化学选修3高中《离子晶体》word教案
- 格式:doc
- 大小:263.99 KB
- 文档页数:3

山东省单县职高2021-2021 年高中化学离子晶体教案新人教版选修 3学习目标 ]能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。
知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关。
了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别知识梳理]1.构成离子晶体的粒子是,粒子之间的相互作用是,这些粒子在晶体中( 能或不能 ) 自由移动,所以离子晶体(能或不能 ) 导电.2.离子晶体中的配位数是指___________________________________________________.3.___________________________________ 是决定离子晶体结构的重要因素. 此外 ,离子晶体的结构还取决于____________________________.4.离子晶体的晶格能的定义是 ________________________________________________. 离子晶体的晶格能是最能反映 _____________________ 的数据 .5.晶格能越大 , 形成的离子晶体 _________________________, 而且熔点 _______________, 硬度______________. 典型的离子晶体,晶格能的大小与离子所带的电荷和离子半径的关系一般是:离子电荷高,晶格能,离子半径大,晶格能。
方法导引 ]1.离子晶体、原子晶体、分子晶体和金属晶体的比拟晶体类型原子晶体分子晶体金属晶体离子晶体晶体质点原子分子金属阳离子、自阴、阳离子〔粒子〕由电子粒子间作用共价键分子间作用复杂的静电作离子键〔力〕力用熔沸点很高很低一般较高,少部较高分低硬度很硬一般较软一般较硬,少部较硬分软溶解性难溶解相似相溶难溶〔 Na 等与易溶于极性溶水反响〕剂导电情况不导电一般不导电良导体固体不导电,熔〔除硅〕化或溶于水后导电实例金刚石、水晶、干冰、冰、纯Na、 Mg、 Al 等NaCl 、CaCO3碳化硅等硫酸、 H2(S)NaOH等2.物质熔沸点的比拟⑴不同类晶体:一般情况下,原子晶体>离子晶体 >分子晶体⑵同种类型晶体:构成晶体质点间的作用大,那么熔沸点高,反之那么小。
2019-2020年高中化学《离子晶体》教案3 新人教版选修3教学目标设定:通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
教学重点、难点:晶格能的定义和应用。
教学方法建议:分析、归纳、应用教学过程设计:[复[阅读与思考]:阅读下表,讨论、分析得出哪些结论?(小组讨论、交流、汇报)表1表2[板1、定义:气态离子形成1mol离子晶体时释放的能量。
2、规律:(1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。
(2)晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
[科学视野]:阅读P84----科学视野,从中你知道了什么?[板书]:3、岩浆晶出规则:晶格能高的晶体,熔点较高,更容易在岩浆冷却过程中先结晶析出。
(美国矿物学家鲍文)教学习题设计:1、下列大小关系正确的是()A、晶格能:NaCl<NaBrB、硬度:MgO>CaOC、熔点:NaI>NaBrD、熔沸点:CO2>NaCl2、已知:三种氟化物的晶格能如下表:三种氟化物的晶格能的递变原因是。
3回答下列问题:(1)橄榄石和云母晶出的顺序是。
(2)石英总是在各种硅酸盐析出后才晶出的原因是。
(3)推测云母和橄榄石的熔点顺序为,硬度大小为。
4、下表列出了钠的卤化物和硅的卤化物的熔点:(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是。
(2)NaF 的熔点比NaBr的熔点高的原因是。
SiF4的熔点比SiBr4的熔点低的原因是。
(3)NaF和NaBr的晶格能的高低顺序为,硬度大小为。
2019-2020年高中化学《离子晶体》教案4 新人教版选修3教学内容分析:学生具备了离子键、离子半径、离子化合物等基础知识,本节直接给出氯化钠、氯化铯晶胞,然后在科学探究的基础上介绍影响离子晶体结构的因素,通过制作典型的离子晶体模型来进一步理解离子晶体结构特点,为学习晶格能作好知识的铺垫。
教学目标设定:1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。

第四节离子晶体1.能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2.知道离子晶体的结构微粒、微粒间作用力以及与其他晶体的区别。
1.结构特点(1)构成粒子:阳离子和阴离子。
(2)作用力:离子键。
(3)配位数:一个离子周围最邻近的异电性离子的数目。
2.结构的决定因素(1)几何因素:晶体中正负离子的半径比。
(2)电荷因素:晶体中正负离子的电荷比。
(3)键性因素:离子键的纯粹程度。
3.性质熔、沸点熔、沸点较高,难挥发硬度硬度较大,难于压缩溶解性一般在水中易溶,在非极性溶剂中难溶导电性固态时不导电,熔融状态或在水溶液中能导电4.常见的离子晶体NaCl CsCl CaF2晶胞阴离子的配位数 6 8 4阳离子的配位数 6 8 81.正误判断(正确的打“√”,错误的打“×”,并阐释错因或列举反例)。
语句描述正误 阐释错因或列举反例(1)离子晶体中一定含有金属元素(2)由金属元素和非金属元素组成的晶体一定是离子晶体(3)离子晶体中除含离子键外还可能含其他化学键 (4)离子晶体的熔点一定低于原子晶体的熔点(5)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化答案:(1)× 不一定,如NH 4NO 3晶体中不含金属元素 (2)× 不一定,如AlCl 3是分子晶体 (3)√(4)× 不一定,如MgO 的熔点(2 852 ℃)高于SiO 2的熔点(1 710 ℃)(5)× 离子晶体受热熔化,虽破坏化学键,但未形成新化学键,属于物理变化 2.在NaCl 和CsCl 两种晶体中,阴、阳离子的个数比都是1∶1,都属于AB 型离子晶体,为什么二者的配位数不同、晶体结构不同?其规律是什么?答案:在NaCl 晶体中,正负离子的半径比r +r -=0.525,在CsCl 晶体中,r+r -=0.934,由于r+r -值的不同,结果使晶体中离子的配位数不同,其晶体结构不同。

"四川省德阳五中高中化学第三章-第四节-离子晶体2 新人教版选修3 "离子晶体(第一课时)教学设计流程图节板块1. 建构离子晶体的概念、性质任务1.1 概念及性质任务 1.2常见的离子晶体. 复习前几节课学过的分子晶体、原子晶体的概念与性质小组讨论推导出离子晶体的概念及性质板书:一、离子晶体1.离子晶体概念:由阳离子和阴离子通过离子键结合而成的晶体2.性质:熔沸点较高提问:构成离子晶体的粒子是什么?粒子间的相互作用是什么?提问:组成离子晶体的物质有哪些?教师总结:常见的离子晶体有:从组成上看:活泼金属与活泼非金属元素组成的晶体。
从类别看:强碱:KOH、Ca(OH)2、NaOH、Ba(OH) 2等。
大部分盐类:NaCl、CaF2、Na2SO4、CH3COONa、NH4Cl等。
某些金属氧化物:CaO、K2O等板书:3、常见的离子晶体讲述:在离子晶体中,阴、阳离子是按一定规律在空间排列的,下面就以NaCl和CsCl晶体为例来讨论在离子晶体中阴,阳离子是怎样排列的?实物及投影展示:CsCl的晶胞模型教师指导:小组讨论分析氯化铯晶体中,铯离子和氯离子的位置,每个Cs+周围同时吸引着小组讨论总结学生回答:构成离子晶体的粒子是阴、阳离子,粒子间的相互作用是离子键。
学生回答,学生小组讨论小组汇报学生回答观察小组讨论通过复习分子晶体、原子晶体的相关知识,学会利用“知识迁移”的学习方法去学习离子晶体,培养自学能力。
培养观察能力,引起学生注意,激发兴趣。
板块2:离子晶体的结构任务 2.1离子的配位数定义几个Cl-,每个Cl-周围同时吸引着几个Cs+?教师总结:每个Cs+周围同时吸引着8个Cl-,每个Cl-周围同时吸引着8个Cs+教师讲述:我们把这个8起了个名字叫配位数,同学们可以给配位数下个定义吗?教师总结:同学们回答的很好板书:二、离子晶体的结构1.配位数:指一个离子周围最邻近的异电性离子的数目。
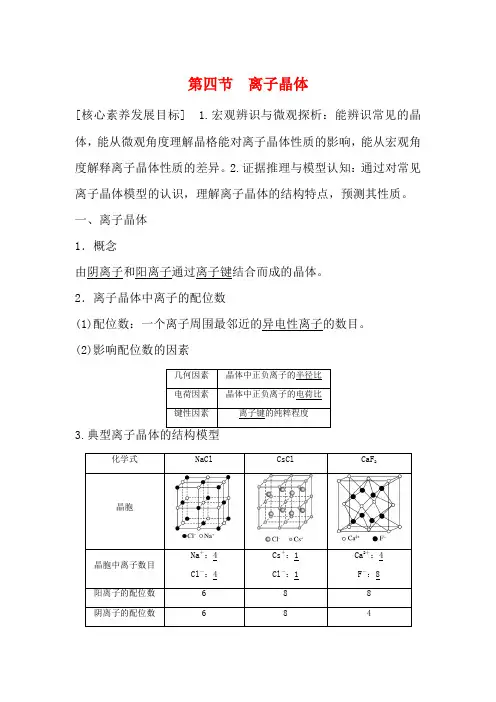
第四节离子晶体[核心素养发展目标] 1.宏观辨识与微观探析:能辨识常见的晶体,能从微观角度理解晶格能对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
2.证据推理与模型认知:通过对常见离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
一、离子晶体1.概念由阴离子和阳离子通过离子键结合而成的晶体。
2.离子晶体中离子的配位数(1)配位数:一个离子周围最邻近的异电性离子的数目。
(2)影响配位数的因素几何因素晶体中正负离子的半径比电荷因素晶体中正负离子的电荷比键性因素离子键的纯粹程度3.典型离子晶体的结构模型化学式NaCl CsCl CaF2晶胞晶胞中离子数目Na+:4Cl-:4 Cs+:1Cl-:1Ca2+:4F-:8阳离子的配位数 6 8 8 阴离子的配位数 6 8 44.离子晶体的性质(1)熔、沸点较高,硬度较大。
(2)离子晶体不导电,但熔化或溶于水后能导电。
(3)大多数离子晶体能溶于水,难溶于有机溶剂。
1离子晶体中无分子,物质的化学式只表示物质的阴、阳离子个数比,不是分子式。
2离子晶体中一定含有离子键,也可能含有共价键。
3离子晶体中离子键没有方向性和饱和性,但每个阴阳离子周围排列的带相反电荷的离子数目都是固定的。
4常见的离子晶体包括强碱、活泼金属的氧化物、大部分盐。
例1自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。
下列一定能说明CaF2是离子晶体的实验是( ) A.CaF2难溶于水,其水溶液的导电性极弱B.CaF2的熔、沸点较高,硬度较大C.CaF2固体不导电,但在熔融状态下可以导电D.CaF2在有机溶剂(如苯)中的溶解度极小【考点】离子晶体的组成与性质【题点】离子晶体的性质及应用答案C解析离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。
例2 (2018·长沙高二期中)如图为NaCl 和CsCl 的晶体结构,下列说法错误的是( )A .NaCl 和CsCl 都属于AB 型的离子晶体B .NaCl 和CsCl 晶体中阴、阳离子个数比相同C .NaCl 和CsCl 晶体中阳离子的配位数分别为6和8D .NaCl 和CsCl 都属于AB 型的离子晶体,所以阳离子与阴离子的半径比相同【考点】 离子晶体的结构特点【题点】 离子晶体的结构分析答案 D解析 NaCl 和CsCl 都是由阴、阳离子通过离子键构成的晶体,阴、阳离子个数之比都为1∶1,则都属于AB 型的离子晶体,故A 、B 正确;结合题图可知,NaCl 为面心立方结构,钠离子的配位数为6,CsCl 为体心立方结构,铯离子的配位数为8,故C 正确;NaCl 和CsCl 都属于AB 型的离子晶体,但钠离子半径小于铯离子半径,则NaCl 的阳离子与阴离子的半径比r +r -小于CsCl 的,故D 错误。

7、離子晶體特點:(1) 較高的熔點和沸點,難揮發、難於壓縮。
(2) 硬而脆(3) 不導電,但熔化後或溶於水後能導電。
(4) 大多數離子晶體易溶於極性溶劑中,難溶於非極性溶劑中。
教學過程教學步驟、內容教學方法、手段、師生活動[復習]分子晶體、原子晶體、金屬晶體的有關理論。
[過渡]在晶體中,若微粒為離子,通過離子鍵形成的晶體為離子晶體,今天我們來研究離子晶體。
[板書]第四節離子晶體一、離子晶體1、定義:由陽離子和陰離子通過離子鍵結合而成的晶體。
[講]在離子晶體中,陰陽離子間只存在離子鍵。
不存在分子,而化學式表示為晶體中陰陽離子個數的最簡化。
陰陽離子採用不等徑密堆積。
[板書]2、構成微粒:陰陽離子3、微粒間的作用:陰陽離子間以離子鍵結合,離子內可能有共價鍵[講]離子晶體不一定含有金屬陽離子,如NH4Cl為離子晶體,不含有金屬陽離子,但一定含有陰離子。
[講]離子晶體種類繁多,結構多樣,圖3—27給出了兩種典型的離子晶體的晶胞。
我們來研究晶體中的配位數(在離子晶體中離子的配位數(縮寫為C N)是指一個離子周圍最鄰近的異電性離子的數目)。
[投影]NaCl和CsCl的晶胞:[科學探究]1、CsCl、NaCl的陽離子和陰離子的比例都是l:l,同屬AE型離子晶體。
參考圖3—27、圖3-28,數一數這兩種離子晶體中陽離子和陰離子的配位數,它們是否相等?並填表。
離子晶體陰離子的配位數陽離子的配位數NaCl 6 6CsCl 8 82、你認為什麼因素決定了離子晶體中離子的配位數?利用相關數據計算,並填表:ZnS NaCl CsClr+/r-=0.2-0.4 r+/r-=0.52 r+/r-=0.93C.N=4 C.N=6 C.N=8[投影]探究練習參考資料:離子Na+Cs+Cl-離子半徑/pm95 169 18l[講] 顯而易見,NaCl和CsCl是兩種不同類型的晶體結構。
晶體中正負離子的半徑比(r+/r-)是決定離子晶體結構的重要因素,簡稱幾何因素。

高中化学离子晶体教案设计作为高中化学的一部分,离子晶体是一个重要的内容。
离子晶体是由离子组成的有序排列的结晶固体,由于其独特的物理和化学性质,有着广泛的应用。
本文将围绕离子晶体的基本概念、晶体结构、特性、制备以及应用等方面,结合教学内容,设计一份完整的化学教案,旨在帮助学生更好的掌握化学中离子晶体的相关知识。
一、教学目标1、了解离子晶体的基本概念,包括离子晶体是如何形成的,它们的化学组成,因离子晶体结构而产生的特殊性质等。
2、了解离子晶体的种类和晶体结构,包括简单离子晶体和复合离子晶体等。
3、了解晶体结构的模型,包括离子晶体的离子键模型、离子晶体的离子键/电子共价键模型等。
4、学习离子晶体的制备方法,包括凝胶法、熔融法、水热法等。
5、了解离子晶体的消光性质,了解偏振镜的基本原理,理解所观察到的消光现象。
6、学习离子晶体的应用,包括在生产生活中的应用和其它方面的应用。
二、教学方法1、讲授教学法通过教学的方式,讲解离子晶体的相关概念、结构、特性、制备以及应用等方面的内容,引导学生对离子晶体的认知。
2、实验教学法通过实验尝试,让学生对离子晶体的制备、消光、性质等方面的知识有更深入的了解,同时培养学生的实验操作能力和实验观察能力。
3、讨论教学法以小组讨论的方式,引导学生自觉思考问题,互相交流讨论,提高学生的能力和兴趣。
三、教学过程1、对离子晶体基本概念的讲解分别从离子晶体的形成、化学组成、特殊性质等方面进行讲解,引导学生了解离子晶体的形成及其特点。
了解离子晶体的化学组成,了解离子晶体的性质。
2、离子晶体的种类和晶体结构分别介绍了简单离子晶体和复合离子晶体的种类,从晶体结构的角度讲解了离子晶体的结构模型,包括离子键模型、离子键/电子共价键模型等方面的内容。
3、离子晶体的制备按照不同的制备方法,分别讲解凝胶法、熔融法、水热法等制备离子晶体的方法和步骤,并结合实验进行讲解。
4、离子晶体的消光特性通过实验,让学生亲身体验离子晶体的消光性质并了解偏振镜的基本原理,让学生观察到消光现象。

第四節離子晶體第一課時教學內容分析:學生具備了離子鍵、離子半徑、離子化合物等基礎知識,本節直接給出氯化鈉、氯化銫晶胞,然後在科學探究的基礎上介紹影響離子晶體結構的因素,通過製作典型的離子晶體模型來進一步理解離子晶體結構特點,為學習晶格能作好知識的鋪墊。
教學目標設定:1.掌握離子晶體的概念,能識別氯化鈉、氯化銫、氟化鈣的晶胞結構。
2.學會離子晶體的性質與晶胞結構的關係。
3.通過探究知道離子晶體的配位數與離子半徑比的關係。
4、通過碳酸鹽的熱分解溫度與陽離子半徑的自學,拓展學生視野。
教學重點難點:1、離子晶體的物理性質的特點2、離子晶體配位數及其影響因素教學方法建議:分析、歸納、討論、探究教學過程設計:[引入]1、什麼是離子鍵?什麼是離子化合物?2、下列物質中哪些是離子化合物?哪些是只含離子鍵的離子化合物?Na2O NH4Cl O2Na2SO4NaCl CsCl CaF23、我們已經學習過幾種晶體?它們的結構微粒和微粒間的相互作用分別是什麼?[板書]一、離子晶體[展示] NaCl 、CsCl晶體模型[板書]陰、陽離子通過離子鍵形成離子晶體1、離子晶體定義:由陽離子和陰離子通過離子鍵結合而成的晶體注:(1)結構微粒:陰、陽離子(2)相互作用:離子鍵(3)種類繁多:含離子鍵的化合物晶體:強鹼、活潑金屬氧化物、絕大多數鹽(4)理論上,結構粒子可向空間無限擴展[思考]下列物質的晶體,哪些屬離子晶體?離子晶體與離子化合物之間的關係是什麼?乾冰、NaOH、H2SO4、K2SO4、NH4Cl、CsCl[投影]2、離子晶體的物理性質及解釋離子晶體溶解性差異較大:NaCl、KNO3、(NH4)2SO4_______BaSO4、CaCO3_______[板書]3、離子晶體中離子鍵的配位數(C.N.)(1)定義:是指一個離子周圍鄰近的異電性離子的數目[探究] NaCl和CsCl晶體中陰、陽離子的配位數(2[投影][學生活動] NaCl、CsCl中正、負離子的半徑比和配位數[自主探究]CaF2晶體中陰、陽離子的配位數[板書](3)影響陰、陽離子的配位數的因素|①正、負離子半徑比的大小②正、負離子所帶電荷的多少[學生活動]四種類型晶體的比較[練習]1、下列含有極性鍵的離子晶體是①醋酸鈉②氫氧化鉀③金剛石④乙醇⑤氯化鈣A、①②⑤B、①②C、①④⑤D、①⑤2下列說法正確的是A、一種金屬元素和一種非金屬元素一定能形成離子化合物B、離子鍵只存在於離子化合物中C、共價鍵只存在於共價化合物中D、離子化合物中必定含有金屬元素3、CsCl晶體中Cs+的 C.N.是____ Cl-的C.N.是_____.CaF2晶體中Ca2+的 C.N.是____ F-的C.N.是_____.已知KCl的晶體結構與NaCl的相似,則KCl晶體中K+的 C.N.是____ Cl-的C.N.是_____.。
2019-2020年高中化学《离子晶体》教案9 新人教版选修3教学目标设定:通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
教学重点、难点:晶格能的定义和应用。
教学方法建议:分析、归纳、应用教学过程设计:[复习]:四种类型晶体的比较:[阅读与思考]:阅读下表,讨论、分析得出哪些结论?(小组讨论、交流、汇报)表1:表2:[板书]:二、晶格能1、定义:气态离子形成1mol离子晶体时释放的能量。
2、规律:(1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。
(2)晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
[科学视野]:阅读P84----科学视野,从中你知道了什么?[板书]:3、岩浆晶出规则:晶格能高的晶体,熔点较高,更容易在岩浆冷却过程中先结晶析出。
(美国矿物学家鲍文)教学习题设计:1、下列大小关系正确的是A、晶格能:NaCl<NaBrB、硬度:MgO>CaOC、熔点:NaI>NaBrD、熔沸点:CO2>NaCl2、已知:三种氟化物的晶格能如下表:三种氟化物的晶格能的递变原因是。
3、已知:硅酸盐和石英的晶格能如下表:回答下列问题:(1)橄榄石和云母晶出的顺序是。
(2)石英总是在各种硅酸盐析出后才晶出的原因是。
(3)推测云母和橄榄石的熔点顺序为,硬度大小为。
4、下表列出了钠的卤化物和硅的卤化物的熔点:回答下列问题:(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是。
(2)NaF 的熔点比NaBr的熔点高的原因是。
SiF4的熔点比SiBr4的熔点低的原因是。
(3)NaF和NaBr的晶格能的高低顺序为,硬度大小为。
2019-2020年高中化学《离子晶体》教案设计新人教版选修4[科学探究] p78讲] 显而易见,NaCl和CsCl是两种不同类型的晶体结构。
晶体中正负离子的[讲]由下图氯化钠晶体结构模型可得:每个Na+紧邻6个Cl-,每个Cl 个Na+(上、下、左、右、前、后),这邻的Na+与Cl-间的距离为a,每个Na6.影响因素:[小结]晶格能越大,越早析出晶体。

第4节离子晶体第一课时离子晶体学习目标:1.能通过电子的得失来说明离子键的形成,能根据离子化合物的结构特征来解释其物理性质。
2.了解NaCl晶体、CsCl 晶体、CaF2晶体的结构,掌握阴、阳离子的配位数。
3.了解影响晶体中离子配位数的因素——几何因素和电荷因素。
[知识回顾]1.什么是离子键?什么是离子化合物?答:阴、阳离子之间通过静电作用形成的化学键叫做离子键。
含有离子键的化合物称为离子化合物。
2.下列物质中属于离子化合物的是①②④⑤⑥⑦,只含离子键的离子化合物是①⑤⑥⑦。
①Na2O②NH4Cl③O2④Na2SO4⑤NaCl⑥CsCl⑦CaF23.我们已经学习过几种晶体?它们的结构微粒和微粒间的相互作用分别是什么?答:晶体类型分子晶体原子晶体金属晶体结构微粒分子原子金属阳离子和自由电子微粒间的相分子间作用力共价键金属键互作用力1.离子键(1)离子键的实质:是静电作用,它包括阴、阳离子之间的引力和两种离子的原子核之间以及它们的电子之间的斥力两个方面,当引力与斥力之间达到平衡时,就形成了稳定的离子化合物,它不显电性。
(2)离子键的特征:没有方向性和饱和性。
因此,以离子键结合的化合物倾向于形成紧密堆积,使每个离子周围尽可能多地排列异性电荷的离子,从而达到稳定的目的。
2.离子晶体(1)离子晶体:阳离子和阴离子通过离子键结合而成的晶体称为离子晶体。
(2)常见离子晶体的配位数:在NaCl晶体中阳离子和阴离子的配位数都是6;在CsCl晶体中,阳离子和阴离子的配位数都是8;在CaF2晶体中,Ca2+的配位数为8,F-的配位数为4。
(3)离子晶体中阴阳离子配位数的决定因素:几何因素、电荷因素和键性因素。
(4)离子晶体的物理性质:硬度大,难压缩,熔、沸点高。
知识点一离子键与离子晶体1.离子键(1)成键元素:活泼金属元素(如K、Na、Ca、Ba等,主要是第ⅠA族和第ⅡA族元素)和活泼非金属元素(如F、Cl、Br、O等,主要是第ⅥA族和第ⅦA族元素)相互结合时多形成离子键。

高中化学选修三晶体教案
教学目标:
1. 理解晶体的定义和结构特点;
2. 掌握晶体的分类方法;
3. 熟悉晶体在化学中的应用。
教学重点:
1. 晶体的结构特点;
2. 晶体的分类方法;
3. 晶体在化学中的应用。
教学难点:
1. 理解晶体结构的复杂性;
2. 掌握晶体的分类方法;
3. 理解晶体的应用原理。
教学过程:
一、导入(5分钟)
请学生回顾一下晶体的概念和结构特点,并简单介绍晶体在日常生活中的应用。
二、知识讲解(15分钟)
1. 什么是晶体?
2. 晶体的结构特点是什么?
3. 晶体的分类方法有哪些?
三、案例分析(15分钟)
介绍几个晶体在化学中的应用案例,让学生分析晶体在这些案例中的作用和原理。
四、实验操作(20分钟)
设计一个简单的实验,让学生观察不同晶体的结构特点,并比较它们的性质。
五、课堂讨论(15分钟)
组织学生讨论晶体的应用领域和未来发展趋势。
六、总结复习(10分钟)
总结本节课的重点知识,并布置相关作业。
七、作业布置
1. 阅读相关文献,了解晶体的近期研究进展;
2. 撰写一篇关于晶体在化学中应用的文章。
教学反思:
本节课通过案例分析和实验操作,帮助学生更深入地理解晶体的结构和应用,激发了他们对化学学科的兴趣和热情。
在以后的教学过程中,应进一步拓展晶体的应用领域,引导学生深入思考晶体在现代化学中的重要性和作用。
教学时间教学课题专题专题3微粒间作用力与物质性质单元第二单元离子键离子晶体节题第二课时离子晶体教学目标知识与技能1、了解晶格能的涵义。
2、了解影响离子晶体的晶格能大小的因素3、知道晶格能的大小可以衡量离子晶体中离子键的强弱。
4、知道离子晶体晶格能的大小和离子晶体熔点高低、硬度大小的关系。
过程与方法进一步丰富晶体结构的知识,提高分析问题和解决问题的能力和联想比较思维能力。
情感态度与价值观通过学习金属特性,体会化学在生活中的应用,增强学习化学的兴趣;教学重点离子晶体晶格能的大小和离子晶体熔点高低、硬度大小的关系教学难点晶格能的涵义教学方法探究讲练结合教学准备教学过程教师主导活动学生主体活动【基础知识】1、构成离子晶体的微粒,微粒间的作用是。
2、晶格能是指的能量。
3、离子晶体有多种类型。
其中和是两种最常见结构类型【知识要点】1、离子键的强度:(晶格能)以 NaCl 为例:键能:1mol 气态 NaCl 分子, 离解成气体原子时, 所吸收的能量. 用Ei 表示:【板书】(2)晶格能(符号为U):拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能【讲解】在离子晶体中,阴、阳离子间静电作用的大小用晶格能来衡量。
晶格能(符号为U)是指拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。
例如:拆开 1mol NaCl 晶体使之形成气态钠离子和氯离子时, 吸收的能量. 用 U 表示:NaCl(s) Na+(g) + Cl-(g) U= 786 KJ.mol-1阴阳离子静电作用气态不是化学变化理解教师主导活动学生主体活动晶格能 U 越大,表明离子晶体中的离子键越牢固。
一般而言,晶格能越大,离子晶体的离子键越强. 破坏离子键时吸收的能量就越多,离教学过程子晶体的熔沸点越高,硬度越大。
键能和晶格能, 均能表示离子键的强度, 而且大小关系一致.【板书】(3)影响离子键强度的因素——离子的电荷数和离子半径离子电荷数越大,核间距越小,晶格能越大,离子键越牢,离子晶体的熔、沸点越高,硬度越大。
NaCl 晶胞:(1) 1个NaCl 晶胞中,有 ________ 个NaS 有 ________ 个C 「。
(2) 在N“C1晶体中,Nf 的配位数为 ______ , C1 一的配位数为 ______ 。
说明:离子晶体中与某离子距离最近的异性离子的数目叫该离子的配位数。
(配位数缩写为C. N.)(3) 在NaCl 品体屮,每个NQ 周围与它最接近且距离相等的Nf 共有 _______ 个。
同理:每个C 「周围与它最接近且距离相等的ci —共有 ________个。
CsCl 晶胞:(1) 1个CsCl 品胞屮,有 _____ 个CsS 有 _____ 个C 「。
(2) 在CsCl 晶体中,Cs+的配位数为 ______ , C1-的配位数为 _______ o (3) 在CsCl 晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有 _______ 个, 形成 ________________ 形。
同理:在CsCl 晶体中,每个C 厂周围与它最接近且距离相等的C1■共有 _____个。
【投影】CaF2晶胞 CaF2晶胞:(1) 1个cm 的晶胞中,有 ____________ 个c 『+, 有 __________ 个厂。
(2) CK 的晶体中,Cf 和厂的配位数不同,C 产配位数是 _________ ,厂的配位数是 ______ 。
思考:为什么NaCl 、CsCl 化学式相似,空间结构不同?【板书】3、影响离子晶体配位数的因素。
提出 问题 引导 学生观察 氯化 钠、 氯化 艳、 氟化 钙的 晶胞 结构 ,最 后归 纳得 出结 论。
(1)儿何因素・晶体屮正、负离子的半径比半径比(r+/r)0. 2 〜0.40. 4〜0.70. 7〜1.0〉1.0配位数46812代表物ZnS NaCl CsCl CsF结论:AB型离子晶体中,正、负离子的半径比越大,离子的配位数越大。
(2)电荷因素——品体中正、负离子的电荷比(3)键性因素 ----- 离子键的纯粹程度【巩固练习】1>已知KC1的晶体结构与NaCl的相似,则KC1晶体中K’的C.N.是________ , CT的C.N.是_____ o2、现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a 处于晶胞的中心),可推知:甲晶体中x与y的个数比是_____________ ,乙中a与b的个数比是 ______ ,丙晶胞中有________ 个c离子,有 ____________ 个d离子。
2024年,高中化学教学中的离子晶体教学是非常重要的一部分。
离子晶体是由阳离子和阴离子通过静电相互作用形成的高度有序的晶体。
在化学教学中,离子晶体的知识是我们理解化学反应、材料性质、能量转化等基础知识,这也是一个高中化学科目的核心内容。
本次教学活动将通过实验和课堂讲授结合,让学生们更加深入、全面地了解离子晶体的结构、特性和应用。
具体而言,在教学中,我们将:
1.引导学生了解离子晶体的结构和晶体缺陷。
2.对离子晶体的性质进行深入探究,探讨离子晶体的熔点、溶解度和颜色等方面。
3.通过离子晶体的应用来引导学生将知识应用到实际生活中。
例如:离子晶体光学器件的应用、半导体材料等等。
4.通过实验,让学生们亲身体验离子晶体的性质和应用,提升学生们的实验操作能力,并培养学生们的创新思维。
5.在交流中促进学生合作,提升学生的交流能力。
6.通过系列探究、观察等方式帮助学生理解化合物中的离子成分,说明离子成分对化合物的性质和反应的影响。
本次高中化学离子晶体教学将以实验、讲解、交流和互动等方式进行,旨在引领学生理解化学中的离子晶体领域,提高学生们的实验操作能力和学习能力,让学生们掌握离子晶体的基本知识、结构、特性和应用,从而全面提高学生的化学素养。
2019-2020年新人教版化学选修3高中《离子晶体》
word教案
教学目标
(1)了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱;
(2)知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关;
(3)能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别。
教学重、难点
了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
教学过程
[复习]分子晶体、原子晶体、金属晶体的有关理论。
[过渡] 在晶体中,若微粒为离子,通过离子键形成的晶体为离子晶体,今天我们来研究离子晶体。
[板书] 第四节离子晶体
一、离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
[讲述] 离子晶体种类繁多,结构多样,图3—27给出了两种典型的离子晶体的晶胞。
我们来研究晶体中的配位数(在离子晶体中离子的配位数(缩写为C N)是指一个离子周围最邻近的异电性离子的数目)。
[投影] NaCl和CsCl的晶胞:
[科学探究] 1、CsCl、NaCl的阳离子和阴离子的比例都是1:同属AE型离子晶体。
[讲述]显而易见,NaCl和CsCl是两种不同类型的晶体结构。
晶体中正负离子的半径比(r+/r-)是决定离子晶体结构的重要因素,简称几何因素。
[板书] 1、几何因素:晶体中正负离子的半径比(r+/r-)。
[讲解] 上面两例中每种晶体的正负离子的配位数相同,是由于正负离子电荷(绝对值)相同,于是正负离子的个数相同,结果导致正负离子配位数相等,如在NaCl中,Na +扩和C1-的配位数均为6。
如果正负离子的电荷不同,正负离子的个数必定不相同,结果,正负离子的配位数就不会相同。
这种正负离子的电荷比也是决定离子晶体结构的重
要因素,简称电荷因素。
例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:l,Ca2+和F-的个数比是l:2,如图3—29所示。
Ca2+的配位数为8,F-的配位数为4。
此外,离子晶体的结构类型还取决于离子键的纯粹程度(简称键性因素)。
[板书] 2、电荷因素:正负离子的电荷比。
3、键性因素:离子键的纯粹程度。
[讲述] 在离子晶体中,离子间存在着较强的离子键,使离子晶体的硬度较大、难于压缩;而且,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。
因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801℃,沸点为l 413℃;ClCl的熔点为645℃,沸点为l290℃。
[板书] 4、离子晶体特点:硬度较大、难于压缩、较高的熔点和沸点。
[自学] 科学视野—复杂离子的晶体
碳酸盐在一定温度下会发生分解,如大家熟悉的碳酸钙煅烧得到石灰(CaO),这是由于碳酸钙受热,晶体中的碳酸根离子会发生分解,放出二氧化碳。
实验证明,碳酸盐的阳离子不同,热分解的温度不同。
第四节离子晶体(第二课时)
教学目标
(1)了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱;
(2)知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关;
(3)能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别。
教学重、难点
了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
[板书] 二、晶格能
[讲解] 最能反映离子晶体稳定性的数据是它们的晶格能。
离子晶体的品格能的定义是气态离子形成l摩离子晶体释放的能量,通常取正值,表3—8给出了某些离子晶体的晶格能数据。
[板书]1、定义:气态离子形成l摩离子晶体释放的能量,通常取正值。
[投影]
[
[板书] 2、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
[自学] 科学视野—岩浆晶出规则与晶格能。
[问题] 1、什么是岩浆晶出?
2、岩浆晶出顺序与晶格能的关系?。