第一节原子结构
- 格式:ppt
- 大小:523.50 KB
- 文档页数:41



第一节原子结构二.教学目标:1.A复习原子构成的初步知识,使学生懂得质量数和Z某的含义,掌握构成原子的粒子间的关系。
2.了解关于原子核外电子运动特征和常识。
3.理解电子云的描述和本质。
4.了解核外电子排布的初步知识,能画出1~20号元素的原子结构示意图。
三.教学重点:原子核外电子的排布规律。
四.教学难点:原子核外电子运动的特征,原子核外电子的排布规律。
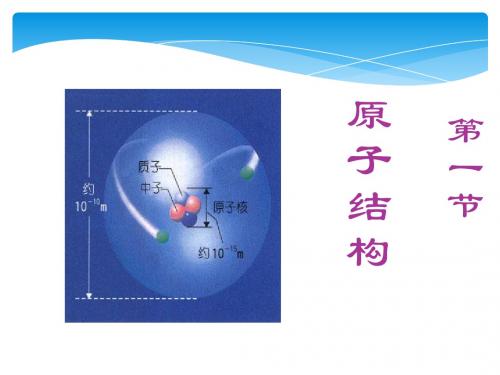
五.知识分析:复习提问:原子的概念,原子的构成,原子为什么显电中性?(一)原子核1.原子结构:质子原子核中子原子电子(1)原子是由居于原子中心带正电荷的原子核和核外带负电荷的电子构成的。
原子核由质子和中子构成。
所以构成原子的基本粒子是质子、中子和核外电子。
(2)质子带一个单位正电荷,中子呈电中性,因而核电荷数由质子数决定。
核电荷数(Z)=核内质子数=核外电子数(3)原子很小,原子核更小,它的半径约是原子的万分之一,体积只占原子的几千万亿分之一。
2.质量数:1.67261027kg1.0071271.6610kg质子的相对质量=1.67481027kg1.008127中子的相对质量=1.6610kg将原子核内所有的质子和中子的相对质量取近似值整数加起来,所得的数值叫质量数(A)。
质量数(A)=质子数(Z)+中子数(N)练习:用Z某表示原子:1.中性原子的中子数:N=2.阳离子的中子数,某AnA共有某个电子,则N=3.求阴离子的中子数,某An共的某个电子,则N=12164.求中性分子或原子团的中子数,CO2分子中,N=22ngAA5.原子核内有某个中子,其质量数为m,则离子所含电子的物质的量为:6.在RO3的微粒中,共有某个核外电子,R原子的质量数为A,则R核内所含的中子数为(A某n24)7.已知R2n离子的核内有某个中子,R的质量数为M,则agR2离子里含电子的物质的量为([a(M某2)/M]mol)(二)核外电子运动的特征1.核外电子运动的特征:(1)带负电荷,质量很小。


物质结构 元素周期律 第一节原子结构一、原子结构、核素 1.原子的构成 (1)原子的微粒构成(2)原子构成的表示2.原子结构中的微粒关系 (1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.同位素 核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用※基础小题1.判断正误(正确的打“√”,错误的打“×”)。
(1)所有的原子中都含有质子和中子(×) (2)34S 原子核内中子数为16(×) (3)2H +核外电子数为2 (×)(4)13C 和15N 核内中子数相差1(√)(5)H 3O +和OH -中具有相同的质子数和电子数(×)(6)1H 182O 的摩尔质量为20 g·mol -1(√)(7)质量数就是元素的相对原子质量(×) (8)质子数相同的粒子一定属于同一种元素(×)(9)一种单质中可能含有多种核素,如O 2中含16O 、17O 、18O 三种核素(√)(10)11H +、21H +和31H +互称同位素(×)2.(1)在6Li 、7Li 、23Na 、24Mg 、14C 、14N 六种粒子中,包含___5___种元素,___6_____种核素,其中互为同位素的是____6Li 与7Li____,中子数相等的核素是_____23Na 与24Mg_____。
(2)D 3O +中的质子数为____11____,电子数为___10_____,中子数为____11____。
※常考题例1.下列说法正确的是( ) BA .235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变 9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N AB .3517Cl 与3717Cl 得电子能力相同C .中子数为146、质子数为92 的铀(U)原子:146 92UD .235 92U 和238 92U 是中子数不同,质子数相同的同种核素例2.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。
第一章原子結構與性質第一節原子結構一. 物質結的本質“原子”一詞源自古希臘,希臘語中ATOM是不可再分的意思,古希臘哲學家認為原子是世間萬物最小的粒子◦直到1808年,英國人道爾頓把物質由原組成的概念作出重大修訂,他認為物質是由不同的微細粒子所組成,而在化學反應中,反應物的粒子並沒有改變,它們只是重新排列形成生成物,這個想法在當時己透過實驗得以証實◦道爾頓原子學說道爾頓原子學說的要點如下:1.所有元素都是由微細和不能再被分割的粒子組成,這些粒子稱為原子◦2.原子既不能被製造,也不能被毀滅◦3.同一種元素的原子,它們的質量和化學性質完全相同◦4.不同元素的原子,它們的質量和化學性質都完全不同◦5.當不同元素的原子結合時,便形成化合物,化合物中,各種原子的數目成一個簡單的整數比◦到了十九世紀末,實驗証據顯示,原子的結構遠較道爾頓所想的複雜,當時的科學家透過很多實驗証明,原子並非僅僅是一個堅硬而均勻的粒子,而是由幾種次原子粒子所構成◦1.質子:原子核的組成部分,帶正電的小微粒,一個質子帶個單位的電荷。
2.中子:原子核的組成部分,不帶電的小微粒。
3.電子:原子的組成部分,位於原子的週邊,帶負電的小微粒。
4.質量數:將原子核內所有的質子和中子的相對質量取近似整數值加起來,所得的值。
質量數(A)=(Z)+(N)5.同位素在同一種元素的原子中,當中有一些質子數目相同(即相同的原子序),但其中子數目並不相同(即不同質量數),這些原子稱為同位素。
例如:氯(Cl)的兩種同位素可寫成:豐度(自然界中的原子含量)的計算:一種元素的相對子原子質量是指該元素的各種同位素在碳-12標度上的相對同位素質量的平均值。
由於35Cl 和37Cl 的相對豐度分別是75.77和24.23,因此氯的相對原子質量可由以下的簡單計算中求得:則銅的相對原子質量為:.例1 已知自然界氧的同位素有16O ,17O ,18O ,氫的同位素有H ,D 。