必修二 第一章第一节 原子结构
- 格式:ppt
- 大小:4.03 MB
- 文档页数:43

第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。

必修2第1章原子结构与元素周期律第1讲原子结构、元素周期表[考纲要求]1、了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
2、了解元素、核素、同位素的含义。
3.了解原子核外电子的排布。
了解原子结构示意图的表示方法。
4、了解元素周期表(长式)的结构(周期、族)及其应用。
知识点一 原子的构成 1.原子 (1)原子结构原子(AZ X)⎩⎪⎨⎪⎧⎩⎨⎧质子(Z )个中子(A —Z )个 (Z )个2.核素、同位素、元素 概念①核素:具有一定数目________和一定数目________的一种________, 如氢元素有三种核素符号为____________________。
②同位素:________相同而________不同的同一元素的不同________互称同位素。
③元素:具有相同____________的同一类__________的总称。
知识点二 核外电子排布1.电子层的表示方法及能量变化电子层数 由内向外 数字表示法 1 2 3 4 5 6 7 字母表示法离核远近 ――→由 到 电子能量 ――→由 到2.(1)能量最低原理:核外电子总是尽可能先排布在能量________的(离原子核________)的电子层里。
(2)每层最多容纳的电子数为______个。
最外层电子数最多不超过____个(K 层为最外层时不超过____个),次外层电子数最多不超过____个,倒数第三层电子数最多不超过____个。
知识点三 元素周期表 1、编排原则:①把 相同的元素按 递增顺序从左到右排成一横行,共有 个横行。
②把不同横行中相同的元素按递增的顺序从上到下排成一纵行,共有纵行。
2、元素周期表的结构短周期长周期不完全周期序号 1 2 3 4 5 6 7元素种数最多容纳32种元素,目前排了26种元素0族元素原子序数86 ------(2)族主族列序 1 2 13 14 15 16 17族序号副族列序 3 4 5 6 7 11 12族序号第Ⅷ族第________共3列0族第________列(1)过渡元素:元素周期表中部从________族到________族10个纵列共六十多种元素,这些元素都是金属元素。
《原子结构》第二课时教学设计原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
1926年,量子力学推翻了玻尔的氢原子模型,指出一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
概率密度:P表示电子在某处出现的概率;V表示该处的体积;求真务实、不断进步的科学精神与社会责任感。
讲授新课第一节原子结构第二课时电子云与原子轨道、泡利原理、洪特规则、能力最低原理一、电子云【问题】图1-7 中的小点是什么呢?是电子吗?小点是1s电子在原子核外出现的概率密度的形象描述。
小点越密,表明概率密度越大。
由于核外电子的概率密度分布看起来像一片云雾,因而被形象的称作“电子云”。
1.电子云概念电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
电子在原子核外一定空间范围内出现的概率统计起来,好似在原子核外笼罩着一团带负电的云雾,形象称为“电子云”。
2.电子云轮廓图电子云图很难绘制,使用不便,我们常使用电子云轮廓图。
为了表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
把电子在原子核外空间出现概率P=90%的空间圈出来,即电子云轮廓图。
【过渡】所有原子的任意能层的s电子的电子云轮廓图都思考认识核外电子的运动特点。
知道电子的运动状态(空间分布及能量)。
是一个球形,只是球的半径不同。
同一原子的能层越高,s 电子云半径越大,是由于电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
就像宇宙飞船必须提供能量推动才能克服地球引力上天,2s电子比1s电子能量高,克服原子核的吸引在离核更远的空间出现的概率就比1s大,因而2s电子云必然比1s电子云更弥散。
二、原子轨道1.定义:电子在原子核外的一个空间运动状态称为一个原子轨道。
2.形状:(1)s电子的原子轨道呈球形,能层序数越大,原子轨道的半径越大。


高中化学必修二知识点大全高中化学必修2知识点归纳总结第一章物质结构、元素周期律一、原子结构原子由质子、中子和电子组成。
其中,质子数量决定了元素的种类,中子数量则决定了同一元素不同核素的存在,而电子则决定了元素的化学性质。
原子序数等于核电荷数等于质子数,也等于核外电子数。
电子按照能量最低的原则排布在不同的电子层中,每个电子层最多容纳2n个电子,最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
二、元素周期表元素周期表是按照原子序数递增的顺序,将元素按照电子层数和最外层电子数的不同排列而成的表格。
周期数等于元素最外层电子层数,主族序数等于元素最外层电子数。
元素周期表中,横行称为周期,纵列称为族,共有7个主族和7个副族,以及三个Ⅷ族和一个零族。
周期表中的元素按照一定的规律排列,能够显示出元素的物理和化学性质的周期性变化。
例如,同一周期内的元素具有相似的电子结构和化学性质,而同一族内的元素具有相同的最外层电子结构和化学性质。
三、元素周期律元素周期律是指元素周期表中元素物理和化学性质的周期性变化规律。
元素周期律包括原子半径、电子亲和能、电离能、电负性等物理和化学性质的周期性变化。
例如,原子半径随着周期数的增加而逐渐减小,而同一周期内原子半径随着原子序数的增加而逐渐减小。
电子亲和能和电离能则相反,随着周期数的增加而逐渐增大,而同一周期内电子亲和能和电离能随着原子序数的增加而逐渐减小。
掌握元素周期律可以帮助我们预测元素的物理和化学性质,从而更好地理解和应用化学知识。
元素周期律是指元素的性质随着核电荷数的递增而呈现周期性变化的规律。
这些性质包括核外电子排布、原子半径、主要化合价、金属性和非金属性。
这种周期性变化实际上是元素原子核外电子排布周期性变化的必然结果。
同一周期内的元素性质也存在递变规律。
以第三周期元素为例,它们的电子排布和原子半径随着核电荷数的增加而发生变化,而主要化合价则依次为+1、+2、+3、-4、+5、-3、+6、-2、+7和-1.此外,金属性和非金属性、单质与水或酸置换、氢化物的化学式、与H2化合的难易、氢化物的稳定性、最高价氧化物的化学式、酸碱性以及变化规律等方面也存在一定的变化规律。


1、据报道,某些花岗岩会产生氡(22286Rn),从而对人体产生伤害。
请回答:(1)该原子的质量数是,质子数是,中子数是。
(2)请补全Rn的原子结构示意图(3)请根据Rn的原子结构预测,氡气的化学性质()A.非常活泼,容易与氧气等非金属单质反应B.比较活泼,能与钠等金属反应C.不太活泼,与氮气性质相似D.很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn,故称22286Rn为镭射气;钍能蜕变为22086Rn,故将22086Rn称为钍射气;锕能蜕变为21986Rn,故将21986Rn称为锕射气。
22286Rn、21986Rn是()A.同种元素B.同位素C.同种核素D.同种原子由此可见,决定元素种类,质子数和决定核素种类。
2、请利用原子结构的知识解释下列事实(1)在硫化钠中,钠元素显+1价,硫元素显-2价(2)钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表ag jb c f i l me h kd(1)表中所列元素中:属于短周期元素的有________________________________,属于主族元素的有____________________,e元素在周期表中的位置是_________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体A.b,c,iB.a,g,kC.c,g,lD.d,e,f(3)将元素a,b,c,f,l的原子半径按从小到大的顺序排列:_______________________ (4)i元素属于___________元素,它的最高化合价是____________,最低化合价是_______。
它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出i 的单质与氧气反应的化学方程式:___________________________________________。
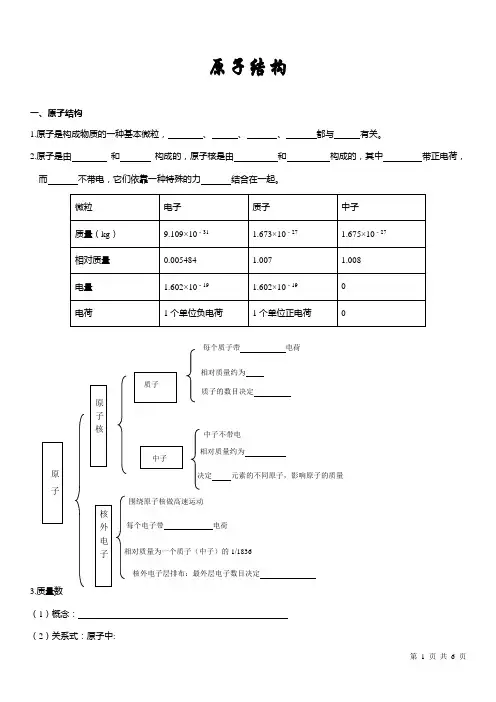
原子结构一、原子结构1.原子是构成物质的一种基本微粒,、、、都与有关。
2.原子是由和构成的,原子核是由和构成的,其中带正电荷,而不带电,它们依靠一种特殊的力结合在一起。
3.质量数(1)概念:(2)关系式:原子中:相对质量约为质子的数目决定中子不带电相对质量约为决定元素的不同原子,影响原子的质量围绕原子核做高速运动每个电子带电荷相对质量为一个质子(中子)的1/1836核外电子层排布:最外层电子数目决定每个质子带电荷核电荷数(Z )= =质量数(A )= ( )+ ( ) 4.原子结构的表示方法:AZX【思考】①阳离子中A Z X n +:核外电子数=质量数(A )= + ②阴离子中A Z X m -:核外电子数= 质量数= + 二、元素、核素、同位素1.元素是 , 元素的种类由 决定。
填写下表并思考:①分别写出氕、氘、氚的原子符号表达式:氕 氘 氚 ②氕、氘、氚的原子结构有什么异同?它们是同一种元素吗?它们是同一种原子吗? ③原子核都是由质子和中子组成的吗?2.核素: 。
几种常见的核素(写出相应的核素符号)氢 ,碳 ,氧 ,氯 ,铀目前已经发现了112种元素,是否表示发现了112种原子?理由是什么?3.同位素: 。
它分为和两种,放射性同位素最常见的应用是制造氢弹原料的是,制造原子弹和核反应堆燃料的是。
三、核外电子排布1.核外电子运动的特征2.核外电子的分层排布看表2总结每层最多可以排布的电子数目?元素的性质与元素原子的最外层电子排布的关系(1)稀有气体原子最外层电子数为8(氦除外),结构稳定,性质;金属原子最外层电子数一般少于4个,易电子;表现性;非金属原子最外层电子数4个,较易获得电子,表现性。
(2)化合价是的一种重要性质。
元素化合价的数值,与特别是有关。
题型一:有关原子结构、元素、核素、同位素练习题例1.对于A Z X 和A+1Z X+ 两种粒子,下列叙述正确的是( ) A .质子数一定相同,质量数和中子数一定不同 B .化学性质几乎相同C .一定都由质子、中子、电子构成D .核电荷数,核外电子数一定相同 例2.、、、H +、H 2是 可以表示为 ( )。

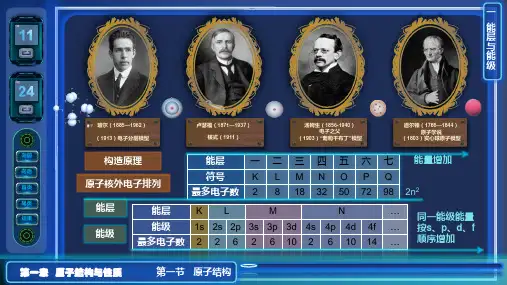
第一章原子结构与性质第一节原子结构一、能层与能级1.能层(1)核外电子按能量不同分成能层并用符号K、L、M、N、O、P、Q…表示。
(2)能层越高,电子的能量越高,能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
2.能级(1)定义:根据多电子原子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为n s、n p、n d、n f等。
(3)能层、能级与最多容纳的电子数由上表可知:①能层序数等于该能层所包含的能级数,如第三能层有3个能级。
② s、p、d、f 各能级可容纳的电子数分别为1、3、5、7的2倍。
③原子核外电子的每一能层最多可容纳的电子数与能层的序数(n)间存在的关系是2n2。
【注】(1)不同能层之间,符号相同的能级的能量随着能层数的递增而增大。
(2)在相同能层各能级能量由低到高的顺序是n s<n p<n d<n f。
(3)不同能层中同一能级,能层数越大,能量越高。
例如:1s<2s<3s<4s……二、基态与激发态原子光谱1.基态原子与激发态原子(1)基态原子:处于最低能量状态的原子。
(2)激发态原子:基态原子吸收能量,电子会跃迁到较高能级,变为激发态原子。
(3)基态、激发态相互间转化的能量变化吸收能量激发态原子。
基态原子释放能量,主要形式为光2.光谱(1)原子光谱不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱。
(2)原子光谱的成因及分类(3)光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【注】(1)电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量;反之,将吸收能量。
光(辐射)是电子释放能量的重要形式之一。
(2)电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。