严重ADR病例分析精品文档52页
- 格式:ppt
- 大小:187.50 KB
- 文档页数:52

我院100例严重药品不良反应报告分析摘要】目的了解我院严重药品不良反应(ADR)的情况,为临床用药以供参考。
方法对我院统计分析。
结果严重ADR的发生与性别无关;50岁以上患者发生率较高(40例);口服给药发生率最高(54例);100例严重ADR共涉及10大类药品124种药品;其中解热镇痛抗炎抗风湿药最高(22例);严重ADR累及器官或系统以泌尿系损害最多(18例);100例严重ADR中好转77例,有后遗症23例;100例严重ADR中不合理用药的共计57例。
结论严重ADR的发生与多种因素有关,其中不合理用药因素不能忽视,应大力宣传药品ADR相关知识,促进合理用药。
【关键词】严重药品不良反应合理用药分析随着人们对药品不良反应(ADR)认识的深入,及自身保健意识的加强,我院药品不良反应上报数量逐年增高,尤其是严重的ADR,不仅对患者健康不利,还有可能危及生命,造成医疗事故。
2007年我院正式成立药品ADR领导小组,负责收集上报药品ADR。
本文对我院100例严重ADR报告进行回顾性分析,为临床提供参考,避免ADR蔓延。
1 资料来源与方法1.1 资料来源收集2008-2010年我院上报至国家ADR监测中心的所有报告,对其中的严重ADR进行数据分析。
1.2 方法对100例ADR报告按照上报科室、患者基本情况、既往及家族ADR史、合并用药情况、给药途径、药品种类、ADR累及器官或系统及用药和理性进行统计分析。
2 结果2.1 上报严重ADR的来源我院严重ADR是各科室主动上报的,具体来源见表1。
2.2发生严重ADR患者的性别与年龄分布男性47例,女性53例。
年龄最小2岁,最大79岁,各年龄均有分布。
50岁以上的共40例。
2.3给药途径及合理用药情况100例严重ADR中,口服54例,静脉滴注44例,吸入2例。
其中存在不合理用药的共57例,一部分是院外患者自行服用40例,另一部分是医生开具药物不合理共17例。
表1 严重ADR报告来源分布表2 引起严重ADR的药品种类2.4 ADR转归及对原患疾病的影响100例严重ADR中好转77例,有后遗症23例;对原患疾病的影响中,使病程延长5例,有后遗症23例,不明显72例。




糖皮质激素病例分析【参考模板】病案:某女,52岁,患支气管哮喘20余年。
依赖糖皮质激素10余年。
泼尼松用量最多时为15mg,每日4次;最少时为10mg,每日两次。
就诊时仍按此量服用。
患者自述年轻时身材苗条,得病以后逐渐发胖。
体重110kg ,血压160/110mmHg,满月脸,面、背部及上唇毛发粗厚,腹、臀及双大腿有紫纹,双肺可闻及哮鸣音,尿常规有微量蛋白。
诊断:支气管哮喘;类Cushing综合征。
治疗:二丙酸氯地米松气雾吸入:400μg泼尼松龙:15mg,gd治疗二个月,哮喘基本控制,体重下降15kg。
将泼尼松龙用量降至10mg,每日一次,二丙酸氯地米松继续按原量吸入。
又经一月,体重降至90kg ,哮喘偶有发作,于发作时加服泼尼松龙5mg 即可控制症状。
后将泼尼松龙改为15mg ,隔日一次,二丙酸氯地米松继续吸入。
一个月后,到某医院就诊,该院医生不了解将泼尼松改为隔日疗法用意,认为集中给药不利于保持血中药物有效浓度,将泼尼松改为10mg,每日3次患者第三次就诊时体重增至100kg以上。
第四次就诊时因严重阻塞性睡眠呼吸暂停综合征住院,泼尼松龙用量为每日40mg左右,必要时加服5mg ,血糖明显升高,精神状态不佳,于一日夜间突然死亡。
尸检全身脏器满布大小不等的脓肿,脓肿内菌培养为白色念珠菌感染。
诊断 1. 白色念珠菌败血症2. 双恻肾上腺皮质萎缩3. 类Cushing综合征分析此病例中糖皮质激素使用对病人带来的影响,临床中如何正确使用糖皮质激素?分析:1. 脂肪代谢异常,向心性肥大(满月脸,面、背部及上唇毛发粗厚,肺可闻及哮鸣音”):长期使用糖皮质激素可增加血浆胆固醇,增加血浆胆固醇,激活四肢皮下的酯酶,还能使脂肪重新分布与面部、胸、背及臀部,形成向心性肥大。
紫纹的形状为中央宽、两端细,呈紫红或淡红色,常为对称性分布。
而紫纹和呼吸不顺都是因为过度肥胖所引起的。
2. 蛋白质代谢异常(尿常规有微量蛋白,腹、臀及双大腿有紫纹):加速组织蛋白质分解代谢,造成尿中氮的排泄增加,造成负氮平衡。

我院182例不良反应报告分析1. 背景药物不良反应(ADR)是指在正常剂量下使用药物时引起的不良药理学效应,它可能发生在药品首次使用或治疗过程中。
由于药物不良反应的发生率、严重程度和强度均不一,因此其对患者健康的影响也不相同。
我院定期对患者使用药品期间出现的ADR情况进行分析和报告,以保障患者的用药安全。
2. 方法在我院对患者使用药品期间进行ADR的报告和记录中,筛选出182例ADR出现的患者,包括男性与女性,年龄范围从18岁到76岁不等,使用的药品涉及抗生素、镇痛药、维生素、镇静剂、抗癌药等多个种类。
对这182例ADR发生的原因、药品类型、反应症状、患者性别、年龄段等信息进行整合,并进行统计分析。
3. 结果3.1 ADR发生原因对182例ADR的发生原因进行整理,其中药品的不良反应为绝大部分的原因,为72.5%;药品与其他因素共同作用的比例为15.9%;而14.1%的ADR原因尚未明确。
3.2 药品类型在182例ADR中,使用最多的药品种类为抗生素,占比22.5%;其次是镇痛药,占比17.5%;维生素类药品占比10.4%;其余的包括镇静剂、抗癌药、秦始皇等多个种类,占比均在10%以下。
3.3 反应症状对182例ADR的反应症状进行汇总,主要表现为皮肤过敏反应,占比29.1%,其次为发热,占比14.8%;其余包括恶心、呕吐、腹泻、脱发等多个种类,占比均在10%以下。
3.4 患者性别和年龄在182例ADR中,男性患者占比45.6%,女性患者占比54.4%。
在不同年龄段中,20-29岁年龄段出现ADR的患者最多,占比为18.7%,其次是30-39岁年龄段的患者,占比为16.5%。
4. 讨论根据本次我们对我院182例ADR进行的统计分析,我们可以看出,药物的不良反应是ADR的主要原因。
此外,我们还观察到,抗生素和镇痛药的ADR占比较高,注意到这两类药的不良反应将会对患者造成较大的危害。
关于这两类药的应用,临床医生应加强对药品类型的选择和使用适当的剂量,以减少ADR的发生率。

ADR典型病例分析引言不良药物反应(ADR)是指在正常剂量范围内使用药物引起的不希望发生的不良反应。
ADR在临床实践中难免会出现,对患者的健康和生活质量造成一定的影响。
本文将通过一个典型病例分析,探讨ADR 的产生原因、识别和管理的方法,以及应对ADR所需的联合工作和倡导。
病例背景一名43岁女性患者,在患有类风湿性关节炎的情况下,因关节疼痛和炎症严重而就诊。
经过医生严密观察和综合分析,决定给予她常用的非甾体类抗炎药(NSAIDs)布洛芬。
病例分析起初,患者对布洛芬治疗的效果感到满意,关节疼痛明显减轻,并且没有出现其他不良反应。
然而,使用一段时间后,患者开始出现胃痛、恶心、呕吐等症状。
她意识到这些反应可能与布洛芬有关,并立即咨询了医生。
ADR识别与原因分析针对患者的症状,医生首先怀疑这些症状是布洛芬引起的胃黏膜损伤导致的胃肠不适。
这是常见的NSAIDs的不良反应之一,挤压了食道中的胃酸分泌,造成胃酸增加。
而胃黏膜受损后,胃痛、恶心和呕吐等症状就会出现。
ADR管理与应对为了管理患者的ADR,医生采取了多种方法:1.停用布洛芬:医生立即停用了布洛芬,以避免进一步损害患者的胃黏膜。
2.替换药物:鉴于患者对布洛芬的不良反应,医生选择了其他非甾体类抗炎药,如酮酸类药物,以继续治疗患者的关节炎,同时避免胃黏膜损伤。
3.辅助治疗:医生还建议患者使用胃药治疗,以减轻胃酸分泌和修复胃黏膜,以便更好地应对胃肠不适。
4.监测和随访:在ADR管理的过程中,医生建议密切监测患者的症状和反应,定期进行随访,以确保患者的症状得到缓解,并根据需要进行调整。
ADR的联合工作和倡导ADR管理需要医生、患者和医药产业的联合工作和倡导。
医生在开药时应全面评估患者的病史、过敏史和用药史,并根据个体情况选择适当的药物。
医生还应向患者提供必要的用药指导,包括药物的使用方法、剂量以及不良反应的可能性等信息。
患者在使用药物期间要密切关注自己的身体反应,并及时向医生汇报任何不寻常的症状。

药物不良反应报告57例分析摘要】目的:分析药物不良反应(ADRs)的相关因素,为临床合理安全的使用药物、减少药源性疾病的发生提供参考。
方法:用回顾性分析方法对我院2008年1月~2012年6月收集的ADRs病例报告情况进行分析。
结果:57例ADRs中以抗菌药物引发的ADRs居首位(19例次,33.3%),中药制剂占第2位(10例次,17.5%)。
中枢神经系统药物占第3位(7例,12.3%);ADRs受累的器官/系统中皮肤及附件的损害居首位(50.9%)。
结论:应加强ADR报告和监测方面的教育和培训,扩大报告监测的覆盖面,提高用药安全。
【关键词】不良反应药物监测【中图分类号】R952【文献标识码】A【文章编号】2095-1752(2013)02-0109-02药品不良反应(ADRs)是指药物在预防、诊断或治疗疾病过程中出现的任何有害、非期望的反应。
目前,ADRs已成为临床治疗用药应考虑的一个重要因素。
为进一步探讨ADRs的一般规律和特点,以便对临床用药有所启示,对我单位2008年1月~2012年6月收集的57例药品不良反应病例分析报告如下。
1、资料与方法1.1 一般资料 2008年1月~2012年6月我单位在日常工作中发现并收集上报的ADRs病例57例。
根据患者的原患疾病、产生ADRs类型、所使用的药品种类和剂型,用回顾性分析方法进行分析。
1.2 方法根据我院上报的ADRs报告表,详细查看患者的门诊病历,记录患者的有关资料,用药情况,ADRs的临床表现,同时到临床科室查看患者,监测至症状减轻或消失,然后对患者的临床资料归纳整理,对ADRs结果及关联性评价进行评估。
1.3 评定标准有明确记录的相关用药史;ADRs临床表现及实验室检查异常与所用药物有关的因果关系、关联性评价、强度分级按卫生部ADRs监测中心指定的原则和标准进行评判。
出现ADRs后,再次使用同样药物又出现同样的症状者,视为“肯定”;未再使用者视为“很可能”,以此两项确定药物不良反应。

中国药物警戒第8卷第10期2011年10月October,2011,Vol.8,No.1089例严重药品不良反应/事件报告分析范平平(大连市药品不良反应监测中心,辽宁大连116021)中图分类号:R994.11文献标识码:A 文章编号:1672-8629(2011)10-0624-03作者简介:范平平,女,药品不良反应监测。
药品严重不良反应,是指因服用药品引起以下损害情形之一的反应:①引起死亡;②致畸、致癌、致出生缺陷;③对生命有危险并能够导致人体永久的或显著的伤残;④对器官功能产生永久损伤;⑤导致住院或住院时间延长。
(本文中所指的严重病例报告包括药品严重不良反应报告、新的严重的药品不良反应报告。
)患者若发生严重药品不良反应,一般不能单纯通过停药而得以缓解,需要采取一系列治疗措施。
严重药品不良反应对患者生理及心理上都将造成较为严重的损害,有些损害甚至不可逆转。
因此,在我国医药产业迅速发展,由药品本身的不良反应所造成的风险与矛盾日益凸显的今天,对严重药品不良反应的监测便成了监测工作的重中之重。
本文将对大连市药品不良反应监测中心2008年1月至2010年4月收集到的89例严重药品不良反应/事件(ADR/ADE )进行统计分析,探讨严重ADR/ADE 发生的特点、一般规律及处理措施,为尽量避免严重药品不良反应,提高临床用药安全性提供参考。
1资料与方法在全国药品不良反应监测网络的数据库中,登录大连市的31个基层用户(12个监测站及19个市管医疗机构),检索2008年1月至2010年4月上报的严重的及新的严重的不良反应报告,按照药品通用名称、剂量、用药途径、不良反应名称、过程描述等19项导出,生成Excel 表,并统计分类、综合分析。
2结果2.1严重的与新的ADR /ADE 分布89例严重ADR/ADE 中,新的严重的报告34例,占38.2%;严重的报告55例,占61.8%。
2.2性别与年龄分布89例严重ADR/ADE 中,女性患者57例,占64.0%;男性患者42例,占36.0%。

药品不良反应/事件报告表报告基本信息首次/跟踪报告:首次报告编码: **************报告类型:新的一般报告单位类别:医疗机构患者基本信息患者姓名: *** 性别:女民族:汉族出生年月:1971-03-29 年龄:40 岁体重:56 (公斤)联系方式:*******原患疾病:女性慢性盆腔炎医院名称:************ 病历号/门诊号:12070208既往药品不良反应/事件:无家族药品不良反应/事件:无相关重要信息:怀疑用药序号批准文号商品名称通用名称生产厂家生产批号用法用量给药途径用药起止时间用药原因1 国药准字H20046286注射用头孢米诺钠剂型:注射剂广东博洲药业有限公司120312011.5 克/1日 1次静脉滴注从2011-07-02到2011-07-02抗菌治疗并用药品序号批准文号商品名称通用名称生产厂家生产批号用法用量给药途径用药起止时间用药原因1 国药准字H20023822氯化钠注射液剂型:注射剂石家庄鹏海制药有限公司1205302090250毫升/1日1次静脉注射从2011-07-02到2011-07-05溶媒用药2 国药准字H20060399奥硝唑氯化钠注射液剂型:注射剂四川科伦药业有股份有限公司W1120107010.5克/1日1次静脉滴注从2011-07-02到2011-07-05抗菌治疗3 国药准字H13022062葡萄糖注射液剂型:注射剂石家庄鹏海制药有限公司1204112040250毫升/1日1次静脉滴注从2011-07-02到2011-07-05溶媒用药4 国药准字H20057257酚磺乙胺注射液剂型:注射剂天津药业焦作有限公司120104213克/1日1次静脉滴注从2011-07-02到2011-07-05促进凝血5 国药准字H32024038氨甲苯酸注射液剂型:注射剂扬州制药有限公司201204030.3克/1日1次静脉滴注从2011-07-02到2011-07-05促进凝血6 国药准字H51023908维生素C注射液剂型:注射剂乐山三九长征药业股份有限公司201404093克/1日1次静脉滴注从2011-07-02到2011-07-05促进凝血不良反应/事件详细信息不良反应/事件名称:过敏反应(一般)不良反应/事件发生时间:2011-07-02不良反应/事件过程描述:患者因白带多,下腹胀痛3+年,加重伴白带有血丝1个月于2012年7月2日10:10入院,体温:36.7℃,心率:78次,呼吸频率:20次,血压:118/70mmHg.血红蛋白(Hbg):127g/L,红细胞(RBC):4.05*10^12/L,白细胞(WBC):6.2*10^9/L,血小板计数:127*10^9/L,血小板平均容积(MPV):11.2fl,血小板分布宽度(PDW):15.1%.阴道内可见大量脓性分泌物,宫颈口可见纳氏囊肿,颈管内息肉,阴道B超:左附件囊性占位,以1慢性盆腔炎2左附件囊肿3慢性宫颈炎(纳囊,息肉)收治,原患疾病慢性盆腔炎。
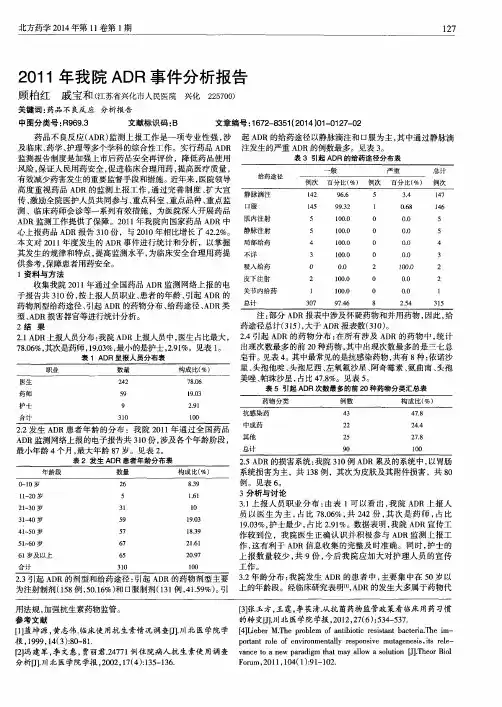
我院2011年新的、严重的药品不良反应报告分析药品不良反应(ADR)是指为了预防、诊断、治疗疾病或改变人体的生理功能,人在正常用法、用量下服用药品所出现的不期望的有害效应。
它已日益受到人们的关注。
通过对我院2011年1月至12月收集到的100例ADR进行回顾性分析,对其中22例药品新的、严重的不良反应进行报告,了解我院药品不良反应发生的特点及规律,为临床合理用药提供参考,促进临床合理用药。
1 资料与方法我院2011年1月至12月期间,共收集到100例ADR报告,其中新的、严重的不良反应22例,按患者性别、年龄、药品种类、给药途径、ADR累及器官及临床表现等进行统计、分析。
10例新的不良反应8例严重的不良反应4例新的及严重的不良反应2 结果3 讨论3.1 药品新的、严重的不良反应中,男性8例,女性14例,男女比例为1:1.75,女性ADR的发生率高于男性,可能由于女性的激素水平、基础代谢率、胃肠蠕动、分泌能力等生理方面的因素对ADR存在影响。
≤18岁的比例占9.09%,≥60岁的占45.45%,这可能与此两个年龄段的患者免疫应答能力较弱有关。
3.2对22例药品新的、严重的不良反应的用药途径进行分析,静脉滴注用药的不良发生率明显高于其他途径,说明静脉用药比非静脉用药更易引发ADR,但也有可能静脉用药是在医院内进行,便于医务人员观察、及时发现。
应加强注射剂的使用管理,能口服用药的尽量不要注射用药,能肌肉注射的尽量不要静脉滴注。
3.3 2011年22例药品新的、严重的不良反应中,抗菌药引起的不良反应,占ADR总例数的36.36%,这与抗菌药应用范围广、使用频率高以及未能严格掌握适应症、剂量、疗程等有关。
但较2010年所占比例有所减少。
由此可见,应继续严格加强抗菌药物的合理使用与管理,严格执行抗菌药物的三级管理制度,降低因抗菌药物引起的ADR的发生率。
3.4中药注射剂引发的ADR有7个品种8例,占总例数的36.36%。
某院药品不良反应(ADR)中高危药品引起的ADR问题分析郑志恒;康丹红;高健【摘要】目的探讨我院药品不良反应(ADR)中高危药品引起的ADR问题.方法在我院2016年10月至2017年10月收治的128例ADR患者的临床资料进行研究,对128例ADR患者的年龄层、各症状类型进行回顾性分析,重点探讨引发ADR的主要高危药品种类、其症状表现以及分布科室等临床资料.结果药品引发的ADR 问题与患者的年龄有关、高危药品引发的ADR发生率要高于普通药品.结论医院应增肌医护人员的临床合理用药的培训学习机会,强化高危药的ADR监管力度,健全药品用药说明书,指导患者安全用药.【期刊名称】《中国医药指南》【年(卷),期】2019(017)019【总页数】2页(P127-128)【关键词】高危药品;ADR;药品监管【作者】郑志恒;康丹红;高健【作者单位】丹东市第一医院药学部,辽宁丹东 118000;丹东市第一医院药学部,辽宁丹东 118000;丹东市第一医院药学部,辽宁丹东 118000【正文语种】中文【中图分类】R969.3高危药品指的是药效快速明显,当使用不善时会对人体产生严重危害甚至导致死亡药品为高危药品,其中包含了肌肉松弛剂、高浓度电解质制剂、细胞毒类等药物[1]。
我国药物学会医院药学专业委员会根据高危药品等级管理编制了《高危药品分级管理策略及推荐目录》[2],将高危药品划分为了A、B、C等级。
高危药品管理中的最高等级为A等级,对患者会极高的死亡风险;而B级的风险等级要低于A级;C级的风险等级低于B级,而中药注射剂的风险管理等级就属于C级[3]。
增强高危药品引起的ADR的监管工作,是提高医院安全以及医疗质量的主要方式之一,这也是保障患者生命健康的主要对策。
因此,为探讨我院药品不良反应(ADR)中高危药品引起的ADR问题,本文选取了我院2016年10月至2017年10月收治的128例ADR患者的临床资料进行研究,报道如下。
目录中文摘要 (1)英文摘要 (3)前言 (5)第一部分药品不良反应严重程度分级及评分标准的制定 (6)第二部分严重程度分级评分在7605例ADR报告中的应用及评估 (11)第三部分用三种指数对40种药品ADR进行危害程度的分析 (30)第四部分讨论 (40)参考文献 (45)致谢 (48)附录 (49)综述 (74)中文摘要目的:1、结合药品不良反应严重程度分级标准和疾病严重程度评分系统,制定药品不良反应严重程度分级评分标准。
2、在药品不良反应例数分析的基础上对药品不良反应报告进行严重程度分析,为临床提供合理信息。
3、通过分析结果证明用药品不良反应严重程度加权平均后排序分析药品不良反应严重程度的可行性。
4、通过不良反应报告的集中分析,发现严重不良反应。
5、综合药品不良反应例数、严重程度和发生率,分析不良反应危害程度。
方法:通过对7605条药品不良反应严重程度评分,按药品分类,考虑药品不良反应发生例数和药品不良反应严重程度两个影响药品不良反应分析的因素,采用四种不同的方法对7605份药品不良反应进行统计,并加以比较分析;通过分析提出药品不良反应严重程度指数的概念和算法,并验证用其分析药品不良反应严重程度的可行性和临床意义。
在7605例不良反应涉及的994种药品中随机抽取40种,结合不良反应例数、严重程度和发生率采用三种方法分析不良反应危害程度。
结果:1、引起药品不良反应的药品按药理学分类,以发生例数排序,结果是β-内酰胺类抗生素(2298例),喹诺酮类、磺胺类与其他合成抗菌药物(928例),中药(837例)。
2、将药品不良反应报告按严重程度评分,再计算每一类药严重程度指数排序,前3位依次是性激素类与避孕药(2.278),抗结核病药与抗麻风病药(2.164),抗癫痫药和抗惊厥药(2.040)。
3、将药品不良反应报告按所用药品的制剂通用名分类,按不良反应报告例数进行统计并排序,前3位依次是左氧氟沙星注射液(370例),注射用头孢噻肟钠(328例), 注射用青霉素钠(305例)。
.不良反应.2010年我院159例药品不良反应病例报告分析药物名称剂型ADR表现抗感染药——青霉素类阿莫西林胶囊躯干、四肢红斑伴瘙痒阿莫西林胶囊弥漫性水肿性红斑!阿莫西林胶囊大疱表皮松解坏死型药疹阿莫西林胶囊红斑、瘙痒阿莫西林胶囊面部,胸上部,四肢潮红,肿胀伴针刺感抗感染药——头孢菌素类头孢氨苄片剂红斑-丘疹,紫癜样皮疹,伴瘙痒头孢氨苄片剂瘀斑样皮疹!头孢氨苄片剂大疱型表皮松解坏死型药疹头孢氨苄片剂红斑丘疹伴瘙痒头孢唑林钠注射剂皮疹头孢哌酮/舒巴坦钠注射剂皮疹头孢哌酮/舒巴坦钠注射剂荨麻疹型药疹头孢哌酮/舒巴坦钠注射剂发疹型药疹头孢哌酮/舒巴坦钠(4)注射剂便菌群比例失调头孢哌酮/舒巴坦钠注射剂排便次数增多头孢哌酮/舒巴坦钠注射剂红色粟粒样疹头孢哌酮/舒巴坦钠注射剂真菌感染头孢哌酮/舒巴坦钠注射剂白细胞及中性粒细胞下降头孢哌酮/舒巴坦钠注射剂腹泻氯唑西林注射剂头颈上肢对称性红斑丘疹伴瘙痒氯唑西林注射剂红斑,斑丘疹头孢曲松钠注射剂头痛,头晕头孢曲松钠注射剂红斑、丘疹头孢曲松钠注射剂红斑,丘疹伴瘙痒头孢曲松钠注射剂白细胞减少及中性粒细胞减少头孢曲松钠注射剂皮疹头孢曲松钠注射剂红斑丘疹,面手足肿胀头孢曲松钠注射剂皮疹、肿胀伴瘙痒!头孢曲松钠注射剂大疱表皮松解型药疹头孢曲松钠注射剂水肿性红斑,部分融合成片头孢孟多注射剂药疹,药物热头孢孟多注射剂水肿性红色皮疹融合成片头孢替安注射剂肝功能酶学增高头孢他美酯片剂红疹、瘙痒头孢他美酯片剂胃灼热、腹胀、腹部不适头孢拉定胶囊红斑伴瘙痒头孢克肟胶囊红斑,瘙痒,双下肢轻微浮肿头孢吡肟注射剂红斑,丘疹抗感染药——氟喹诺酮类左氧氟沙星注射剂麻疹、猩红热样皮疹左氧氟沙星注射剂倦怠无力、面目肌肉抽搐!左氧氟沙星注射剂大疱表皮松解型药疹左氧氟沙星注射剂便菌群比例失调左氧氟沙星注射剂白细胞及中性粒细胞比例降低左氧氟沙星注射剂沿静脉走向胳膊红肿,痒,呼吸困难左氧氟沙星注射剂真菌感染左氧氟沙星注射剂恶心、呕吐、头晕、头痛左氧氟沙星注射剂失眠,头痛头晕,皮疹红斑左氧氟沙星胶囊双下肢红色丘疹伴瘙痒左氧氟沙星胶囊红斑丘疹伴瘙痒抗感染药——碳青霉烯类美罗培南注射剂大便菌群比例失调美罗培南注射剂粟粒样皮疹亚胺培南/西司他汀注射剂肠道菌群比例失调抗感染药——林可霉素类克林霉素注射剂红斑伴瘙痒,药物热抗感染药——万古霉素类替考拉宁注射剂血小板减少,周身瘀点、瘀斑万古霉素注射剂高热,心慌抗感染药——硝基咪唑类甲硝唑注射剂发疹型药疹人工牛黄甲硝唑胶囊胶囊荨麻疹样皮疹抗结核病药吡嗪酰胺胶囊高尿酸血症呼吸系统用药酮替芬片剂排尿困难布地奈德气雾剂口腔感染,溃疡茶碱缓释片片剂心悸多索茶碱注射剂心悸多索茶碱注射剂恶心、呕吐消化系统用药双歧杆菌乳杆菌三联活菌片片剂红斑,水肿,水疱,大疱奥美拉唑钠注射剂头痛奥美拉唑钠注射剂恶心、呕吐黄连素片剂阴囊水肿?柳氮磺吡啶片剂药疹兰索拉唑片剂恶心、呕吐、腹泻复方甘草酸苷片剂血压升高复方甘草酸单胺S 注射剂血压升高复方甘草酸单铵注射剂头痛、头晕复方甘草酸铵注射剂面部皮疹甘草酸二铵氯化钠注射剂皮疹甘草酸二铵氯化钠注射剂药物热,皮疹颠茄片剂斑疹,瘙痒消旋山莨菪碱(5)注射剂口干、视物不清解热镇痛药安痛定注射剂药疹,药物热!去痛片(2)片剂多形红斑型药疹复方氨酚烷胺胶囊多型红斑型药疹复方氨酚烷胺胶囊周身红斑伴瘙痒,口唇阴囊糜烂!感冒胶囊胶囊四肢水肿性红斑,大炮伴疼痛感冒胶囊胶囊周身潮红,小丘疹伴肿胀,脱屑!感冒胶囊胶囊多形性红斑药疹感冒胶囊胶囊麻疹,猩红热杨药疹感冒胶囊胶囊红斑丘疹伴瘙痒感冒胶囊胶囊药物性皮炎伴口腔糜烂扑热息痛片剂周身红斑,伴口周肿胀、糜烂!扑热息痛片剂多形性红斑药疹扑热息痛片剂周身潮红,肿胀伴瘙痒扑热息痛片剂红斑伴瘙痒扑热息痛片剂弥漫性红斑,药物热!扑热息痛片剂表皮松解型药疹!扑热息痛片剂周身红斑,浮肿,脱屑伴瘙痒扑热息痛片剂红斑丘疹伴瘙痒扑热息痛片剂双小腿肿痛,红斑瘙痒扑热息痛片剂手足红斑、斑丘疹伴瘙痒维C银翘片片剂药物性皮炎伴口腔糜烂萘丁美酮胶囊血压升高循环系统用药硝酸异山梨酯片片剂头痛单硝酸异山梨酯片剂头痛单硝酸异山梨酯氯化钠注射剂头痛氟桂利嗪胶囊精神抑郁桂哌齐特注射剂头痛、头晕!吲哒帕胺片剂多型红斑型药疹吲哒帕胺片剂红斑、斑丘疹伴瘙痒神经系统用药吡拉西坦注射液恶心,风团丁咯地尔片剂皮疹,血压不稳定奥卡西平片剂手足红斑、斑丘疹伴瘙痒卡马西平片剂周身红斑、瘙痒,面部浮肿,肝功能、心肌酶异常卡马西平片剂红色丘疹伴瘙痒卡马西平片剂红斑丘疹伴瘙痒多巴丝肼片剂腹泻咪达唑仑注射液血压下降血液系统用药氨甲环酸注射剂头颈部红色皮疹内分泌系统用药罗格列酮片剂胃肠道反应吡格列酮片剂心率加快,早搏诺和锐30 注射剂皮下硬结甲巯咪唑片剂全身关节疼痛甲巯咪唑片剂粟粒样皮疹!甲巯咪唑片剂肝功能实验值增高,白细胞及中性粒细胞下降甲巯咪唑片剂肝功能转氨酶升高甲巯咪唑片剂丘疹,瘙痒!别嘌醇片剂周身红斑水疱,口腔黏膜散在糜烂,结膜充血,阴囊及龟头包皮糜烂泌尿系统!呋塞米注射剂重性多形红斑型药疹!甘露醇注射剂肉眼血尿抗肿瘤药长春西汀注射剂过敏,浑身哆嗦卡铂注射剂血小板下降吉他西滨注射剂血小板下降奥沙利铂注射剂腹泻奥沙利铂注射剂药物热硼替佐米注射液红色斑丘疹伴瘙痒柔红霉素注射剂恶心,呕吐环磷酰胺注射剂肉眼血尿顺铂注射剂恶心、呕吐利妥昔单抗注射剂药物热免疫系统用药粒细胞刺激因子注射液骨痛沙利度胺片剂嗜睡、双手颤动强的松片剂面部潮红强的松片剂高血糖,高血压胸腺肽注射剂药物热皮肤科用药阿维A(10)胶囊血脂升高黑豆溜油软膏软膏丘疹伴瘙痒中药制剂抗病毒口服液口服液红斑、丘疹、瘙痒双黄连口服液皮疹,肿胀、瘙痒强筋健骨片片剂斑疹、斑丘疹伴瘙痒!芦荟胶囊大疱表皮松解型药疹丹红注射液注射剂血压下降!参麦注射液注射剂胸闷,呼吸困难,口唇紫绀注:“!”标识为严重不良反应的病例报告。