第六章 配合物的结构与性质
- 格式:ppt
- 大小:229.00 KB
- 文档页数:19



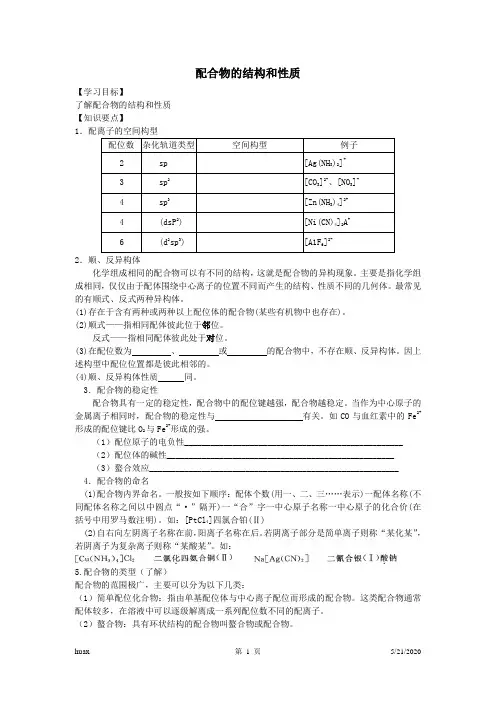
配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】1.配离子的空间构型配位数杂化轨道类型空间构型例子2 sp [Ag(NH3)2]+3 sp2[CO3]2-、[NO3]-4 sp3[Zn(NH3)4]2+4 (dsP2) [Ni(CN)4]2A+6 (d2sp3) [A1F6]2-2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位位置都是彼此相邻的。
(4)顺、反异构体性质同。
3.配合物的稳定性配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________(3)螯合效应_________________________________________________________4.配合物的命名(1)配合物内界命名。
一般按如下顺序:配体个数(用一、二、三……表示)一配体名称(不同配体名称之间以中圆点“·”隔开)一“合”字一中心原子名称一中心原子的化合价(在括号中用罗马数注明)。
如:[PtCl4]四氯合铂(Ⅱ)(2)自右向左阴离子名称在前,阳离子名称在后。
若阴离子部分是简单离子则称“某化某”,若阴离子为复杂离子则称“某酸某”。