注射用盐酸格拉司琼说明书
- 格式:doc
- 大小:27.00 KB
- 文档页数:2

核准日期:修改日期:盐酸帕洛诺司琼注射液说明书请仔细阅读说明书并在医师指导下使用。
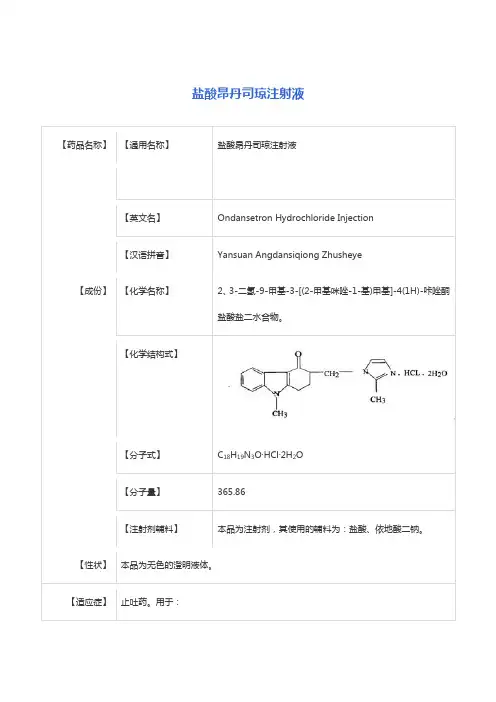
【药品名称】通用名称:盐酸帕洛诺司琼注射液商品名:阿洛西®/ Aloxi ®英文名称:Palonosetron Hydrochloride Injection汉语拼音:Yansuan Paluonuosiqiong Zhusheye【成份】本品的活性成份为盐酸帕洛诺司琼。
化学名称:2-[1-氮杂双环[2.2.2]辛-3S-基]-2,3,3aS,4,5,6-六氢-1H-苯并[de]异喹啉-1-酮盐酸盐。
化学结构式:.HClN OH分子式:C 19H 24N 2O∙HCl分子量:332.87本品辅料:甘露醇、依地酸二钠、枸橼酸钠、一水合枸橼酸、注射用水、用氢氧化钠和盐酸调节pH 值。
【性状】本品为无色澄明液体。
【适应症】本品适用于预防成人术后24小时内恶心呕吐(PONV )。
24小时后的疗效尚未证明。
对于预期术后不会出现恶心和/或呕吐的患者,不推荐本品用作常规预防用药。
对于术后必须避免恶心和呕吐的患者,即使术后恶心和/或呕吐发生率较低,也推荐使用本品。
【规格】1.5mL: 0.075mg(按C19H24N2O计)【用法用量】推荐剂量为:麻醉诱导前,单次静脉注射本品0.075mg(1支),注射时间应超过10秒。
本品浓度为0.05 mg/ml (50 mcg/ ml),可直接静脉给药。
本品不可与其他药物混合。
输液前和输液后应使用生理盐水冲洗输液管路。
在给药前应检查其中是否含有可见的颗粒物,以及是否变色。
特殊人群肾脏损害任何程度的肾功能损害患者均不需要调整剂量。
肝脏损害任何程度的肝功能损害患者均不需要调整剂量。
儿童用药尚未在儿科患者中确定预防术后恶心和呕吐的安全性和有效性。
老年用药用于老年患者的有效性尚未充分评估。
对老年患者无需调整剂量或特殊监护。
【不良反应】由于临床试验的实施条件差异很大,因此在一种药物的临床试验中观察到的不良反应率无法与另一种药物的临床试验中观察到的不良反应率进行直接比较,且不能反映临床实践中观察到的发生率。

格拉司琼的用法
1. 格拉司琼可以口服哦!就像我们平时吃糖果一样把药吃下去就好啦,比如说你刚做完手术,觉得有点恶心想吐,那这时候口服格拉司琼就能帮你缓解啦!
2. 还能通过静脉注射用格拉司琼呢!这就好比给身体来个快速支援,像病人在化疗后很难受,采用静脉注射格拉司琼,效果就会来得特别快呀!
3. 格拉司琼也可以肌肉注射呀!想象一下打个小针,就能对抗那难受的感觉了,要是有人晕车晕得厉害,给他来一针格拉司琼试试呀!
4. 儿童使用格拉司琼要注意剂量哦!这不就像给小朋友分糖果,得根据他们的年龄来给合适的量嘛,可不能多了或少了呀!比如小朋友生病后呕吐,医生就要仔细斟酌格拉司琼的用量啦!
5. 格拉司琼得按时用呀!这就像是每天要按时吃饭一样重要呢,难道不是吗?患者要谨遵医嘱去用才行呢,不然怎么能快点好起来呢?
6. 在用格拉司琼的时候也要注意有没有不良反应呀!这不就像开汽车要时刻留意路况一样嘛,要是有啥不舒服可得赶紧跟医生说呀!
7. 千万别乱用格拉司琼呀!可不是随便什么情况都能用的呢,这就好比不是所有问题都能用一种方法解决呀,一定要听医生的话呀!
8. 记住哦,格拉司琼是帮助我们缓解不适的好帮手,但一定要正确使用才能发挥它的最大作用!咱可不能糊涂呀!。

盐酸托烷司琼注射液说明书盐酸托烷司琼注射液说明书【适应症】用于预防和治疗化疗引起的恶心和呕吐,用于外科全麻手术后的恶心和呕吐。
【用法用量】用前将本品用生理盐水或葡萄糖溶解后使用。
预防和治疗癌症化疗引起的恶心和呕吐:儿童:一般不推荐用于儿童,如病情需要必须使用时,可参照下列剂量:在2岁以上的儿童剂量为毫克/公斤,最高可达5毫克/天。
第1天静脉给药:将本品溶于100毫升常用输注液中(生理盐水、林格氏液或5%葡萄糖液)于化疗前快速静脉滴注或缓慢静脉推注,第2~6天可口服给药。
儿童口服给药:本品溶解后,可取适量的盐酸托烷司溶液,用桔子汁或可乐稀释后,在早晨起床时(至少于早餐前1小时)立即服用。
成人:成人推荐剂量为5毫克/天,每天一次,疗程为6天。
第1天静脉给药:将溶于100毫升常用输注液中(生理盐水、林格氏液或概葡萄糖液)在化疗前快速静脉滴注或缓慢静脉推注。
第2~6天可改为口服给药,于早晨起床时用生理盐水或葡萄糖溶解后(至少于早餐前一小时)用水服用。
治疗手术后的恶心和呕吐:儿童本品的推荐剂量为毫克/公斤体重,静脉输注(溶于生理盐水、林格氏溶液、5%的葡萄糖溶液或果糖溶液等)或缓慢静脉注射(30秒以上)。
成人推荐剂量为5毫克.静脉输注(溶于生理盐水、林格氏溶液、5%的葡萄糖溶液或果糖溶液等)或缓慢静脉注射(30秒以上)。
特殊使用:单用本品疗效不佳时,不增加药物剂量而同时合用地塞米松可提高止吐疗效。
代谢不良者应用:在为期6天的应用中,无需减少剂量。
肝或肾功能不全患者的应用:在急性肝炎或脂肪肝患者中.盐酸托烷司琼的药代动力学无改变。
但是,肝硬化或肾功能不全患者的血浆药物浓度则较正常的健康志愿者高约50紅然而,如果采用5毫克/天共六天的给药方案,则不必减量。
在任何化疗周期中,盐酸托烷司琼最多应用6天。
【不良反应】盐酸托烷司琼通常耐受性良好.推荐剂量下的不良反应为一过性,常见的不良反应有头痛,头昏、便秘,眩晕、疲劳和胃肠功能紊乱如腹痛和腹泻等。

盐酸格拉司琼葡萄糖注射液【化学结构式】无症状肝转氨酶增加。
上述反应轻微,无须特殊处理。
【禁忌】 1.对本品或有关化合物过敏者禁用。
2.肠梗阻患者禁用。
【注意事项】 1.由于本品可减缓消化道运动,故消化道运动障碍患者使用本品时应严密观察。
2.本品不宜与其他药物混合使用。
【孕妇及哺乳期妇女用药】 1.孕妇除非必需外,不宜使用。
2.哺乳期妇女慎用,若使用本品时应停止哺乳。
【儿童用药】2岁到16岁儿童推荐剂量10ug/kg,2岁以下的儿童用药情况尚不明确。
【老年用药】老年人和肝、肾功能不全者无需调整剂量。
【药物相互作用】 1.格拉斯琼是通过肝细胞色素P-450药物代谢酶进行代谢,诱导或抑制此酶可以改变清除率和格拉斯琼的半衰期。
2.格拉斯琼本身不会诱导或抑制细胞色素P-450药物代谢酶系统,可以和苯二氮卓类、神经安定类和抗溃疡类联合使用。
【药物过量】尚无一种特殊的解毒剂。
有报道指出:当用量达到38.5mg时,无明显症状,只偶尔有轻微的头疼。
受体拮抗剂,【药理毒理】药理作用:本品是一种高选择性的5-HT3对因放疗、化疗及手术引起的恶心和呕吐具有良好的预防和治疗作用。
放疗、化疗及外科手术等因素可引起肠嗜铬细胞释放5-HT,5-HT可激活中枢或迷走神经的5-HT受体而引起呕吐反射。
本品控制恶心和呕吐的机理,3是通过拮抗中枢化学感受区及外周迷走神经末梢的5-H受体,抑制恶心、呕吐的发生。
本品选择性高,无锥T3体外系反应、过度镇静等副作用。
生殖毒性:本品皮下给药剂量达6mg/kg/天(以体表面积计算,为临床静脉给药推荐剂量的97倍)时,未表现出对雌、雄大鼠生育力和生殖行为的影响。
妊姃的大鼠和家兔静脉给予本品剂量分别为9mg/kg/天(54mg/m2/天,按体表面积算,相当于临床静脉推荐给药剂量的146倍)及3mg/kg/天(35.4 mg/m2/天,按体表面积算,相当于临床静脉推荐给药剂量的96倍)的生殖毒性研究中,均未表现出对动物生育力和胎仔发育的影响。


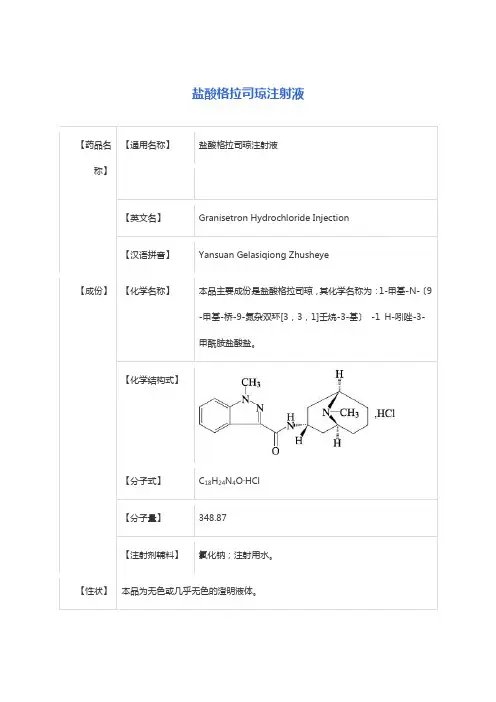
盐酸格拉司琼注射液的制备及其质量研究引言盐酸格拉司琼(Granisetron Hydrochloride)属于5-HT3受体拮抗剂,广泛用于化疗后恶心和呕吐症的预防和治疗。
本文将介绍盐酸格拉司琼注射液的制备方法与质量研究。
制备方法本次制备的盐酸格拉司琼注射液采用无菌制备,具体步骤如下:1.材料准备:盐酸格拉司琼、注射用水、生理盐水、苯酚等。
2.加热:将注射用水、盐酸格拉司琼分别进行加热至60~70℃。
3.冷却:将两种液体都冷却到40℃以下。
4.混合:将盐酸格拉司琼缓慢滴入注射用水中。
混合均匀后加入一定量的苯酚作为防腐剂。
5.筛选:过滤混合液去除杂质后,加入适量的生理盐水调节注射液的容积。
6.灭菌:对注射液进行灭菌处理,并在无菌环境下灌装至注射瓶中。
质量研究为了确保制备的盐酸格拉司琼注射液符合规定的质量标准,需要进行以下指标的检测:外观检查检查制备后的注射液颜色、透明度、气体、悬浮物等外在特征是否符合规范要求。
pH值测定盐酸格拉司琼注射液的pH值应在4.0~6.0之间,使用酸度计进行检测。
盐酸格拉司琼含量测定采用高效液相色谱法(HPLC)进行盐酸格拉司琼含量测定,应符合国家药典中相关规定。
细菌限度测定采用无菌法进行细菌限度测定,应符合国家药典中相关规定。
稳定性检测将样品置于不同的贮存条件下,如室温、4℃和冷冻,定期进行检测,以评估其稳定性和保存期限。
结论通过无菌制备、外观检查、pH值测定、盐酸格拉司琼含量测定、细菌限度测定和稳定性检测等质量研究,本次制备的盐酸格拉司琼注射液符合国家药典中相关标准规定。


格拉司琼使用说明书请仔细阅读说明书并在医师指导下使用格拉司琼使用说明书【药品名称】通用名称:格拉司琼英文名称:Granisetron Hydrochloride Capsules汉语拼音:Yansuan Gelasiqiong Jiaonang【成份】本品主要成分是盐酸格拉司琼【适应症】止吐药。
用于:①细胞毒性药物化疗和放射治疗引起的恶心呕吐;②预防和治疗手术后的恶性呕吐。
【规格】1mg/片。
【用法用量】本品通过口服给药,与静脉、肌肉注射给药配合使用,①成人:剂量一般为每次1mg,每天2次。
②儿童:剂量为每次20μg/kg,每天2次。
一般于化疗前1小时服用,第二次为12小时后服用。
【不良反应】常见的副作用为头痛、倦怠、发热、便秘及胃肠道功能紊乱,偶有短暂性无症状肝转氨酶增高。
上述反应轻微,无须特殊处理。
【禁忌】①对本品或有关化合物过敏者禁用;②胃肠道梗阻者禁用。
【注意事项】①本品对化疗、放疗所致呕吐起预防作用,首剂在化疗前1小时服用。
②本药可减缓结肠蠕动,患者若有亚急性肠梗阻时,需严格观察。
③高血压未控制的患者,日剂量不宜超过10mg,以免引起血压进一步升高。
④致癌性研究资料显示,给予两性小鼠及大鼠极大量本品时(50mg/kg)(大鼠剂量于第59周时降至25mg/kg/日),发现有肝细胞瘤及或腺瘤,于接受5mg/kg本品之大鼠亦发现有肝细胞增生,而于低剂量时(1mg/kg)时此种药物无诱发肝细胞增生的现象。
⑤本品与食物同时服用时吸收略有延迟。
【孕妇及哺乳期妇女用药】多个体外及体内评估试验证实本药对哺乳类动物的细胞无遗传毒性。
动物实验证实无致畸胎性,但于人体则无此经验。
此外,本品亦无在母乳中分泌及排泄的资料。
因此,下述规则应当遵循:①孕妇除非必需外,不宜使用;②哺乳期妇女需慎用,若使用本品时应停止哺乳。
【儿童用药】对于儿童不推荐使用。
【老年用药】老年人无须调整剂量。
【药物相互作用】与利福平或其他肝酶诱导药物同时使用,本品血药浓度减低,应适当增加剂量。

雷赛隆(盐酸格拉司琼片)【药品名称】商品名称:雷赛隆通用名称:盐酸格拉司琼片英文名称:Granisetron Hydrochloride T ablets【成份】本品主要成分为:盐酸格拉司琼。
【适应症】用于放射治疗、细胞毒类药物化疗引起的恶心和呕吐。
【用法用量】口服:成人通常用量为1mg,一日2次,第一次于化疗前1小时服用,第二次于第一次服药后12小时服用。
肝、肾功能不全者无需调整剂量。
【不良反应】常见的副作用为头痛、倦怠、发热、便秘及胃肠道功能紊乱,偶有短暂性无症状肝转氨酶增高。
上述反应轻微,无须特殊处理。
【禁忌】1 对本品或有关化合物过敏者禁用;2 胃肠道梗阻者禁用。
【注意事项】1.本品对化疗、放疗所致呕吐起预防作用,首剂在化疗前1小时服用;2.本药可减缓结肠蠕动,患者若有亚急性肠梗阻时,需严格观察;3.高血压未控制的患者,日剂量不宜超过10mg,以免引起血压进一步升高;4.致癌性研究资料显示,给予两性小鼠及大鼠极大量本品时(50mg/kg)(大鼠剂量于第59周时降至25mg/kg/日),发现有肝细胞瘤及或腺瘤,于接受5mg/kg本品之大鼠亦发现有肝细胞增生,而于低剂量时(1mg/kg)时此种药物无诱发肝细胞增生的现象;5.本品与食物同时服用时吸收略有延迟。
【药物相互作用】与利福平或其他肝酶诱导药物同时使用,本品血药浓度减低,应适当增加剂量。
【药理作用】一种高选择性的5-羟色胺3(5-HT3)受体拮抗剂,对因放疗、化疗及手术引起的恶心和呕吐具有良好的预防和治疗作用。
放疗化疗及外科手术等因素可引起肠嗜铬细胞释放5-HT,5-HT可激活中枢或迷走神经末梢的5-HT3受体而引起呕吐反射。
本品控制恶心和呕吐的机制,是通过拮抗中枢化学感受区及外周迷走神经末梢的5-HT3受体,抑制恶心、呕吐的发生。
本品选择性高,无锥体外系反应、过度镇静等不良反应。
【贮藏】遮光,密闭保存。
【批准文号】国药准字H10980009【生产企业】企业名称:精华制药集团股份有限公司生产地址:江苏省南通市港闸经济开发区兴泰路9号。
盐酸格拉司琼氯化钠注射液(征求意见稿)Yansuan Gelasiqiong Lühuana ZhusheyeGranisetron Hydrochloride and Sodium Chloride Injection 本品为盐酸格拉司琼与氯化钠的灭菌水溶液。
含格拉司琼(C18H24N4O)应为标示量的90.0%~110.0%,含氯化钠(NaCl)应为标示量的95.0%~105.0%。
【性状】本品为无色或几乎无色的澄明液体。
【鉴别】(1)在含量测定项下记录色图谱中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)取本品适量,加0.1mol/L盐酸溶液制成1ml约含12μg的溶液,照紫外-可见分光光度法(附录ⅣA)测定,在302nm的波长处有最大吸收。
(3)本品显钠盐与氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
【检查】pH值应为4.5~7.0(中国药典2010年版二部附录ⅥΗ)。
有关物质取本品作供试品溶液;精密量取供试品溶液1ml,加流动相稀释至100ml,作为对照溶液。
照含量测定项下的色谱条件进行测定,精密量取对照溶液20µl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%以上;再精密量取供试品溶液和对照溶液各20µl分别注入液相色谱仪,记录色谱图至主峰保留时间的2倍,供试品溶液的色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液主峰的峰面积。
不溶性微粒取本品1瓶,依法检查(中国药典2010年版二部附录Ⅸ C),应符合规定。
重金属取本品50ml,蒸发至约20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,依法检查(中国药典2010年版二部附录ⅧH第一法)含重金属不得过千万分之三。
渗透压取本品,依法测定(中国药典2010年版二部附录ⅨG),毫渗透压摩尔浓度应为260~320mOsmol/kg。
细菌内毒素取本品,依法检查(中国药典2010年版二部附录ⅪE),每1ml中含内毒素的量应小于4EU。
盐酸格拉司琼结构
摘要:
一、盐酸格拉司琼简介
1.盐酸格拉司琼的定义
2.盐酸格拉司琼的作用
二、盐酸格拉司琼结构特点
1.分子式
2.分子量
3.结构式
三、盐酸格拉司琼的应用领域
1.临床应用
2.制药工业
正文:
【提纲】一、盐酸格拉司琼简介
盐酸格拉司琼是一种化学物质,具有独特的化学结构和生物活性。
作为一种药物,盐酸格拉司琼主要用于治疗各种疾病,尤其是癌症。
它可以通过干扰癌细胞的生长和分裂过程来抑制癌细胞的扩散和恶化。
此外,盐酸格拉司琼也被用于治疗胃肠道疾病、神经系统疾病等。
【提纲】二、盐酸格拉司琼结构特点
盐酸格拉司琼的分子式为C18H24N4OCl2,分子量为393.35。
其结构式如下:
```
Cl
|
H - C - N - C - C - N - C - C - O - C - N - C - C - N - C - C - O
| | | | | | | | | | | | | | |
H H H H H H H H H H H H H H H H
```
【提纲】三、盐酸格拉司琼的应用领域
盐酸格拉司琼在临床上的应用非常广泛,主要用于治疗癌症、胃肠道疾病、神经系统疾病等。
在制药工业中,盐酸格拉司琼被用作原料药,用于生产各种抗肿瘤药物。
注射用盐酸格拉司琼
【药品名称】
通用名称:注射用盐酸格拉司琼
英文名称:Granisetron Hydrochloride For Injection
汉语拼音:Zhusheyong Yansuan Gelasiqiong
【成份】本品主要成份为盐酸格拉司琼制成的无菌冻干品。
每瓶含格拉司琼3mg;其辅料为甘露醇。
化学名称:1-甲基-N-〔桥-9-甲基-9-氮杂双环(3,3,1)壬烷-3-基〕-1H-吲哚-3-甲酰胺盐酸盐。
化学结构式:
分子式:C18H24N4O·HCl
分子量:348.88
【性状】本品为白色或类白色疏松块状物或粉末。
【适应症】用于放射治疗、细胞毒类药物化疗引起的恶心和呕吐。
【规格】3mg
【用法用量】静脉注射:成人:用量通常为3mg,用20~50ml的5%葡萄糖注射液或0.9%氯化钠注射液充分溶解后,于治疗前30分钟静脉注射,给药时间应超过5分钟。
大多数病人只需给药一次,对恶心和呕吐的预防作用便可超过24小时,必要时可增加给药次数1~2次,但每日最高剂量不应超过9mg。
老年人和肝、肾功能不全者无需调整剂量。
【不良反应】常见的不良反应为头痛、倦怠、发热、便秘、偶有短暂性无症状肝脏氨基转移酶增加。
上述反应轻微,无须特殊处理。
【禁忌】
1.对本品或有关化合物过敏者禁用。
2.胃肠道梗阻者禁用。
【注意事项】
1.由于本品可减慢消化道运动,故消化道运动障碍患者使用本品时应严密观察。
2.本品不应与其他药物混合使用。
【孕妇及哺乳期妇女用药】孕妇除非必需外,不宜使用。
哺乳期妇女需慎用,若使用本品时应停止哺乳。
【儿童用药】2岁到16岁儿童推荐剂量10μg/kg,2岁以下儿童用药情况尚不明确。
【老年用药】老年人无需调整剂量。
【药物相互作用】
1. 格拉司琼是通过肝细胞色素P-450药物代谢酶进行代谢,诱导或抑制此酶可以改变清除率
和格拉司琼的半衰期。
2. 格拉司琼本身不会诱导或抑制细胞色素P-450药物代谢酶系统,可以和苯二氮卓类、神经
安定类和抗溃疡类药联合使用。
【药物过量】尚不明确。
【药理毒理】
药理作用
本品是一种高选择性的5-HT3受体拮抗剂,对因放疗、化疗及手术引起的恶心和呕吐具有
良好的预防和治疗作用。
放疗、化疗及外科手术等因素可引起肠嗜铬细胞释放5-HT,5-HT 可激活中枢或迷走神经的5-HT3受体而引起呕吐反射。
本品控制恶心和呕吐的机理,是通过拮抗中枢化学感受区及外周迷走神经末梢的5-HT3受体,从而抑制恶心、呕吐的发生。
本品选择性高,无锥体外系反应、过度镇静等副作用。
毒理研究
生殖毒性:本品皮下给药剂量达6mg/kg/天(以体表面积算,为临床静脉给药推荐剂量的97倍)时,未表现出对雌、雄大鼠生育能力和生殖行为的影响。
妊娠的大鼠和家兔静脉给予本品剂量分别为9 mg/kg/天(54mg/m2/天,按体表面积算,相当于临床静脉给药推荐剂量的146倍)及3mg/kg/天(35.4mg/m2/天,按体表面积算,相当于临床静脉给药推荐剂量的96倍)的生殖毒性研究中,均未表现出对动物生育力和胎仔发育的影响。
遗传毒性:本品Ames试验、小鼠淋巴瘤细胞正向突变试验、小鼠微核试验及体内、外大鼠肝细胞UDS试验结果均未表现出致突变作用。
但在Hela细胞体外试验中出现UDS明显增加,体外人淋巴细胞染色体畸变试验中,多倍体细胞的数量明显增加。
致癌性:在给药两年的致癌性试验中,大鼠经口给予本品的剂量分别为1、5、50mg/kg(6、30、300mg/m2/天),其中高剂量组在第59周时因毒性反应而将剂量降至25mg/kg。
结果显示,5mg/kg/天以上组(包括该剂量组)雄性大鼠和25mg/kg/天组雌性大鼠(以体表面积计算,其剂量分别相当于临床静脉给药推荐剂量的81倍以上和405倍)的肝细胞癌和腺癌的发生率显著增加,而1mg/kg组雄性大鼠和5mg/kg组雌性大鼠(以体表面积算,分别为临床静脉给药推荐剂量的16倍和81倍)的肝肿瘤发生率未见增加。
在12个月的试验中,经口给予本品100mg/kg/天组(600mg/m2,以体表面积计算,相当于临床静脉给药推荐剂量的1622倍)的雌、雄大鼠均发生肝细胞腺瘤,而空白对照组未出现。
本品给药24个月的小鼠致癌性试验结果显示,肿瘤的发生率未见有统计学意义的明显增加,但该试验尚未得出最后结论。
【药代动力学】健康受试者静注本品20或40μg/kg后,平均血浆峰浓度分别为13.7和42.8μg/L,血浆清除半衰期约3.1~5.9小时。
本品在体内分布广泛,血清蛋白结合率约为65%,大部分迅速代谢,主要代谢途径为N-去烷基化及芳香环氧化后,再共轭形成结合产物,本品通过粪便和尿液排泄。
【贮藏】遮光,密闭保存。
【包装】低硼硅玻璃管制注射剂瓶、药用溴化丁基橡胶塞包装,2瓶/盒。
【有效期】24个月。
【执行标准】YBH02282005
【批准文号】国药准字H20050204。