第四章 非经典配合物
- 格式:ppt
- 大小:2.09 MB
- 文档页数:80


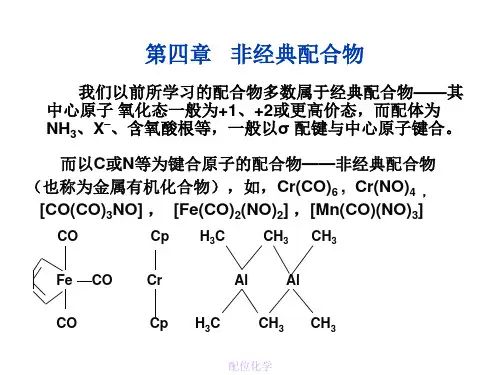

讲座十、过渡金属的非经典配合物(王振山,2017.11.18,2中)一、概述1、非经典配合物是指:金属和一个或多个碳原子直接键合而形成的一类化合物。
常见的配体是CO,苯,烯烃等。
有人也把它们称为金属有机化合物。
学工作者主要指的是过渡金属和有机分子通过M-C键形成的配合物,即非经典配合物。
非经典配合物含有L的键中,既有σ又有反馈π键,经典配合物中只有σ配键。
2、非经典配合物的反馈π键在配合物中,中心原子与配位体之间形成σ配键时,如果中心原子的某些d轨道(如d XY,d YZ,d XZ)有孤对电子,而配位体有空的π分子轨道或空的p或d轨道,而且两者对称性匹配,则中心原子可以反过来将其孤对d电子给予配位体形成反馈π键。
这就是L→M形成σ键,L←M形成反馈π键。
需要指出,反馈π键不能独立存在,它必须与σ配键同时存在。
形成反馈π键的条件是中心原子必须有自由的d电子。
这种键具有部分双键特征,它比通常的σ配键的键能大、键长短,因而配合物的稳定性强。
3、非经典配合物分类⑴、按成键分:①、π-酸配合物,如Ni(CO)4;②、π-配合物,如[PtCl3(C2H4)]-。
⑵、按配体分:羰基配合物,烯烃、炔烃配合物,有机配体配合物等。
⑶、按结构分:简单配合物、簇状化合物、夹心配合物、冠谜化合物(超分子化合物)。
4、有效原子序数规则⑴、有效原子序数EAN(Effective Atomic Nnmber Rule)规则:①、提出:EAN规则是1923年英国化学家西奇维克(N.V.Sidgwick)提出的,是过渡金属簇合物化学中比较重要的一个概念,常用来预测金属配合物的结构和稳定性。
②、内容:有效原子序数是指中心金属原子的电子总数和配体给予的电子数之和。
EAN规则认为,“中心金属原子的电子总数加上由配体贡献来的电子数之和,应等于其后的同周期稀有气体元素的原子序数”。
EAN规则的另一种说法是18电子规则18-electron rule,“每个中心金属原子的价电子数加上由配体贡献来的电子数之和应等于18”,所以EAN规则又称18电子规则。


第四章配合物4-1 答:向粗盐酸中滴入1滴硫氰酸钾溶液,若溶液呈现深红色,则粗盐酸的黄色不是Fe3+与Cl-的络离子;若溶液不显色,则粗盐酸的黄色是Fe3+与Cl-的络离子的颜色。
由于粗盐酸PH小于1,在PH小于1的强酸性溶液中不可能存在Fe(OH)2+, Fe(OH)2+等离子,因此,粗盐酸的黄色也不是铁的羟合离子的颜色。
4-2 解:由于Cl-半径大,若采取6配位,则由于Cl-间的斥力,形成的配合物不够稳定,而F-半径较小,采取6配位后形成的配合物稳定。
4-3 解:MA3B3:有2种几何异构体;MA2B4:有2种几何异构体;MABC4:有2种几何异构体;MA2B2C2:MABCDEF :有15种对映异构体。
4-4 解:有一对对映异构。
4-5 解:由于双齿配体的碳链不够长,不能够与顺铂的几何异构体的对位配位,故它不能与草酸反应生成Pt(NH3)2C2O4。
顺铂有极性,水溶性较大,而它的几何异构体则无极性,水溶性较小。
4-6 解:[Co(NH3)6]3+ ; [Co(NH3)5Cl]2+ ; [Co(NH3)4Cl2]+ ; [Co(NH3)4Cl2]+.这四种配合物的电导之比为4:3:2:2 .4-7 解: Fe(CN)64-的杂化轨道类型为:d2sp3 ;Co(NH3)63+的杂化轨道类型为:d2sp3 .4-8 解:RuCl2(H2O)4有2种几何异构体:RuCl3(H2O)3有2种几何异构体:又,所以异构体A是上述中的(Ⅱ).(Ⅲ)中的取代反应只发生在对位是Cl的Cl原子上,不发生在对位是H2O的Cl原子上;(Ⅳ)中的取代反应可发生在任一Cl原子上,此规律称”反位效应”.4-9 解:[Co(NH3)6]Cl3氯化六氨合钴(Ⅲ) [Co(NH3)6]3+K2[Co(NCS)4] 四异硫氰酸根合钴(Ⅱ)酸钾[Co(NCS)4]2-H2[PtCl6] 六氯合铂(Ⅳ)酸[PtCl6]2-[CrCl(NH3)5]Cl2 氯化一氯五氨合铬(Ⅲ) [CrCl(NH3)5]2+K2[Zn(OH)4] 四羟基合锌(Ⅱ)酸钾[Zn(OH)4]2-[PtCl2(NH3)2] 二氯二氨合铂(Ⅱ) [PtCl2(NH3)2]4-10(1)[CoCCl2(H2O)(NH3)]Cl ⑵ K2[PtCl6](3)(NH3)3[CrCl2(SCN)4] (4) Ca[Co(NH3)2(C2O4)2]24-11化学式:K2[(CoCL2)2(NH3)2]中心氧原子的氧化态为+2,属于MA2B2C2型八面体配合物异构4-12答:Fe(H2O)63+为外轨型配合物,未成对电子数为5,Fe(CN)63-为内轨型配合物,未成对电子数为1,差距很大,所以由u=√n(n+2)BM可知Fe(H2O)63+的磁距比Fe(CN)63-的磁距大。


理清概念把握结构准确判断配位数朱德彬【摘要】配位数的判断是一个复杂的问题,不仅要理清配位数的概念,还要要考虑物质的空间结构及其原子间的键合.【期刊名称】《化学教与学》【年(卷),期】2011(000)011【总页数】3页(P82-84)【关键词】配位数;概念;结构【作者】朱德彬【作者单位】江苏省翔宇教育集团宝应县中学江苏宝应225800【正文语种】中文【中图分类】G633.8有一条关于配位数的题目:酞菁与酞菁铜染料分子结构如下图:该分子的中心Cu2+的配位数为多少?此题颇有争议。
答案有2和4两种不同的说法,前者的理由是:配位数就是与中心原(离)子配位的原子数目,该分子中Cu2+与上下两个采用SP2杂化的氮原子通过共价键结合,与左右两个采用SP3杂化的氮原子以配位键相结合;另一方的理由是在金属酞菁分子中的16个π电子,由于分子的共轭作用,与金属原子相连的共价键和配位键在本质上是相同的,所以配位数为4。
要解决这一问题,不仅要理清配位数的概念,还要考虑物质的空间结构及其原子间的键合。
一、配位数的概念配位数是由化合价分化产生的另一个概念,它主要用于晶体和配合物。
1.晶体学中的配位数在晶体中,原子或离子总是按一定方式与周围的原子或离子相结合,此时,一个质点与周围直接接触的质点数称为配位数。
原子配位数是指某一个原子周围所接触到的同种原子的数目;离子配位数是在离子晶体中,每个离子周围所接触到的异性离子的个数。
在金属晶体中,由于金属原子通常做最紧密堆积,决定了金属原子具有较高或最高的配位数。
2.配位化学中的配位数配位化合物(简称配合物)的配位数是直接同中心原子(离子)合的配位原子数目,即中心原子(配离子)接受孤对电子或形成配位键的数目。
二、配位数与物质结构1.晶体中配位数晶体中原子(离子)的配位数与晶体结构或晶胞类型有关。
表1 常见晶体的配位数晶胞类型简单立方简单晶体复式面心立方体心立方面心立方晶体结构复式简单立方六方密堆积配位数 6 8 12 6 8 12(1)原子晶体由于共价键有方向性和饱和性,所以原子的配位数决定于元素的共价。

配合物 知识点总结一、配位化合物的定义由提供孤电子对(NH 3、H 2O 、X -或π电子的物种与提供适当空轨道的物种(金属原子或金属离子)组成的化合物称为配位化合物,简称为配合物。
二、配位化合物的组成1.配合物由内界和外界组成。
外界为简单离子,配合物可以无外界,但不可以无内界。
例如:Fe(CO)5、Pt(NH 3)2Cl 2 2.内界由中心体和配位体组成。
(1) 中心体:提供适当的空轨道的原子或离子,绝大部分是d 区或ds 区元素。
用M 表示。
(2) 配位体 (L)(简称配体):提供孤对电子对或π电子的离子,离子团或中性分子。
三、配位化合物的分类1.配体提供孤电子对,占有中心体的空轨道而形成的配合物。
例如:+23)Ag(NH ,-34Cu(CN)2.配体提供π电子,占有中心体的空轨道而形成的配合物。
例如:255)H Fe(CH 2CCH 2M配体提供:2个π电子 4个π电子 6个π电子四、配位体1.根据配体中配位原子的不同,配体可分类成:(1) 单基(齿)配体:配体中只含有一个配位原子;例如:NH 3、H 2O 。
(2) 多基(齿)配体:配体中含有两个或两个以上的配位原子。
由单齿配体组成的配合物,称为简单配合物;由多齿配体组成的配合物,称为螯合物。
2.一些常见的配体:(1) 单基配体:X -:F -、Cl -、Br -、I -、H 2O 、CO 、NO 、OH -(2) 双基配体:en (乙二胺) H 2NCH 2CH 2NH 2、ox 2-(草酸根)五、配位数1.中心原子(或离子)所接受的配位原子的数目,称为配位数2.若单基配体,则配位数 = 配体数;若多基配体,则配位数 = 配体数 ⨯ 配位原子数 / 每个配体六、配位化合物的命名1.从总体上命名(1) 某化某:外界是简单阴离子,[Cr(H 2O)4Cl 2]Cl ,氯化二氯·四氨合铬(Ⅲ) (2) 某酸某:a .外界是含酸根离子:[Co(NH 3)5Br]SO 4:硫酸溴·五氨合钴(Ⅲ)b .内界是配阴离子:K 3[Fe(CN)6]:六氰合铁(Ⅲ)酸钾2.内界的命名(1) 内界的命名顺序:配体名称 + 合 + 中心体名称 + (用罗马数字表示的中心体氧化数)例如:[PtCl 2(NH 3)(C 2H 4)]:二氯·氨·(乙烯)合铂(Ⅱ) (2) 配体的命名顺序:a .先无机配体后有机配体,有机配体名称一般加括号,以避免混淆;b .先命名阴离子配体,再命名中性分子配体;c .对于都是中性分子(或阴离子),先命名配体中配位原子排在英文字母顺序前面的配体,例如NH 3和H 2O ,应先命名NH 3;d .若配位原子数相同,则先命名原子数少的配体。
第四章配位化学内容提要:1.配合物的基本概念、命名;2.配合物的立体化学、异构现象;3.配合物的化学键理论。
要点难点:配位化学的几何异构、晶体场理论。
课时安排:6随着无机化学的复兴,大约在本世纪40年代中期配位化学便形成一门独立的学科。
据统计,目前一千万种化合物中大约7o%是配合物。
近年来发表的无机化学论文也有了70%左右涉及配合物。
配位化学早已是一门独立的学科,在现代无机化学中占有重要的地位。
配位化学的奠基人是Alfred Werner。
他提出了配位学说的主价和副价概念,并因对Co(111),Cr(111)旋光活性配合物的研究而荣获了1913年诺贝尔化学奖。
在Werner时代,人们对主价和副价的本质还弄不清楚,只有在现代化学键的电子理论提出以后,配合物的结构才得到满意的阐明。
在配位键合理论的指引下,配位化学得到了进一步蓬勃的发展。
§1 配位化合物的基本概念一、配合物的定义什么叫配合物?按照中国化学会1980年制订的《无机化学命名原则》,配合物的定义是:配位化合物(简称配合物)是由可给出弧对电子或多个不定域电子的一定数目的离子或分子(称为为配体)和具有接受孤对电子或多个不定域电子的的空位的原子离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
研究配合物的化学称配位化学,配合物化学。
关于配合物的名称,我们作一简单介绍。
建国以前,配位化合物曾引用日本名称称为错合物。
在20世纪50年代初期,根据曾昭伦先生建议,将其称为络合物。
根据中国化学会1980年制订的《无机化学命名原则》,定名配位化合物,简称配合物。
实际上采用的是双轨制。
国际上除了使用Coordination compounds之外,还有一个通用名,即compounds或pomplex,这和我国的配位化合物(简称配合物)、络合物是对应的。
也和“络合滴定”、“络合催化”、“大环配体络合物”等概念对应。
二、配合物的组成一个配合物由以下几部分组成,以[Cu(NH3)4]SO4为例:[Cu (NH3) 4 ] SO4中心原子配体配位数内界(配离子)外界Cu为中心原子、NH3为配体、4是配位数,这一部分称配合物的内界,往往称配离子,是配合物的特征部分,SO42-为外界,一个配合物可以没有外界,但不能没有内界。
第五章非经典配合物5.1概述5.1.1金属有机化合物与非经典配合物的关系1.什么叫金属有机化合物一般指有机分子基团的C原子直接和M键合形成的化合物。
对无机化学工作者主要指的是过渡金属和有机分子通过M-C键形成的配合物,即非经典配合物2.无机中的金属有机配合物-非经典配合物非经典配合物含有ML的键中既有又有反馈键经典配合物中只有配键5.1.2金属有机化学发展回顾11825年(丹化学家Zeise)发现蔡塞盐21890年合成Ni(CO)431891年合成CH3MgI41951年(P.L.Pauson)合成二茂铁51952年FischerandWilkinson同时测定二茂铁结构61973年FischerandWilkinson获Nobel奖750年代后迅猛发展5.1.3金属有机化合物的分类1.M-C间为离子型的化合物(无机化学讨论)K+C CH-2.C原子为σ电子给予体(有机化学讨论)[B(C6H5)4]-Al2(CH3)6Hg(C2H5)23.C既为σ电子给予体,又为π接受体(金属有机,即非经典配合物)Ni(CO)44.C为π电子给予体,有时也可以是π电子接受体(金属有机,即非经典配合物)金属烯烃、炔烃配合物,二茂铁5.1.4非经典配合物基本常识简介1.非经典配合物分类(1)成键分:π-酸配合物,Ni(CO)4π-配合物,[PtCl3(C2H4)]-(2)配体分:羰基配合物,烯烃、炔烃配合物,有机配体配合物(3)结构分:简单配合物、蔟状化合物、夹心配合物、冠谜化合物(超分子化合物)5.2金属羰基配合物5.2.1金属羰基配合物的一般介绍1.金属羰基配合物的特点(1)CO不是强的Lewis碱,但和过渡金属形成稳定的化学键(2)过渡金属有低的氧化态(3)大都符合EAN规则。
2.金属羰基配合物的分类:单核,多核3.有效原子序数规则(EAN)--(EffectiveAtomicNnmberRule)(1)1927英化学家N.V.Sidgwick扩展了G.N.Lewis的Octet的概念,提出的经验规则:金属的电子数加上配体提供的电子数等于金属所在周期稀气元素电子数。