第八章 氧化还原反应与电极电位
- 格式:doc
- 大小:78.00 KB
- 文档页数:4

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。


氧化还原反应与电极电位氧化还原反应是化学反应中常见的一种类型,它涉及到电子的传递和原子、离子之间的电荷转移。
在氧化还原反应中,物质可以同时发生氧化和还原的过程,其中一个物质被氧化,失去电子,另一个物质则被还原,获得电子。
这种反应可以通过电极电位来描述和测量。
一、电极电位的定义电极电位是指电极与溶液中某特定物种(如氢离子)之间的电势差。
它是描述氧化还原能力的物理量,以标准氢电极为参照。
标准氢电极的电极电位定义为0V,其他电极与标准氢电极之间的电位差可以正负表示。
正值表示该电极的氧化还原能力较强,负值表示能力较弱。
二、氧化还原反应中的电位变化在氧化还原反应中,电子的转移会导致电极电位的变化。
当物质被氧化时,它的电极电位会升高,而当物质被还原时,电极电位会降低。
这是因为被氧化的物质失去了电子,所以电极电位增高;而被还原的物质获得了电子,所以电极电位降低。
三、电极电位的测量方法测量电极电位的方法有很多种,其中较常用的是电化学法。
电化学法利用电池的原理,将待测电极与参比电极连接在一起,通过测量其间的电势差来得到电极电位。
常见的参比电极有标准氢电极、银/银离子电极等。
四、电极电位对氧化还原反应的影响电极电位可以影响氧化还原反应的进行程度和方向。
当两个电极电位之间的差异较大时,电子会从电位较负的一侧传递到电位较正的一侧,从而反应更为剧烈。
根据电极电位的高低,氧化还原反应可以被分为自发反应和非自发反应。
自发反应是指电极电位差足够大,反应能够自行进行;非自发反应是指电极电位差不足以驱动反应发生,需要外部提供电势差来促使反应进行。
五、电极电位在实际应用中的意义电极电位在许多领域具有广泛的应用价值。
在电化学电池中,电极的电位差决定了电池的工作状态和输出电压。
在腐蚀、电解和电镀等工艺中,电极电位的变化影响着反应速率和产物的选择。
而在生物体内,电极电位的平衡和调节对细胞的正常功能也具有重要作用。
总结:氧化还原反应与电极电位密切相关。

氧化反应的标准电极电位与氧化还原反应的推导氧化还原反应是化学中常见的重要反应之一。
在氧化还原反应中,物质发生氧化的过程称为氧化反应,而同时发生还原的过程称为还原反应。
作为探究氧化还原反应的一个重要指标,标准电极电位在研究中起着重要的作用。
本文将探讨氧化反应的标准电极电位以及氧化还原反应的推导。
1. 标准电极电位标准电极电位是指在标准状态下,电极与溶液中电离浓度均为1mol/L时,测得的电解电位。
标准状态是指所有反应物的活度均为1。
标准电极电位可以通过电位差测量仪器来测量,并被用来评估元素或化合物的氧化还原能力。
2. 氧化反应的标准电极电位氧化反应涉及到被氧化物质失去电子,因此其标准电极电位是正值,表示其具有氧化能力。
例如,标准氢电极的电位被定义为0 V,而其他电极的电位相对于标准氢电极进行比较和测量。
3. 氧化还原反应的推导氧化还原反应的推导可以通过以下步骤进行。
a. 确定氧化和还原反应物首先需要明确参与反应的氧化物质和还原物质。
氧化反应中,物质被氧化,因此被氧化的物质是氧化剂,而还原反应中,物质被还原,因此被还原的物质是还原剂。
b. 确定氧化态和还原态确定氧化反应物和还原反应物的氧化态和还原态。
根据反应物和产物中元素的氧化态的变化来推导反应的方程式。
c. 平衡反应方程式根据确定的氧化态和还原态,平衡氧化还原反应方程式中的反应物和产物的个数。
确保反应方程式中的总电荷和总质量都平衡。
d. 计算电极电位利用标准电极电位表,查找反应中涉及的各个物质的标准电极电位,并按照反应方程式的系数进行计算。
计算得到的标准电极电位之差就是氧化还原反应的标准电极电位。
4. 应用和意义氧化还原反应的标准电极电位可以用来比较和评估不同物质的氧化还原能力。
通过测量不同反应物的标准电极电位,可以推导出一系列反应的相对强弱,从而指导相关实验的设计和反应条件的选择。
此外,标准电极电位的研究对于电化学、电池和腐蚀等领域的发展也具有重要意义。


氧化还原反应的电极电位计算电极电位与氧化还原反应的驱动力计算氧化还原反应是化学中非常重要的一类反应,涉及到电子的转移与传递。
在氧化还原反应中,电极电位是一个关键参数,用来描述电极上发生氧化还原反应的趋势和方向。
本文将介绍如何计算氧化还原反应的电极电位以及电极电位与氧化还原反应的驱动力之间的关系。
一、氧化还原反应的电极电位计算方法在氧化还原反应中,电极电位可以通过计算标准电极电位和非标准电极电位来确定。
标准电极电位是指在标准状况下(浓度为1 mol/L,温度为298K),电极上的氧化还原反应的电位。
非标准电极电位是指在非标准状况下,电极上的氧化还原反应的电位。
1. 计算标准电极电位标准电极电位的计算可以通过标准氧化还原电位表来实现。
标准氧化还原电位表列出了各个氧化还原对的标准电极电位值。
对于给定的氧化还原对,其标准电极电位可以通过两个半反应的标准电极电位之差来计算。
2. 计算非标准电极电位非标准电极电位可以通过涉及到的各种因素来确定,例如浓度、温度和电子传递系数等。
在实际应用中,可以使用尼尔斯特方程来计算非标准电极电位:E = E0 - (0.0592/n) * logQ其中,E是非标准电极电位,E0是标准电极电位,n是电子传递的电子数目,Q是反应物浓度之比的电子指数。
二、电极电位与氧化还原反应的驱动力计算方法氧化还原反应的驱动力可以通过计算电极电位之差来确定。
具体而言,氧化还原反应的驱动力等于电子传递的能力与电子转移的能力之间的差异。
根据热力学理论,氧化还原反应的驱动力可以通过以下公式计算:ΔG = -nFΔE其中,ΔG是氧化还原反应的自由能变化,n是电子传递的电子数目,F是法拉第常数,ΔE是氧化还原反应的电极电位差。
根据上述公式,我们可以通过计算氧化还原反应的电极电位差来确定反应的驱动力。
如果电极电位差为正值,说明反应是自发进行的,驱动力大;如果电极电位差为负值,反应是不自发进行的,驱动力小。

氧化反应的标准电极电位与氧化还原反应的判断氧化还原反应是化学反应中最重要的类型之一,它涉及到电子的转移和化学物质的氧化与还原。
在氧化还原反应中,标准电极电位是一个重要的概念,用于判断反应的进行方向和强弱。
本文将探讨氧化反应的标准电极电位与氧化还原反应的判断方法。
一、氧化还原反应的概念氧化还原反应是指在化学反应中,原子、离子或分子中的电子从一个物质转移到另一个物质的过程。
其中,氧化是指物质失去电子或氢原子,而还原则是物质获得电子或氢原子。
典型的氧化还原反应包括金属被酸溶解、金属腐蚀、燃烧等。
二、标准电极电位的概念标准电极电位是用来衡量氧化还原反应的强弱的物理量,通常用E0表示。
标准电极电位是指在标准条件下,将某个氧化还原对中的氧化剂或还原剂与标准氢电极(E0=0V)之间建立电池,测得的电位差。
三、标准电极电位的判别在氧化还原反应中,标准电极电位可用于判断反应的进行方向和强弱。
标准电极电位越正,说明反应的氧化能力越强,即越容易接受电子;标准电极电位越负,说明反应的还原能力越强,即越容易失去电子。
判断方法如下:1. 比较标准电极电位:将两个氧化还原对的标准电极电位进行比较,标准电极电位较正的物质是氧化剂,较负的物质是还原剂。
2. 使用电位差计算电动势:将氧化剂和还原剂构成一个电池,通过测量电动势来判断反应的进行方向和强弱。
正电动势表示反应进行,负电动势表示反应不进行。
3. 应用电化学系列:通过查阅电化学系列(即电位序列),可以根据氧化还原电位的大小来判断反应的进行方向和强弱。
在电化学系列中,标准电极电位越正的物质越容易接受电子。
四、应用实例1. 锌和铜的氧化还原反应:锌离子(Zn2+)具有较强的氧化能力,标准电极电位为-0.76V;铜离子(Cu2+)具有较强的还原能力,标准电极电位为+0.34V。
因此,在锌和铜之间,氧化反应发生在锌上,还原反应发生在铜上。
2. 高锰酸钾和硫酸的氧化还原反应:高锰酸钾(KMnO4)是一种强氧化剂,标准电极电位为+1.51V;硫酸(H2SO4)不具备还原能力,标准电极电位为0V。



第八章氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题答案难题解析[TOP]例8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。
(1)(-) Ag,AgCl(s) |HCl |Cl2(100kp),Pt (+)(2)(-) Pb, PbSO4(s)| K2SO4‖KCl| PbCl2(s),Pb (+)(3)(-) Zn | Zn2+‖MnO4-, Mn2+, H+| Pt (+)(4)(-) Ag | Ag+ (c1)‖Ag+(c2) |Ag (+)析将所给原电池拆分为两个电极。
负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。
解(1)正极反应Cl2+2e-→ 2 Cl-此电极为气体电极负极反应Ag+Cl-→ AgCl(s)+e-此电极为金属-难溶盐-阴离子电极电池反应2Ag+Cl2→2AgCl(s) n=2(2)正极反应PbCl2(s)+2e-→Pb+2Cl- 此电极为金属-难溶盐-阴离子电极负极反应Pb+SO42- →PbSO4(s)+2e-此电极为金属-难溶盐-阴离子电极电池反应PbCl2(s) +SO42-→PbSO4(s) +2Cl-n=2(3)正极反应MnO4- +8 H++5e-→Mn2++ 4 H2O 此电极为氧化还原电极负极反应Zn → Zn2++2e-此电极为金属及其离子电极电池反应2MnO4- +16 H++5Zn→2Mn2++8 H2O+5Zn2+ n=10(4)正极反应Ag+(c2) +e- → Ag 此电极为金属及其离子电极负极反应Ag → Ag+ (c1) + e-此电极为金属及其离子电极电池反应Ag+(c2) → Ag+ (c1) n=1例8-2 25℃时测得电池(-) Ag,AgCl(s) |HCl(c) |Cl2(100kp),Pt (+) 的电动势为 1.136V,已知θϕ( Cl2/Cl-)=1.358V, θϕ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。
第八章氧化还原反应与电极电位氧化还原反应(oxidation-reduction reaction or redox reaction)是一类十分重要的化学反应,它广泛存在于化学反应和生命过程中。
氧化还原反应中伴随的能量变化与人们的日常生活、工业生产及生命过程息息相关,如:各种燃料的燃烧、各类电池的使用、电镀工业、金属的腐蚀和防腐、生物的光合作用、呼吸过程、新陈代谢、神经传导、生物电现象(心电、脑电、肌电)等等。
氧化还原反应及电化学是十分重要和活跃的研究领域,具有非常广泛的应用。
本章将介绍氧化还原反应的一般特征;重点讨论电极电位产生的原因、影响电极电位的因素和电极电位对氧化还原反应的影响,并简单介绍与此相关的电位法测定溶液的pH、电化学及生物传感器。
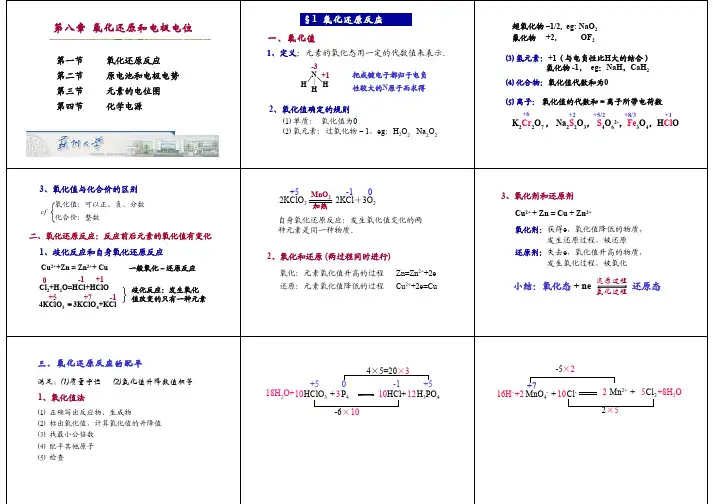
第一节氧化还原反应一、氧化值在18世纪末,人们把与氧化合的反应称为氧化反应,从氧化物中夺取氧的反应称为还原反应。
到19世纪中期,借助化合价的概念回避?人们把化合价升高的过程称为氧化,化合价降低的过程称为还原。
20世纪初,由于化合价的电子理论的发展,人们把失电子的过程称为氧化,得电子的过程称为还原。
例如Fe + Cu2+ = Fe2+ +Cu 的反应中,Fe失电子被氧化,Cu2+得电子被还原。
但是在反应H2(g) + Cl2(g) = 2HCl(g) 中,却没有明显的电子得失关系,因此人们提出用“氧化值”来描述元素的氧化或还原状态以及氧化还原反应中电子的转移关系。
氧化值(oxidation number)又称为氧化数,用来表示元素的原子在单质或化合物中的氧化或还原状态。
1970年IUPAC对其给出的定义是:氧化值是某元素一个原子的荷电数,这种荷电数是假设把每个化学键中的成键电子对指定给电负性较大的原子而求得。
其符号取决于成键原子电负性的相对大小,电负性较大的氧化值为负,电负性较小的氧化值为正,(元素的电负性是原子在分子中吸引成键电子能力的量度,有关它的概念将在第九章原子结构中讨论)。
第八章氧化还原反应与电极电位
一、判断题
1.已知θϕFe2+/Fe=-0.41V,θϕAg+/Ag=0.80V,θϕFe3+/Fe2+=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是( )
A. Ag+,Fe2+
B. Ag+,Fe
C. Fe3+,Fe
D. Fe2+,Ag
E. Fe3+,Fe2+
2.其他条件不变时,能使电对Cr2O72-/Cr3+的电极电位增大的方法是( )
A. 增大pH
B. 降低pH
C. 增大Mn2+浓度
D. 前三个都可以
E. 前三个都不对
3.下列电对中,有关离子浓度减少时,电极电位增大的是( )
A. Cl2/Cl-
B. Sn2+/Sn
C. Fe2+/Fe
D. H+/H2
E. Cu2+/Cu
4.已知θϕ(Fe3+/Fe2+)= 0.77V, θϕ(Fe2+/Fe)= -0.41V, θϕ(Sn4+/Sn2+)= 0.15V, θϕ(Sn2+/Sn)= -0.14V,在标准状态下,下列各组物质中能共存的是( )
A. Fe3+,Fe
B. Fe3+,Sn2+
C. Fe3+,Sn
D. Sn4+,Sn
E. Sn2+,Sn
5.已知θϕMnO4-/Mn2+=1.49V,若其他物质均处于标态,当pH=2时,此电对的电极电位是( )
A. 1.30V
B. 1.03V
C. 1.50V
D. 0.89V
E.1.39V
6.已知θϕ(Cl2/Cl-)= 1.36V, θϕ(I2/I-)= 0.535V, θϕ(Fe3+/Fe2+)= 0.770V, θϕ(Sn4+/Sn2+)= 0.15V,下列四种物质:Cl2,I2,FeCl3,SnCl4 ,在标准状态下按氧化能力由高到低的顺序排列为( )
A. SnCl4, I2, FeCl3, Cl2,
B. Cl2, I2,SnCl4, FeCl3,
C. Cl2,FeCl3,I2,SnCl4,
D. Cl2, I2,FeCl3, SnCl4,
E. FeCl3, Cl2,I2,SnCl4,
7.下列原电池的符号中,书写正确的是( )
A. (-) Zn|Zn2+(c)‖Cu2+(c)|Cu (+)
B. (-) Zn2+(c)|Zn‖Cu2+(c)|Cu (+)
C. (-) Zn|Zn2+(c)‖Cu| Cu2+(c) (+)
D. (-)Zn2+(c)|Zn‖Cu| Cu2+(c) (+)
E. (-) Zn,Zn2+(c)‖Cu2+(c),Cu (+)
答:1B ,2B ,3A ,4E ,5A ,6C ,7A
二、填空题
1.对于 M n++Xe -→M (n-x )+ 的电极反应,若加入M (n-x )+的沉淀剂或络合剂,则此电极的电极电位将 ,M n+的氧化性将 。
2.电池反应Zn+Cu 2+→Cu+Zn 2+。
若只增加[Zn 2+],电池的E 将 ;若只增加Zn 电极的表面积,电池的电动势E 将 。
3.在MnO 4-+8H ++5e - → 2Mn 2+ + 4H 2O 反应中,若使溶液的pH 值增大,其电极电位 ,-4
MnO 的 能力降低。
答:1.增大,增强
2.降低,不变
3.下降,氧化
三、计算题
1.设计一原电池,计算AgCl 的溶度积常数K sp ,并写出原电池的组成式。
已知AgCl(s) + e -
Ag +Cl - V 223.0=θϕ Ag + + e - Ag V 799.0=θϕ
2.已知下列电极反应的标准电极电位为:
Cu 2+( aq) +2e - = Cu( s) ϕθ=+0.3394 V
Cu 2+( aq) +e - = Cu +( aq) ϕθ=+0.1607 V 。
( 1)计算反应 Cu 2+( aq) +Cu( s) = 2 Cu +( aq) 的标准平衡常数K θ; ( 2) 已知 K SP ( CuCl)=1.7×10-7,计算反应:
Cu 2+( aq) +Cu( s)+2Cl -
( aq) = 2 CuCl( s)的标准平衡常数。
3. 将铜片插入盛有0.5mol·L -1CuSO 4溶液的烧杯中,银片插入盛有0.5mol·L -1 AgNO 3溶液的烧杯中,组成一个原电池。
已知θφ (Ag +/Ag) = 0.7996V ,θφ(Cu 2+ /Cu) =0.3402V 。
(1)写出原电池符号;
(2)写出电极反应式和电池反应式;
(3)求该电池的电动势。
解:1.设计以银电极和氯化银电极组成的原电池
(-) Ag(s)|AgNO 3(1mol·L -1)||KCl (1mol·L -1)|AgCl(s)|Ag (+) 正极反应AgCl(s)+e - → Ag +Cl - V 223.0=θϕ
负极反应 Ag - e - → Ag + V 799.0=θϕ
电池反应 AgCl(s) →Ag + + Cl - (此反应的平衡常数即为Ksp )
θ
θθϕϕ还氧-=E = 0.223V -0.799V =-0.576V
05916.0)
576.0(1lg -⨯=K = lgKsp = -9.74
Ksp=1.82×10-10
2. (1)由下面两个电极反应相减得:
2Cu 2+( aq)+2e =2Cu +( aq) (1) Cu 2( aq)+2e =Cu( s ) (2)
可得到 Cu 2+( aq) +Cu (s) = 2 Cu +(aq)
所以用(1)和(2组成电池,且其标准电池电动势为:
E θ= ϕθ (Cu 2+/Cu +)- ϕθ (Cu 2+/Cu)
= 0.1607-0.3 = -0.1787V
根据公式lg K θ = n E θ/0.05916V = -6.037,
所以,K θ= 9.18×10-7
(2) 由下两个反应(3)+(4)相加得到反应 (5)
Cu 2+( aq) +Cu(s) =2 Cu +(aq) (3) 2Cu +( aq) +2Cl -( aq)=2 CuCl (s)
(4) 反应 Cu 2+(aq) +Cu(s)+2Cl -(aq) =2 CuCl(s) (5) 所以有: K 5θ = K 3θ×K 4θ 故该反应得标准平衡常数为 :
K = 9.18×10-7×(1/Ksp (CuCl) )2= 3.2×107
3.(1)(-)Cu | Cu 2+ (0.5 mol·L -1) || Ag + (0.5 mol·L -1) | Ag (+)
(2) 正极反应 Ag + + e - Ag
负极反应Cu 2+ +2e-Cu
①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+
(3)E =φ(Ag +/Ag) -φ(Cu 2+ /Cu)
=θφ(Ag +/Ag) + 0.0592lg[Ag +] -(θφ(Cu 2+ /Cu) + 0.0592/2lg[Cu 2+])
= 0.7996 + 0.0592lg0.5-0.3402-0.0592/2 lg0.5 = 0.4505(V)。