第八章 氧化还原反应与电极电位(大纲)
- 格式:doc
- 大小:106.50 KB
- 文档页数:6

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。


氧化反应的标准电极电位与氧化还原反应的推导氧化还原反应是化学中常见的重要反应之一。
在氧化还原反应中,物质发生氧化的过程称为氧化反应,而同时发生还原的过程称为还原反应。
作为探究氧化还原反应的一个重要指标,标准电极电位在研究中起着重要的作用。
本文将探讨氧化反应的标准电极电位以及氧化还原反应的推导。
1. 标准电极电位标准电极电位是指在标准状态下,电极与溶液中电离浓度均为1mol/L时,测得的电解电位。
标准状态是指所有反应物的活度均为1。
标准电极电位可以通过电位差测量仪器来测量,并被用来评估元素或化合物的氧化还原能力。
2. 氧化反应的标准电极电位氧化反应涉及到被氧化物质失去电子,因此其标准电极电位是正值,表示其具有氧化能力。
例如,标准氢电极的电位被定义为0 V,而其他电极的电位相对于标准氢电极进行比较和测量。
3. 氧化还原反应的推导氧化还原反应的推导可以通过以下步骤进行。
a. 确定氧化和还原反应物首先需要明确参与反应的氧化物质和还原物质。
氧化反应中,物质被氧化,因此被氧化的物质是氧化剂,而还原反应中,物质被还原,因此被还原的物质是还原剂。
b. 确定氧化态和还原态确定氧化反应物和还原反应物的氧化态和还原态。
根据反应物和产物中元素的氧化态的变化来推导反应的方程式。
c. 平衡反应方程式根据确定的氧化态和还原态,平衡氧化还原反应方程式中的反应物和产物的个数。
确保反应方程式中的总电荷和总质量都平衡。
d. 计算电极电位利用标准电极电位表,查找反应中涉及的各个物质的标准电极电位,并按照反应方程式的系数进行计算。
计算得到的标准电极电位之差就是氧化还原反应的标准电极电位。
4. 应用和意义氧化还原反应的标准电极电位可以用来比较和评估不同物质的氧化还原能力。
通过测量不同反应物的标准电极电位,可以推导出一系列反应的相对强弱,从而指导相关实验的设计和反应条件的选择。
此外,标准电极电位的研究对于电化学、电池和腐蚀等领域的发展也具有重要意义。

第八章氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题解答难题解析 [TOP]例 8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。
(1) (-) Ag(s)│AgCl(s) │HCl(sln)│Cl2(100kp)│Pt(s) (+)(2) (-) Pb(s)│PbSO4(s)│K2SO4(sln)‖KCl(sln)│PbCl2(s)│Pb(s) (+)(3) (-) Zn(s)│Zn2+(c1)‖MnO4-(c2), Mn2+(c3), H+(c4)│Pt(s) (+)(4) (-) Ag(s) | Ag+ (c1) ‖Ag+(c2) │Ag(s) (+)分析将所给原电池拆分为两个电极。
负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。
解(1)正极反应 Cl2(g)+2e- → 2 Cl- (aq) 属于气体电极负极反应 Ag(s)+Cl-(aq) → AgCl(s)+e- 属于金属-难溶盐-阴离子电极电池反应 2Ag(s)+ Cl2(g) →2AgCl(s) n=2(2)正极反应 PbCl2(s)+2e- →Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极负极反应 Pb(s)+SO42-(aq) →PbSO4(s)+2e- 属于金属-难溶盐-阴离子电极电池反应 PbCl2(s) +SO42- (aq)→PbSO4(s) +2Cl-(aq) n=2(3)正极反应 MnO4-(aq) +8H+(aq)+5e- →Mn2+(aq)+ 4H2O(l) 属于氧化还原电极负极反应 Zn(s) → Zn2+(aq)+2e- 属于金属-金属离子电极电池反应2MnO4- (aq)+16H+(aq)+5Zn(s)→2Mn2+(aq)+8H2O(l)+5Zn2+ (aq) n=10 (4)正极反应 Ag+(c2) +e- → Ag(s) 属于金属-金属离子电极负极反应 Ag(s) → Ag+ (c1) + e- 属于金属-金属离子电极电池反应 Ag+(c2) → Ag+ (c1) n=1例 8-2 25℃时测得电池 (-) Ag(s)│AgCl(s)│HCl(c)│Cl2(100kp)│Pt(s) (+) 的电动势为1.136V,已知 ( Cl2/Cl-)=1.358V, ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。






第八章氧化还原反应与电极电位氧化还原反应(oxidation-reduction reaction or redox reaction)是一类十分重要的化学反应,它广泛存在于化学反应和生命过程中。
氧化还原反应中伴随的能量变化与人们的日常生活、工业生产及生命过程息息相关,如:各种燃料的燃烧、各类电池的使用、电镀工业、金属的腐蚀和防腐、生物的光合作用、呼吸过程、新陈代谢、神经传导、生物电现象(心电、脑电、肌电)等等。
氧化还原反应及电化学是十分重要和活跃的研究领域,具有非常广泛的应用。
本章将介绍氧化还原反应的一般特征;重点讨论电极电位产生的原因、影响电极电位的因素和电极电位对氧化还原反应的影响,并简单介绍与此相关的电位法测定溶液的pH、电化学及生物传感器。
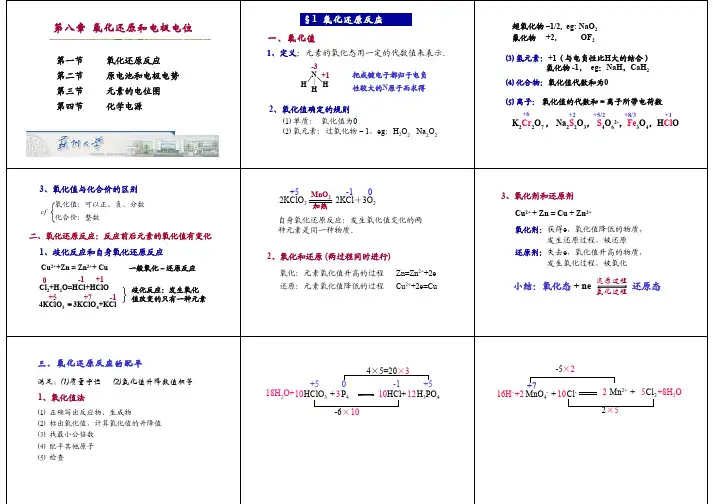
第一节氧化还原反应一、氧化值在18世纪末,人们把与氧化合的反应称为氧化反应,从氧化物中夺取氧的反应称为还原反应。
到19世纪中期,借助化合价的概念回避?人们把化合价升高的过程称为氧化,化合价降低的过程称为还原。
20世纪初,由于化合价的电子理论的发展,人们把失电子的过程称为氧化,得电子的过程称为还原。
例如Fe + Cu2+ = Fe2+ +Cu 的反应中,Fe失电子被氧化,Cu2+得电子被还原。
但是在反应H2(g) + Cl2(g) = 2HCl(g) 中,却没有明显的电子得失关系,因此人们提出用“氧化值”来描述元素的氧化或还原状态以及氧化还原反应中电子的转移关系。
氧化值(oxidation number)又称为氧化数,用来表示元素的原子在单质或化合物中的氧化或还原状态。
1970年IUPAC对其给出的定义是:氧化值是某元素一个原子的荷电数,这种荷电数是假设把每个化学键中的成键电子对指定给电负性较大的原子而求得。
其符号取决于成键原子电负性的相对大小,电负性较大的氧化值为负,电负性较小的氧化值为正,(元素的电负性是原子在分子中吸引成键电子能力的量度,有关它的概念将在第九章原子结构中讨论)。
第八章1 1.1 基本要求 [TOP]氧化还原反应与电极电位掌握离子-电子法配平氧化还原反应式、电池组成式的书写;根据标准电极电位判断氧化还原反应 方向;通过标准电动势计算氧化还原反应的平衡常数;电极电位的 Nernst 方程、影响因素及有关 计算。
1.2 熟悉氧化值的概念和氧化还原反应的定义,熟练计算元素氧化值;熟悉原电池的结构及正负极反应 的特征;熟悉标准电极电位概念;熟悉电池电动势与自由能变的关系。
1.3 了解电极类型、电极电位产生的原因;了解电位法测量溶液 pH 的原理及 pH 操作定义;了解电化学 与生物传感器及其应用。
2 重点难点 [TOP]2.1 重点 2.1.1 标准电极电位表的应用。
2.1.2 电极反应与电池反应,电池组成式的书写。
2.1.3 通过标准电动势计算氧化还原反应的平衡常数。
2.1.4 电极电位的 Nernst 方程、影响因素及有关计算。
2.2 难点 2.2.1 电极电位的产生 2.2.2 用设计原电池的方法计算平衡常数 2.2.3 Nernst 方程的推导3讲授学时 建议 6 学时[TOP]4内容提要[TOP]第一节第二节第三节第四节第五节4.1 第一节 氧化还原反应 4.1.1 氧化值1氧化值是某元素原子的表观荷电数,这种荷电数是假设把化学键中的电子指定给电负性较大的原子 而求得。
确定元素氧化值的规则:1)单质中原子的氧化值为零。
2)单原子离子中原子的氧化值等于离 子的电荷。
3)氧的氧化值在大多数化合物中为-2,但在过氧化物中为-1。
4)氢的氧化值在大多数化合 物中为+1,但在金属氢化物中为-1。
5)卤族元素:氟的氧化值在所有化合物中均为-1,其它卤原子的 氧化值在二元化合物中为-1,但在卤族的二元化合物中,列周期表靠前的卤原子的氧化数为-1;在含氧 化合物中按氧的氧化值为-2 决定。
6)电中性化合物中所有原子的氧化值之和为零。
4.1.2 氧化还原反应 元素的氧化值发生了变化的化学反应称为氧化还原反应。
氧化还原反应可被拆分成两个半反应。
半反应中元素的氧化值升高称为氧化,元素的氧化值降低称为还原。
氧化还原反应中,氧化反应和还原 反应同时存在,还原剂被氧化,氧化剂被还原,且得失电子数相等。
半反应的通式为 或 氧化型 + ne Ox + ne-还原型 Red式中 n 为得失电子数,氧化型(Ox)包括氧化剂及相关介质,还原型(Red)包括还原剂及相关介质。
氧化 型物质及对应的还原型物质称为氧化还原电对(Ox/Red) 。
4.1.3 氧化还原反应方程式的配平 离子-电子法(或半反应法)配平氧化还原反应方程式的方法是:1)写出氧化还原反应的离子方程 式。
2)将离子方程式拆成氧化和还原两个半反应。
3)根据物料平衡和电荷平衡,分别配平半反应(注意 不同介质中配平方法的差异) 。
4)根据氧化剂和还原剂得失电子数相等,找出两个半反应的最小公倍数, 并把它们配平合并。
5)可将配平的离子方程式写为分子方程式。
4.2 第二节 原电池与电极电位 4.2.1 原电池 将化学能转化成电能的装置称为原电池。
原电池中电子输出极为负极;电子输入极为正极。
正极发 生还原反应;负极发生氧化反应,正极反应和负极反应构成电池反应,即氧化还原反应。
常用的电极有金属-金属离子电极、气体电极、金属-金属难溶盐-阴离子电极、氧化还原电极四种 类型。
将两个电极组合起来构成一个原电池,原电池可用电池组成式表示。
习惯上把正极写在右边,负极 写在左边;用“|”表示两相之间的界面;中间用“‖”表示盐桥。
如 Zn-Cu 电池的电池组成式: (-) Zn(s)│Zn (c1) ‖Cu (c2)│Cu(s) 4.2.2 电极电位的产生和电池电动势2+ 2+[TOP](+)2溶解 M(s) 析出 在极板上Mn+(aq) +ne-在溶液中 留于极板上电极电位的产生可用双电层理论解释。
当金属浸入其相应盐的溶液中,存在如下平衡: 平衡时,若金属溶解的趋势大于金属离子析出的趋势,则金属极板表面上会带有过剩的负电荷,等 量的正电荷将分布在溶液中。
由于正负电荷的静电吸引,使溶液中的正电荷较多地集中在金属极板附近 的溶液中,形成了双电层结构,从而产生了电位差。
电极电位用符号 ϕ Ox/Red 表示。
电极电位的大小与金 属的本性、 温度和金属离子的浓度(或活度)有关。
原电池正极与负极的电极电位差称为原电池的电动势, 符号 E:E = ϕ + - ϕ - 。
电极电位和电动势的单位都是伏特(V)。
4.2.3 标准电极电位 标准氢电极(SHE) Pt(s) | H2(100kPa) |H (a=1), 并规定在 298.15K,氢气分压 100kPa,氢离 : 子浓度 1 mol·L-1 +(严格地是活度 1)时, ϕ SHE = 0.0000V。
在标准状态下,将待测电极与 SHE 组成原电池(SHE 为负极),测得原电池的电动势等于待测电极的 标准电极电位。
根据电极电位的高低可判断氧化还原能力的相对强弱:(1) 电极电位愈低,电对中还原型物质失电 子的能力愈强,是较强的还原剂;电极电位愈高,电对中氧化型物质得电子的能力愈强,是较强的氧化 剂。
(2) 较强氧化剂所对应的还原剂的还原能力较弱,较强还原剂所对应的氧化剂的氧化能力较弱。
4.3 第三节 电池电动势与化学反应 Gibbs 自由能 4.3.1 电池电动势与化学反应 Gibbs 自由能的关系 在等温、等压可逆过程中(可逆电池) ,系统 Gibbs 自由能的降低值与电池电动势之间存在如下关 系: [TOP]∆ r Gm = -nFE式中,F 为法拉第常数,F=96 485C·mol 。
n 为电池反应中电子转移数。
当电池中各物质均处于标准态 时,上式可表示为 ∆ r Gm = - nF E θ 。
θ-14.3.2 用电池电动势判断氧化还原反应的自发性 在等温等压标准态下,氧化还原反应自发性的判据:θ ∆ r Gm <0, θ ∆ r Gm >0, θ ∆ r Gm =0,E θ >0,反应正向自发进行; E θ <0,反应逆向自发进行; E θ =0,反应达到平衡。
3同理, ∆ r Gm 和 E 可作为非标准态下的氧化还原反应自发性的判据。
4.3.3 电池标准电动势和平衡常数θ θ 氧化还原反应的平衡常数可根据关系式 RTln K = nF E 计算。
在 298.15K 下,将 R =8.314J·K ·mol , F =96 485 C·mol 代入上式得:-1-1-1lg K θ =nE θ 0.05916V6θ θ 式中,n 是配平的氧化还原反应方程式中转移的电子数。
E 越大,反应进行的越完全。
当 K >10 时,可以认为反应进行的已相当完全。
有些平衡常数,如:酸(碱)质子转移平衡常数 Ka(Kb)、水的离子积常数 Kw、溶度积常数 Ksp、配位平 衡稳定常数 Ks 等,若它们的平衡可以由两个电极反应式组成,同样可用电池的标准电动势计算其平衡常 数。
4.4 第四节 电极电位的 Nernst 方程式及影响电极电位的因素 4.4.1 电极电位的 Nernst 方程式 对电池反应: [TOP]aOx1+bRed2其电池电动势的 Nernst 方程式为:dRed1+eOx2RT cRe d1 cOx2 E=E − ln nF ca cbθ Ox1 Re d 2de在 298.15K 时:0.05916V cRe d1 cOx2 E=E − lg a b n c cθ Ox1 Re d 2de对电极反应:pOx + ne其电极电位的 Nernst 方程式为:qRedRT ϕ (Ox/Red) = ϕ (Ox/Red) + ln cOx nF cqθpRe d在 298.15K 时:40.05916V cOx ϕ (Ox/Red) = ϕ (Ox/Red) + lg q n cθpRe d应用 Nernst 方程式应注意: (1) 当 Red 及 Ox 为气体时,其分压应除以标准态压力 100kPa;若是固体、纯液体或溶剂,则其浓 度视为常数,不列入 Nernst 方程式。
(2) Nernst 方程式中,各物质的浓度或分压应以其反应式中化学计量系数为幂指数。
(3) 对于有 H 或 OH 参与的氧化还原反应,计算时 H 或 OH 的浓度也应列入 Nernst 方程式。
4.4.2 电极溶液中物质浓度对电极电位的影响 由 Nernst 方程式可知,电极中各物质的浓度对电极电位产生影响,若 H 、OH 作为介质参加反应, 也会对电极电位产生影响。
氧化还原电对中氧化型或还原型物质生成沉淀、弱酸、弱碱、配合物等,将 使其浓度降低,也使电极电位发生变化。
判断非标准态下的氧化还原反应的方向或氧化剂、还原剂的相对强弱时,应根据由 Nernst 方程式 计算出来的电池的电动势或电极电位来判断。
4.5 第五节 电位法测定溶液的 pH [TOP]+ + + -应用电位法测定溶液的 pH,应有一个参比电极和一个指示电极。
参比电极的电极电位已知且性能 稳定,常用饱和甘汞电极(SCE) 。
指示电极的电极电位与被测 H 离子浓度(活度)有关,常用玻璃电极, 其电极电位符合 Nernst 方程式:+ϕ玻 = K玻 +RT 2.303RT ln a (H + ) = K 玻 − pH F F式中 K 玻 是未知的常数,可通过用标准 pH 缓冲溶液定位加以消除。
玻璃电极、饱和甘汞电极分别与标准 pH 缓冲液或待测 pH 溶液组成原电池: (-) 玻璃电极│标准 pH 缓冲液 │SCE (+) 和 (-) 玻璃电极│待测 pH 溶液 │SCE (+)分别测定两个电池的电动势,从而求得待测溶液的 pH:pH = pH s +( E − Es ) F 2.303RT式中 pHs 为标准缓冲溶液的 pH,Es 为标准缓冲溶液所组成原电池的电动势;E 为待测溶液所组成原 电池的电动势。
T 为测定时的温度。
上式称为 pH 操作定义。
56。