第八章 氧化还原反应与电极电位
- 格式:doc
- 大小:613.00 KB
- 文档页数:15

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。






第八章氧化还原反应和电极电位一、选择题1.下列关于氧化值的叙述中,不正确的是()A.单质的氧化值为0B.氧气的氧化值为-2C.在多原子分子中,各元素原子的氧化值的代数和等于0D.氧化值可以是整数或分数2.已知ϕ°(Fe3+/Fe2+)=0.77V,ϕ°(Cu2+/Cu)=0.34V,ϕ°(Sn4+/Sn2+)=0.15V,ϕ°(Fe2+/Fe)=-0.41V。
在标准态下,下列反应能进行的是()A.2Fe3++Cu=2Fe2++Cu2+B.Sn4++Cu=Sn2++Cu2+C.Cu+Fe2+=Cu2++FeD.Sn4++2Fe2+=Sn2++2Fe3+3.已知ϕ°(Zn2+/Zn)=-0.76V,ϕ°(Ag+/Ag)=0.80V,将电对Zn2+/Zn和Ag+/Ag组成原电池,该原电池的标准电动势为()。
A.2.36VB.0.04VC.0.84VD.1.56V4.对于电池反应Cu2++Zn=Cu+Zn2+,下列说法正确的是()。
A.当c(Cu2+)=c(Zn2+)时,反应达到平衡B.当ϕ°(Cu2+/Cu)=ϕ°(Zn2+/Zn)时,反应达到平衡C.当ϕ(Cu2+/Cu)=ϕ(Zn2+/Zn)时,反应达到平衡D.当原电池的标准电动势等于零时,反应达到平衡5.已知ϕ°(Fe2+/Fe)=-0.41V,ϕ°(Ag+/Ag)=0.80V,ϕ°(Fe3+/Fe2+)=0.77V,在标准态下,电对Fe2+/Fe、Ag+/Ag和Fe3+/Fe2+中,最强的氧化剂和最强的还原剂分别是()A.Ag+、Fe2+B.Ag+、FeC.Fe3+、AgD.Fe2+、Fe2+6.已知ϕ°(F2/F-)>ϕ°(Cl2/Cl-)>ϕ°(Br2/Br-)>ϕ°(Fe3+/Fe2+)>ϕ°(I2/I-)。



第八章氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题答案难题解析[TOP]例8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。
(1)(-) Ag,AgCl(s) |HCl |Cl2(100kp),Pt (+)(2)(-) Pb, PbSO4(s)| K2SO4‖KCl| PbCl2(s),Pb (+)(3)(-) Zn | Zn2+‖MnO4-, Mn2+, H+| Pt (+)(4)(-) Ag | Ag+ (c1)‖Ag+(c2) |Ag (+)析将所给原电池拆分为两个电极。
负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。
解(1)正极反应Cl2+2e-→ 2 Cl-此电极为气体电极负极反应Ag+Cl-→ AgCl(s)+e-此电极为金属-难溶盐-阴离子电极电池反应2Ag+Cl2→2AgCl(s) n=2(2)正极反应PbCl2(s)+2e-→Pb+2Cl- 此电极为金属-难溶盐-阴离子电极负极反应Pb+SO42- →PbSO4(s)+2e-此电极为金属-难溶盐-阴离子电极电池反应PbCl2(s) +SO42-→PbSO4(s) +2Cl-n=2(3)正极反应MnO4- +8 H++5e-→Mn2++ 4 H2O 此电极为氧化还原电极负极反应Zn → Zn2++2e-此电极为金属及其离子电极电池反应2MnO4- +16 H++5Zn→2Mn2++8 H2O+5Zn2+ n=10(4)正极反应Ag+(c2) +e- → Ag 此电极为金属及其离子电极负极反应Ag → Ag+ (c1) + e-此电极为金属及其离子电极电池反应Ag+(c2) → Ag+ (c1) n=1例8-2 25℃时测得电池(-) Ag,AgCl(s) |HCl(c) |Cl2(100kp),Pt (+) 的电动势为 1.136V,已知θϕ( Cl2/Cl-)=1.358V, θϕ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。
第八章氧化还原反应与电极电位氧化还原反应(oxidation-reduction reaction or redox reaction)是一类十分重要的化学反应,它广泛存在于化学反应和生命过程中。
氧化还原反应中伴随的能量变化与人们的日常生活、工业生产及生命过程息息相关,如:各种燃料的燃烧、各类电池的使用、电镀工业、金属的腐蚀和防腐、生物的光合作用、呼吸过程、新陈代谢、神经传导、生物电现象(心电、脑电、肌电)等等。
氧化还原反应及电化学是十分重要和活跃的研究领域,具有非常广泛的应用。
本章将介绍氧化还原反应的一般特征;重点讨论电极电位产生的原因、影响电极电位的因素和电极电位对氧化还原反应的影响,并简单介绍与此相关的电位法测定溶液的pH、电化学及生物传感器。
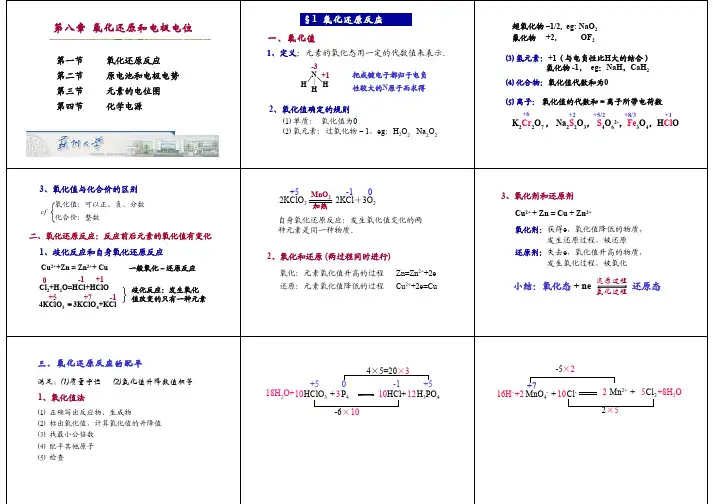
第一节氧化还原反应一、氧化值在18世纪末,人们把与氧化合的反应称为氧化反应,从氧化物中夺取氧的反应称为还原反应。
到19世纪中期,借助化合价的概念回避?人们把化合价升高的过程称为氧化,化合价降低的过程称为还原。
20世纪初,由于化合价的电子理论的发展,人们把失电子的过程称为氧化,得电子的过程称为还原。
例如Fe + Cu2+ = Fe2+ +Cu 的反应中,Fe失电子被氧化,Cu2+得电子被还原。
但是在反应H2(g) + Cl2(g) = 2HCl(g) 中,却没有明显的电子得失关系,因此人们提出用“氧化值”来描述元素的氧化或还原状态以及氧化还原反应中电子的转移关系。
氧化值(oxidation number)又称为氧化数,用来表示元素的原子在单质或化合物中的氧化或还原状态。
1970年IUPAC对其给出的定义是:氧化值是某元素一个原子的荷电数,这种荷电数是假设把每个化学键中的成键电子对指定给电负性较大的原子而求得。
其符号取决于成键原子电负性的相对大小,电负性较大的氧化值为负,电负性较小的氧化值为正,(元素的电负性是原子在分子中吸引成键电子能力的量度,有关它的概念将在第九章原子结构中讨论)。
氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题解答难题解析[TOP]例8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。
(1)(-) Ag(s)│AgCl(s) │HCl(sln)│Cl2(100kp)│Pt(s) (+)(2)(-) Pb(s)│PbSO4(s)│K2SO4(sln)‖KCl(sln)│PbCl2(s)│Pb(s) (+)(3)(-) Zn(s)│Zn2+(c1)‖MnO4-(c2), Mn2+(c3), H+(c4)│Pt(s) (+)(4)(-) Ag(s) | Ag+ (c1) ‖Ag+(c2) │Ag(s) (+)分析将所给原电池拆分为两个电极。
负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。
解(1)正极反应Cl2(g)+2e-→ 2 Cl-(aq) 属于气体电极负极反应Ag(s)+Cl-(aq) → AgCl(s)+e-属于金属-难溶盐-阴离子电极电池反应2Ag(s)+ Cl2(g) →2AgCl(s) n=2(2)正极反应PbCl2(s)+2e-→Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极负极反应Pb(s)+SO42-(aq)→PbSO4(s)+2e-属于金属-难溶盐-阴离子电极电池反应PbCl2(s) +SO42-(aq)→PbSO4(s) +2Cl-(aq) n=2(3)正极反应MnO4-(aq) +8H+(aq)+5e-→Mn2+(aq)+ 4H2O(l) 属于氧化还原电极负极反应Zn(s) → Zn2+(aq)+2e-属于金属-金属离子电极电池反应2MnO4- (aq)+16H+(aq)+5Zn(s)→2Mn2+(aq)+8H2O(l)+5Zn2+ (aq)n=10 (4)正极反应Ag+(c2) +e- → Ag(s) 属于金属-金属离子电极负极反应Ag(s) → A g+ (c1) + e-属于金属-金属离子电极电池反应Ag+(c2) → Ag+ (c1) n=1例8-2 25℃时测得电池(-) Ag(s)│AgCl(s)│HCl(c)│Cl2(100kp)│Pt(s) (+) 的电动势为ϕ( Cl2/Cl-)=1.358V, θϕ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。
1.136V,已知θϕAgCl/Ag 。
其分析首先根据电池电动势和已知的标准电极电位,由Nernst方程求出θ次:AgCl的平衡AgCl(s)Ag+ (aq)+ Cl-(aq),方程式两侧各加Ag:AgCl(s) + Ag(s)Ag + (aq)+ Cl -(aq) + Ag(s)AgCl 与产物Ag 组成AgCl/Ag 电对;反应物Ag 与Ag +组成Ag +/Ag 电对。
AgCl(s)的溶度积常数为:V05916.0lg θsp nE K ==V 05916.0)(θ/Ag Ag θAgCl/Ag +-ϕϕn 。
解 由电池表达式:正极反应 Cl 2 (g)+ 2e - → 2 Cl -(aq),-/Cl Cl 2ϕ=θ/Cl Cl 2-ϕ+20.05916V lg 2Cl ][Cl 2-P 负极反应 Ag(s) + Cl -(aq) → AgCl(s) + e -,AgCl/Ag ϕ=θAgCl/Ag ϕ+20.05916V lg2][Cl 1- 电池反应 Cl 2(g) + 2Ag(s) → 2AgCl(s)E =-/Cl Cl2ϕ-AgCl/Ag ϕ =(θ/Cl Cl 2-ϕ+20.05916V lg 2Cl ][Cl 2-P )-(θAgCl/Ag ϕ+20.05916V lg 2][Cl 1-) =1.136V ,将θ/Cl Cl 2-ϕ和2Cl P 数据带入θAgCl/Ag ϕ=θ/Cl Cl 2-ϕ-1.136 V =1.358 V -1.136 V =0.222V , 又由 AgCl(s) + Ag Ag + + Cl - + AgV 05916.0lg θsp nE K ==V05916.0)(θ/AgAg θAgCl/Ag +-ϕϕn =(0.222-0.799 6)V/0.059 16V =-9.76 K sp (AgCl) = 1.74×10-10例 8-3 在Ag +、Cu 2+离子浓度分别为1.00×10-2mol·L -1和1.00mol·L -1的溶液中加入铁粉,哪一种金属离子先被还原析出?当第二种金属离子被还原析出时,第一种金属离子在溶液中的浓度为多少?已知θϕ( Cu 2+/Cu)=0.341 9V ,θϕ(Ag +/Ag)=0.799 6V 。
分析 首先根据电极电位判断物质氧化性或还原性的相对强弱。
氧化能力强的氧化型物质将首先被还原。
随着反应进行,被还原金属离子浓度降低,电极电位减小,当减小到与第二种金属离子的电极电位相等时,第二种金属离子才能被还原。
解 /A g Ag +ϕ= θ/Ag Ag +ϕ+ 0.059 16Vlog[Ag +] = 0.799 6V + 0.059 16Vlg(1.00×10-2) = 0.681 3 V/Cu Cu 2+ϕ= θ/Cu Cu 2+ϕ= 0.341 9 V由于/Ag Ag +ϕ>/Cu Cu 2+ϕ,Ag +是较强氧化剂,当加入还原剂铁粉时首先被还原。
当/Ag Ag +ϕ=/Cu Cu 2+ϕ时,Cu 2+离子被还原。
则/Ag Ag +ϕ= 0.799 6V+ 0.059 16Vlg[Ag +] = 0.341 9V[Ag +] = 1.82×10-8(mol·L -1)例8-4 298K 时电池 (-) Pt(s)│H 2(100kp)│NaOH(sln)│HgO(s)│Hg(l) (+)的θΕ=0.926V ,反应H 2(g)+21O 2(g) = H 2O(l)的△r H m θ= -285.84kJ ·mol -1。
又:H 2(g) O 2(g) H 2O(l) Hg(l) HgO(s)S θ/J·mol -1·K -1 130.5 205.03 69.94 77.4 70.29试求分解反应 HgO(s)Hg(l) +21O 2(g)(1) 在298K 时氧的平衡分压;(2) 假定反应热与温度无关,HgO 在空气中能稳定存在的最高温度是多少?解 给定的电池反应:HgO(s)+ H 2 → Hg(l) +H 2O(l) 且n =2 ……(1式)△r G m θ= -nFE θ= -2×96 500C·mol -1×0.926V =-178 718 J·mol -1由 H 2(g) + 21O 2(g)=H 2O(l) ……(2式)△r G m θ[H 2O (l)]=△r H m θ-T ×△r S m θ=-285 840J·mol -1-298K×(69.94-130.5 -21×205.03) J·mol -1·K -1=-237 244 J·mol -11式-2式得 HgO(s) → Hg(l) + 21O 2(g) ……(3式)△r G m θ=-178 718 J·mol -1-(-237 244 J·mol -1)=58 526 J·mol -1(1) 由 △r G m θ=-RT ln K p ,ln K p = -△r G m θ/RT = -58 526 J·mol -1/(8.314 J·mol -1·K -1×298K) = -23.62K p =5.5×10-11=2O p2O p = K p 2=3.03×10-21atm = 3.07×10-19kPa(2) 反应 HgO(s) → Hg(l) + 21O 2(g) 的△r S m θ =77.4 J·mol -1·K -1+21×205.03 J·mol -1·K -1-70.29 J·mol -1·K -1 =109.6 J·mol -1·K -1 △r H m θ = △r G m θ + T △r S m θ =58 526 J·mol -1+298K×109.6 J·mol -1·K -1 = 91 187 J·mol -1 当HgO 在空气中能稳定存在时,2O p =0.2 atm ,K p =2O p = 0.447 再由 12ln K K = R T T T T H r )()(1212θm ⨯-∆ 11105.5447.0ln -⨯=11221K mol J 314.8)K 298()K 298(mol J 91187---⋅⋅⨯⨯-⨯⋅T T计算得 T 2=784.2K学生自测题 [TOP] 判断题 选择题 填空题 问答题 计算题一、判断题(对的打√,错的打×)1. CH 4中C 与4个H 形成四个共价键,因此C 的氧化值是4。
( )2. 浓差电池Ag|AgNO 3(c 1)||AgNO 3(c 2)|Ag ,c 1< c 2, 则左端为负极。
( )3. 组成原电池的两个电对的电极电位相等时,电池反应处于平衡状态。
( )4. 氢电极的电极电位是0.0000伏。
( )5. 增加反应I 2 + 2e - 2I -中有关离子的浓度,则电极电位增加。
( )二、选择题(将每题一个正确答案的标号选出) [TOP]1.下列关于氧化值的叙述中,不正确的是 () A. 单质的氧化值为0 B. 氧的氧化值一般为-2C. 氢的氧化值只能为+1D. 氧化值可以为整数或分数E. 在多原子分子中,各元素的氧化值的代数和为02.下列原电池中,电动势最大的是 ()A. (-) Zn|Zn 2+(c )‖Cu 2+(c )|Cu (+)B. (-) Zn|Zn 2+(0.1c )‖Cu 2+(0.2c )|Cu (+)C. (-) Zn|Zn 2+(c )‖Cu 2+(0.1c )|Cu (+)D. (-) Zn|Zn 2+(0.1c )‖Cu 2+(c )|Cu (+)E. (-) Zn|Zn 2+(2c )‖Cu 2+(c )|Cu (+)3.已知θϕ(Zn2+/Zn)=-0.76V,θϕ(Ag+/Ag)=0.80V,将这两电对组成原电池,则电池的标准电动势为( )A. 2.36VB. 0.04VC. 0.84VD. 1.56VE. 1.18V4.对于电池反应Cu2+ + Zn=Cu + Zn2+,下列说法正确的是()A.当c(Cu2+)=c(Zn2+)时,电池反应达到平衡。