各种细胞转染方法比较
- 格式:docx
- 大小:20.11 KB
- 文档页数:2

细胞转染实验总结引言细胞转染是生物学研究中常用的实验技术,用于将外源DNA、RNA或蛋白质引入到目标细胞中。
通过细胞转染,可以实现基因表达、基因敲除、蛋白质定位等多种研究目的。
本文总结了细胞转染实验的基本原理、常用方法和注意事项。
基本原理细胞转染实验的基本原理是通过物理或化学方法将外源DNA、RNA或蛋白质传递到目标细胞内。
细胞内的转染物质可以在细胞内进行表达、干扰或定位,从而实现对目标细胞功能的研究。
常见的细胞转染方法包括:1.电穿孔法:通过应用电流使细胞膜发生临时孔洞,从而使转染物质进入细胞内。
2.化学转染法:利用聚合物、脂质体等化学物质,将目标物质载体化,并与细胞膜结合,实现内源化学转染。
3.病毒载体介导转染法:利用病毒(如腺病毒、逆转录病毒等)作为载体,传递目标物质到细胞内。
常用方法1. 电穿孔法电穿孔法是细胞转染中常用的物理方法之一。
通过应用高电压或脉冲电场,可以使细胞膜发生临时性孔洞,从而使外源DNA、RNA或蛋白质进入细胞内。
常用的电穿孔方法包括:•电转染:将转染物质与细胞悬浮液混合后施加电脉冲,使细胞膜发生孔洞并吸收转染物质。
•静电转染:将转染物质与带正电荷的载体(如聚乙烯亚胺)混合后,与带负电荷的细胞膜相互吸引,从而将转染物质导入细胞内。
2. 化学转染法化学转染法是一种通过化学物质介导的细胞转染方法。
常用的化学转染法有:•使用聚合物:聚合物(如聚乙烯亚胺、聚合丙烯酸等)能与转染物质结合成复合物,使其稳定且易于细胞摄取。
•脂质体转染:脂质体是由磷脂、胆固醇等成分构成的脂质双层结构,可以包裹转染物质形成脂质体-转染物复合物,通过与细胞膜融合实现内源转染。
3. 病毒载体介导转染法病毒载体介导转染法是细胞转染中较常用的方法之一。
常见的病毒载体包括:•腺病毒:腺病毒是一种双链DNA病毒,可以携带大片段的外源DNA,并有效地传递到目标细胞内。
•逆转录病毒:逆转录病毒(如 lentivirus、retrovirus等)可以将外源RNA逆转录成DNA,然后整合到宿主细胞基因组中。

各种转染方法比较
转染是一种常见的基因表达技术,在微生物、植物、动物等生物的基
因组研究与分析中被广泛应用。
它能够将外源DNA片段引入生物体,从而
产生基因表达,使得目的基因被特定的染色体位置激活。
此外,在转染中
作为功能基因的外源基因,可以约束提示其他的基因表达。
目前,转染在科学领域的应用众多,主要有包二聚体转染、质粒转染、酶联转染、质粒转化、脂质体转染、病毒转染等几种技术。
1、包二聚体转染
包二聚体转染是由三部分组成:DNA片段,10%二聚体和CaCl2溶液,将需要转染的DNA片段溶解在CaCl2溶液中,添加二聚体并调节pH值,
即可形成包二聚体复合体,将复合体注入细胞内,从而达到转染目的。
应
用包二聚体的转染方法可以很好地穿越细胞膜,可以达到突变外源基因的
目的,并且细胞损伤小,可以获得相对高的转染能力。
2、质粒转染
质粒转染是一种常见的转染技术,它是由PEG6000、KCl、CaCl2等混
合物组成,将要转染的DNA与混合物结合,然后把质粒-DNA复合物注入
细胞内,即可转染。

细胞转染的技巧细胞转染是研究细胞分子生物学的关键技术之一,广泛应用于基因表达、基因敲除和功能分析等领域。
本文将详细介绍细胞转染的原理、方法和优化技巧。
细胞转染的原理主要基于外源DNA的纳入细胞内,并表达目的基因。
目前常用的转染方法包括化学法、电穿孔法、病毒介导法和基因枪法等。
一、化学法化学法是最常用的细胞转染方法之一,其基本原理是通过化学试剂破坏细胞膜屏障,使外源DNA能够进入细胞内。
常用的转染试剂包括聚乙烯亚胺(Polyethylenimine, PEI)、脂质体和阳离子聚合物等。
在化学转染过程中,需要注意以下几个关键环节:1. 细胞密度:化学转染对细胞密度有一定的要求,通常细胞密度应保持在80%~90%的对数生长期,以保证转染效果。
2. 转染试剂的浓度和比例:不同的转染试剂适用于不同的细胞系,需要根据实验需求进行优化。
一般情况下,转染试剂的浓度和DNA的比例为1:3~6。
3. 转染时间和转染条件:化学转染的时间和条件也需要进行优化。
过短的转染时间会导致转染效率低,而过长的转染时间可能会对细胞造成毒性影响。
二、电穿孔法电穿孔法通过电场脉冲的作用使细胞膜发生短暂的孔洞形成,从而实现外源DNA的转染。
电穿孔法具有转染效率高、转染速度快等优点,但对细胞需求较高,且操作较为繁琐。
在电穿孔转染过程中,需要注意以下几个环节:1. 电脉冲的参数:电脉冲参数包括电压、脉冲宽度和脉冲数等,需要根据细胞类型和实验需求进行优化。
2. 转染缓冲液的配方:转染缓冲液通常包含含有机磷盐的缓冲液或无机盐溶液,可用于增加细胞的导电性和缓解电穿孔过程中对细胞的损伤。
3. 转染后的细胞培养:电穿孔转染后,应及时将细胞转移到无血清培养基中,以减少电穿孔对细胞的影响。
三、病毒介导法病毒介导法是一种高效、稳定的转染方法,常用于长期表达和基因敲除实验。
病毒载体(如腺病毒、逆转录病毒等)可携带外源DNA进入细胞并整合到基因组中,从而实现目的基因的表达。

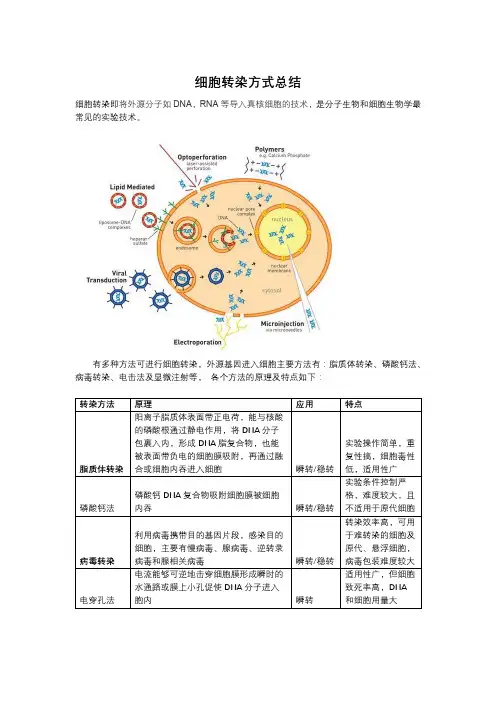
细胞转染方式总结
细胞转染即将外源分子如DNA,RNA等导入真核细胞的技术,是分子生物和细胞生物学最常见的实验技术。
有多种方法可进行细胞转染,外源基因进入细胞主要方法有:脂质体转染、磷酸钙法、病毒转染、电击法及显微注射等,各个方法的原理及特点如下:
利用脂质体转染试剂及病毒感染是最为常见的讲外源基因导入细胞的方法,转染试剂用量大,可以说是基础科研的必备试剂之一。
但鉴于进口试剂成本支出高,那物美价廉的国货转染试剂是否存在呢?
其实国产与进口试剂的pk一直源源不断,大多进口试剂以质量优,口碑好占据上风,
国产试剂也经历了数十年的发展,
深知科研工作的艰辛与不易,在共同为科研事业奋斗的出发点下,国内的科研公司也做了很多努力。
汉恒生物自主研发的转染试剂LipoFiter推出已有6年,受到了很多科研工作者的认可,汉恒实验室建立了IOS9001质量体系,拥有中科院博士研发团队,目前使用LipoFiter发表的文献多达数百篇(部分见后文)。
18年汉恒推出了第三代转染试剂:LipoFiter 3,经验证,和市面上常见的一些进口试剂相比,操作简单毒性低,感染效率更高。
附:。

细胞转染的原理一、细胞转染的基本概念细胞转染是指将外源性DNA或RNA等物质导入到细胞内,以达到改变细胞基因表达或功能的目的。
它是生物学研究中常用的技术手段之一,广泛应用于基因治疗、药物筛选和基因功能研究等领域。
二、细胞转染的方法1. 化学法:通过化学试剂(如聚乙烯醇、离子脂质体等)将DNA或RNA导入到细胞内。
这种方法简单易行,但毒性较大且效率不高。
2. 物理法:通过机械冲击(如电穿孔)、高压注射、微注射等方式将DNA或RNA直接注入到细胞内。
这种方法效率较高,但操作复杂且对细胞有一定伤害。
3. 病毒载体法:利用病毒作为载体将DNA或RNA导入到细胞内。
这种方法效率高,但存在安全隐患和限制性较大。
三、化学法转染原理1. 离子脂质体介导转染离子脂质体是由阳离子表面活性剂和阴离子脂质组成的复合物,具有良好的生物相容性和可生物降解性。
在转染过程中,DNA或RNA与离子脂质体形成复合物,通过静电作用与细胞膜结合并进入细胞内。
此外,离子脂质体还能促进细胞内吞作用和溶酶体逃逸,提高转染效率。
2. 聚乙烯醇介导转染聚乙烯醇(PEI)是一种阳离子聚合物,在水中能形成稳定的颗粒。
在转染过程中,PEI与DNA或RNA形成复合物,通过静电作用与细胞膜结合并进入细胞内。
PEI不仅能促进细胞内吞作用和溶酶体逃逸,还能与核糖体结合并促进基因表达。
四、化学法转染优缺点1. 优点:简单易行、操作方便、不需要专门设备。
2. 缺点:毒性较大、效率低、对不同类型的细胞有一定限制。
五、物理法转染原理1. 电穿孔法电穿孔法利用电场作用使细胞膜通透,形成微小孔道,从而将DNA或RNA导入到细胞内。
电穿孔法的优点是操作简单、效率高,但缺点是对细胞有一定伤害。
2. 高压注射法高压注射法是通过高压气流将DNA或RNA直接注入到细胞内。
这种方法效率高,但对细胞有较大的伤害。
3. 微注射法微注射法是在显微镜下使用微针将DNA或RNA直接注入到单个细胞内。

各种转染方法比较不同的实验室转染方法选择会依赖于多个相关因素,如目标细胞类型、转染效率、细胞毒性、需求的表达时间、实验的规模和预算等。
以下是一些常见的转染方法的比较:1. 离子交换法(Calcium phosphate transfection)离子交换法是最早开发和使用的转染方法之一、它使用磷酸钙和DNA或RNA的复合物在细胞表面形成凝析沉淀物。
该方法简单、经济且较为普遍,适用于许多细胞类型。
然而,它的转染效率较低,存在较多的细胞毒性。
2. 迷走转染法(Lipofection)迷走转染法是当前最常用的转染技术之一,通过磷脂体(例如Lipofectamine)与质粒DNA形成复合物。
该方法转染效率高,而且适用于许多类型的细胞,包括哺乳动物和非哺乳动物。
然而,迷走转染法存在一些限制,如细胞毒性、稳定性较差,和细胞特异性。
3. 电穿孔法(Electroporation)电穿孔法是通过应用电场使细胞膜暂时性孔化来实现转染效果。
它可以用于转染各种类型的细胞,包括哺乳动物、鸟类和植物。
电穿孔法的转染效率高,但存在一定的细胞毒性和细胞损伤风险。
此外,电穿孔设备的成本较高,需要专门训练的技术人员来操作。
4. 病毒载体转染法(Viral vector transfection)病毒载体转染法使用经修饰的病毒作为转染载体,可实现高效的基因传递和表达。
常用的病毒载体包括腺病毒、衣壳病毒和逆转录病毒。
这些病毒对于不同类型的细胞具有不同的亲和力和转染效率。
然而,病毒载体转染法的主要限制是细胞对病毒的感染能力,以及在临床应用中可能引发的安全性问题。
5. 直接注射法(Direct microinjection)直接注射法是一种机械刺伤细胞膜直接将DNA注入细胞的方法。
这种方法对于特定的细胞类型具有高效转染的能力,如哺乳动物受精卵和干细胞。
它可以实现精确控制和单细胞水平的转染,但需要昂贵的设备和专业技能。
总结起来,转染方法的选择应根据实验的具体需求来进行。

细胞转染的各种方法比较梭华-Sofast TM基因转染试剂(高效率和细胞毒性低的聚阳离子转染试剂)梭华-Sofast TM是新一代的阳离子聚合物基因转染试剂,梭华-Sofast TM具有高效率转染所必备特征,如浓缩DNA,将DNA运送到细胞内,并使其在细胞核内释放等;梭华-Sofast TM 的细胞毒性很低,这是它的另一个重要特点;而且与其它转染试剂相比,梭华-Sofast TM很稳定,不被血清清除。
以上优点使得基因转染的操作简便易行,重复性好。
梭华-Sofast TM 已被成功应用于很多原代培养细胞和转化细胞株的基因转染。
一. 特点★转染效率高且稳定,比目前常用产品高10%。
★细胞培养基中的血清存在与否,均能获得高效率转染。
★细胞毒性低。
★转染程序简单,转染前后无需更换培养基转染实验可以在半小时内完成。
★价格比进口产品便宜60%。
★完善的技术支持,保证质量,无效退货。
二. 效果比较将梭华转染试剂与其它公司的聚阳离子转染试剂和常用的脂质体转染试剂分别在常用的报告基因如GFP、荧光素酶基因和LacZ基因的转染效率方面作了对比。
实验表明:1. 梭华-Sofast TM具有很高和稳定的转染率,是一种很好的基因转染试剂。
对某些常用的细胞株梭华-Sofast TM 转染率高于某常用阳离子脂质体,对其他多数细胞株的转染效率相近。
2. 需特别指出梭华-Sofast TM在原代培养细胞HUV-EC中有较高的转染效率,而大多数阳离子脂质体对此细胞的转染效率很低。
3. 通过检测转染细胞荧光素酶基因的活性,测定其转染效率。
实验表明梭华转染试剂具有最高的转染率。
4. 通过检测转染GFP基因的细胞所发出的荧光强度来测试转染效率,实验发现梭华转染试剂的转染率比常用的脂质体转染试剂转染率高达5-10%。
三. 适用范围☉适应于众多原代培养细胞和转化细胞株的基因转染。
☉适用于瞬时转染和稳定转染。
☉适应于贴壁细胞和悬浮细胞转染。
四. 各种转染方法的比较(在目前使用的方法中, 阳离子聚合物转染法是最好的转染试剂。

各种转染方法比较转染是将外源DNA或RNA导入体细胞的一种常用技术,用于研究基因功能、疾病机制、基因治疗等领域。
常用的转染方法包括化学法、电穿孔法、病毒载体介导转染和生物矢量直接注射法等。
下面将对这些转染方法进行详细比较。
1.化学法:化学法是最简单、最常用的转染方法之一,主要通过化学试剂与DNA或RNA形成复合物,进而被细胞摄取。
常用的化学试剂有钙磷酸盐、聚乙烯亚胺(PEI)、脂质体、高分子聚合物等。
化学法的优势在于易操作、适用于不同细胞类型,且无需特殊设备。
但其转染效率相对较低,引起细胞毒性的风险较高。
2.电穿孔法:电穿孔法又称为电转染法,通过利用电场作用使细胞膜发生瞬时通透性,使外源DNA或RNA进入细胞。
这种方法可使用电脉冲仪或特殊转染设备进行操作,适用于多种细胞类型。
相比于化学法,电穿孔法的转染效率更高,但对细胞的毒性稍高。
3.病毒载体介导转染:病毒载体介导转染是一种高效的转染方法,常用的病毒载体有腺病毒(Adenovirus)、腺相关病毒(Adeno-associated virus,AAV)、逆转录病毒(Retrovirus)和慢病毒(Lentivirus)等。
这些病毒载体不仅能将外源DNA或RNA导入细胞,还能使其在细胞内稳定表达。
病毒载体介导转染的优势在于高转染效率、稳定表达,适用于许多细胞类型。
然而,为了避免潜在的致病性和免疫反应,需要选择无毒性、无致病性的病毒载体。
4.生物矢量直接注射法:生物矢量直接注射法是将外源DNA或RNA直接注射到体内,让其进入目标细胞。
这种方法适用于许多动物模型研究,如小鼠、斑马鱼等。
生物矢量直接注射法的优势在于转染效率高、实验操作简单,但对于人体病理研究等实验要求较高的场景,其应用范围较窄。
根据以上比较,选择适合自己研究需求和细胞类型的转染方法非常重要。
需要考虑的因素包括转染效率、细胞毒性、操作难度、成本等。
在实际应用中,有时也可结合多种方法,例如将化学法与电穿孔法相结合,能够提高转染效率。

细胞转染的方法有哪些?
1. 脂质体法。
中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。
带正电的阳离子脂质体则不同,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
脂质体法始于1987年,此法的出现使得转染效率、转染的稳定性和可重复性大大提高。
阳离子脂质体细胞毒性相对较高,对不同的细胞可能会干扰细胞的代谢。
2. 电穿孔法。
通过短暂的高电场电脉冲处理细胞,沿细胞膜的电压差异会导致细胞膜的暂时穿孔。
DNA被认为是穿过孔扩散到细胞内的。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
理论上说电穿孔法可用于各种细胞,且不需要另外采购特殊试剂,但需要昂贵的电转仪。
此法每次转染需要更多的细胞和DNA,因为细胞的死亡率高。
每种细胞电转的条件都需要进行多次优化。
3. 病毒介导的感染。
感染需要将目的基因克隆到特定的病毒体系中,经过包装细胞的包装得到改造后的病毒,再进行感染。
优点是转染效率特别高,尤其是难以转染的原代细胞、活体细胞。
缺点是构建病毒周期长,环节多,易出错,费用也高。
4,非脂质体转染。
最新的纳米聚合物转染试剂,如Entranster 试剂,纳米材料,细胞毒性小,转染效率高,渐渐成为各大实验室的首选转染试剂。
干货:细胞转染的常用方法作为一条标准的实验狗,细胞转染这条路可谓是荆棘丛生,很多实验狗们看见细胞转染率低就把细胞给扔掉了!中洪小编告诉你,千万别这样“作死”,因为实验材料也很贵的啊!!科研道路十分漫长,今天我们来看看细胞转染实验大比拼。
首先我们看看细胞转染有哪些常见方式:细胞转染途径化学介导——利用载体分子包被核酸使其呈现中性电荷或正电荷DEAE磷酸钙法人工脂质体法物理介导——在细胞膜表面产生一个瞬时的孔从而导入DNA 显微注射法电穿孔法基因枪法病毒介导——利用基因工程病毒转染非病毒基因到细胞中逆转录病毒腺病毒(人脐带间充质干细胞转染图,图为本公司实验图,勿盗)小编总结了几种经典的传统方法,在此一一做一个介绍。
1磷酸钙共沉淀原理:该法可用于瞬时或稳定转染。
然而因其对pH、温度和缓冲液盐浓度的微小变化十分敏感,所得结果容易出现差异,且对许多类型的细胞培养物(尤其是原代细胞)具有细胞毒性,转染效率较差。
实验步骤:将核酸与氯化钙在磷酸盐缓冲液中混合,同时控制好pH、温度等条件→ 室温孵育,生成浓缩DNA的极小不溶性颗粒沉淀→ 将颗粒型沉淀分散到细胞中,促进DNA粘附在细胞表面→ 共沉淀通过内吞作用进入胞浆→ 分析细胞瞬时基因表达或者选择稳定性传染。
2人工脂质体法原理:带正电的脂质体与核酸带负电的磷酸基团形成复合物,进而可被细胞内吞稳定转染/瞬时性转染。
这种方法几乎适用于所有细胞,转染效率高、重复型好,但转染时需要去除血清,转染效果随细胞类型变化大。
实验步骤:在单独试管中分别稀释核酸及转染试剂→ 脂质体与核酸的磷酸骨架结合,形成复合物→ 脂质体上的正电荷有助于复合物与细胞膜结合→ 复合物通过内吞作用进入胞浆→ 分析细胞瞬时基因表达或沉默情况。
3病毒转染原理:对于用脂质体不能实现转染的细胞,可以采用病毒转染。
可用于蛋白质过表达或抑制,是临床研究中最常用的方法。
它通过侵染宿主细胞将外源基因整合到染色体中,可用于难转染细胞、原代细胞的稳定性转染。
常用转染方法原理及应用常用的转染方法有物理转染和化学转染两种。
物理转染是利用物理力学方法将外源DNA导入细胞内。
常用的物理转染方法有离心转染、电穿孔转染和基因枪转染。
离心转染是利用离心力将外源DNA加速转移到细胞内。
利用离心力可将DNA迅速穿透细胞膜,使其进入细胞质。
离心转染操作简单快捷,对细胞毒性较小,适用于大部分细胞的转染。
但由于仅靠离心力进行转染,对一些细胞类型转染效率较低。
电穿孔转染是利用电场将细胞膜瞬间打开,使外源DNA得以进入细胞内。
通过施加电场,使细胞膜上形成小孔,从而增加外源DNA进入细胞的机会。
电穿孔转染方法具有转染效率高、对细胞毒性较小等优点,适用于多种细胞类型的转染。
但操作过程较复杂,需要专用电转仪,且对细胞穿孔条件的控制较为严格。
基因枪转染是利用高压气泡冲击将外源DNA直接注射到细胞内。
将外源DNA包裹在微小金粒表面,再利用高压气泡将微小金粒射入细胞内,使外源DNA进入细胞质。
基因枪转染方法可以对不易转染的细胞类型进行转染,如植物细胞等。
但操作相对繁琐,对转染条件的控制较为困难。
化学转染是通过化学方法将外源DNA导入细胞内。
常用的化学转染方法有磷脂体转染、阳离子转染和电转的转染。
磷脂体转染是利用磷脂体包裹外源DNA,形成DNA磷脂体复合物,使其与细胞膜相互作用,从而实现外源DNA进入细胞质。
磷脂体转染方法适用于多种细胞类型,转染效率较高。
但磷脂体转染对细胞毒性较大,而且操作步骤较繁琐。
阳离子转染是利用阳离子聚合物与DNA形成复合物,使其与细胞膜发生相互作用,促进DNA进入细胞质。
阳离子转染适用于多种细胞类型,转染效率较高,但对细胞毒性较大,操作过程较为复杂。
电转是利用电场作用使负带电的外源DNA进入细胞内。
将细胞与含有外源DNA的转染缓冲液一起放在电转仪中,通过施加电压使DNA进入细胞质。
电转适用于多种细胞类型,具有转染效率高和操作简单等优点。
转染方法在生物研究和生物技术应用中具有重要作用。
几种转染方法的比较
目前,基因转染技术已经发展为分子生物学、生物工程和基因治疗等
领域的重要实用工具,它可以极大地提高研究的效率和准确度,是许多重
要的基础实验的重要手段。
基因转染,就是把DNA片段植入受体细胞,使
其形成完整的外源基因,从而使其编码的蛋白质可以表达出来。
其中,质
粒转染(经典CaCl2转染)、电穿孔转染、膜融合转染、磁珠转染、膜膜
转染、管状细胞转染(cylinder-mediated gene transfer)、病毒转染
和小肠转染等转染方法,是目前比较常用的基因转染方法。
一、质粒转染
质粒转染是将外源DNA片段载体在质粒上,用极低的浓度CaCl2诱导
细胞膜的瞬时通透性,使外源基因可以通过通透的细胞膜进入细胞,这是
质粒转染的原理,也是最常用的一种质粒转染方法。
质粒转染的优点:
(1)操作简单,易于大批量高效率的实验。
(2)操作条件宽松,不受受体细胞类型的限制,可以适应多种宿主
细胞。
(3)转染效率高,可以达到百分之九十以上。
(4)可以通过有效的筛选系统,有效控制外源DNA的插入和表达量。
质粒转染的缺点:
(1)转染过程对细胞毒性较大,转染效率有限。
实验小站细胞转染操作方法及各方法比较转染,是将外源性基因导入细胞内的一种专门技术。
随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。
转染大致可分为物理介导、化学介导和生物介导三类途径。
电穿孔法、显微注射和基因枪属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态,到转染方法的操作细节,都需要考虑。
一、细胞传代1. 试验准备:200ul/1mlTip 头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。
2. 弃掉培养皿中的培养基,用 1ml 的 PBS 溶液洗涤两次。
3. 用 Tip 头加入 1ml Trypsin 液,消化 1 分钟(37℃,5%CO2 )。
用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
4. 加入 1ml 的含血清培养基终止反应。
5. 用 Tip 头多次吹吸,使细胞完全分散开。
6. 将培养液装入离心管中,1000rpm 离心 5min。
7. 用培养液重悬细胞,细胞计数后选择0.8X106 个细胞加入一个35mm 培养皿。
8. 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
9. 将培养皿转入 CO2培养箱中培养,第二天转染。
细胞转染的方法和基本原理细胞转染是生物学研究中常用的实验技术,用于将外源DNA、RNA或蛋白质引入到靶细胞中。
本文将介绍细胞转染的方法和基本原理。
一、细胞转染的方法1. 化学法转染:化学法转染是最常用的细胞转染方法之一。
通过利用化学物质如聚乙烯亚胺(PEI)或脂质体等,将外源DNA或RNA 包裹成复合物,与细胞膜结合后进入细胞。
这种方法操作简单、成本低廉,适用于多种细胞类型。
但转染效率较低,对细胞有一定毒性。
2. 病毒载体转染:病毒载体转染是一种高效的细胞转染方法。
病毒载体可以将外源基因嵌入病毒基因组中,然后通过感染细胞的方式将基因导入细胞内。
常用的病毒载体有腺病毒、逆转录病毒等。
这种方法转染效率高,适用于多种细胞类型,但需要特殊设备和技术,同时也有一定的生物安全风险。
3. 电穿孔法转染:电穿孔法利用高压脉冲作用于细胞膜,破坏细胞膜结构,从而使外源DNA或RNA进入细胞。
这种方法操作简单,转染效率较高,但对细胞有一定的毒性,并且只适用于某些特定的细胞类型。
4. 基因枪法转染:基因枪法是一种生理穿孔法,通过利用高压气体或火药驱动基因枪,将外源DNA或RNA以微粒形式直接射入细胞。
这种方法适用于多种细胞类型,转染效率较高,但需要特殊设备和技术,并且对细胞有一定的毒性。
二、细胞转染的基本原理细胞转染的基本原理是通过一定的方法将外源DNA、RNA或蛋白质引入靶细胞,使其在细胞内表达或功能发挥。
转染后的细胞可以用于研究基因功能、蛋白质表达及相互作用等。
细胞转染的基本原理可以分为三个步骤:吸附、内化和表达。
1. 吸附:在化学法转染中,外源DNA或RNA会与载体相结合形成复合物,通过静电作用与细胞膜结合。
在病毒载体转染中,病毒载体会与细胞膜表面的受体结合。
吸附是转染的第一步,直接影响转染效率。
2. 内化:吸附后,外源DNA、RNA或蛋白质需要进入细胞内部。
在化学法转染中,复合物通过细胞膜的内吞作用或直接渗透进入细胞质。
细胞转染方法根据不同的试验目的,外源DNA导入哺乳细胞有两种类型:瞬时转染和稳定转染。
瞬时转染是指外源基因进入受体细胞后,存在于游离的载体上,不整合到细胞的染色体上,在外源基因导入细胞1-4天后收获细胞进行分析;稳定转染需要外源基因整合到细胞的染色体上,从而得到稳定的转染细胞株。
下面介绍几种转染方法:DEAE-葡聚糖:这是早在1965年出现的转染方法。
带正电的DEAE-葡聚糖或polybrene(多聚季胺)多聚体可以结合带负电的DNA分子,使得DNA复合物结合在带负电的细胞表面。
通过使用DMSO或甘油获得的渗透休克,也可能是细胞内吞作用使得DNA复合体进入细胞。
DEAE-葡聚糖仅限于瞬时转染,可重复性好,转染时要除掉血清。
磷酸钙共沉淀转染:最早在1973年开始采用。
氯化钙+DNA+磷酸缓冲液按一定的比例混和,形成极小的磷酸钙-DNA复合物沉淀黏附在细胞膜表面,借助内吞作用进入细胞质。
沉淀颗粒的大小和质量对于转染的成功至关重要,pH值、钙离子浓度、DNA浓度、沉淀反应时间、细胞孵育时间乃至各组分加入顺序和混合的方式都可能对结果产生影响,重复性不佳。
此法较易得到稳定转染,但转染原代细胞比较困难。
电穿孔法:通过短暂的高电场电脉冲处理细胞,沿细胞膜的电压差异会导致细胞膜的暂时穿孔。
DNA被认为是穿过孔扩散到细胞内的。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
理论上说电穿孔法可用于各种细胞,且不需要另外采购特殊试剂,但需要昂贵的电转仪。
此法每次转染需要更多的细胞和DNA,因为细胞的死亡率高。
每种细胞电转的条件都需要进行多次优化。
脂质体法:中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA 导入细胞膜内。
带正电的阳离子脂质体则不同,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
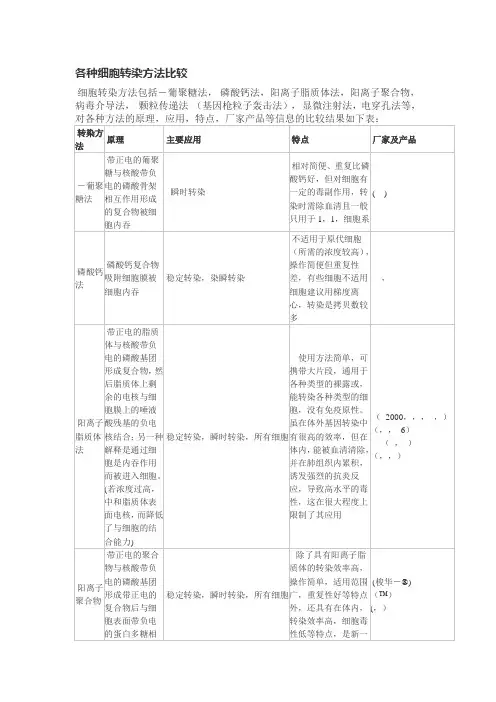
各种细胞转染方法比较
细胞转染方法包括DEAE-葡聚糖法,磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic 颗粒传递法(基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表:
转染方法原理主要应用特点厂家及产品
DEAE-葡聚糖法带正电的DEAE-葡聚
糖与核酸带负电的
磷酸骨架相互作用
形成的复合物被细
胞内吞
瞬时转染
相对简便、重复比磷酸钙好,但
对细胞有一定的毒副作用,转染
时需除血清且一般只用于BSC-1,
CV-1,COS细胞系
Sigma-Aldrich
(DEAE-Dextran
Transfection
Kit)
磷酸钙法磷酸钙DNA复合物吸
附细胞膜被细胞内
吞
稳定转染,
染瞬转染
不适用于原代细胞(所需的DNA
浓度较高),操作简便但重复性
差,有些细胞不适用
细胞建议用CSCL梯度离心,转染
是拷贝数较多
GIBCO BRL ,
Promega
阳离子脂质体法带正电的脂质体与
核酸带负电的磷酸
基团形成复合物,然
后脂质体上剩余的
电核与细胞膜上的
唾液酸残基的负电
核结合;另一种解释
是通过细胞是内吞
作用而被进入细胞。
(若DNA浓度过高,
中和脂质体表面电
核,而降低了与细胞
的结合能力)
稳定转染,
瞬时转染,
所有细胞
使用方法简单,可携带大片段
DNA,通用于各种类型的裸露DNA
或RNA,能转染各种类型的细胞,
没有免疫原性。
虽在体外基因转
染中有很高的效率,但在体内,
能被血清清除,并在肺组织内累
积,诱发强烈的抗炎反应,导致
高水平的毒性,这在很大程度上
限制了其应用
Invitrogen
(Lipofectami
ne 2000,
Lipofectamine
,Lipofectin,
Lipofectamine
Plus,
Cellfectin)
Roche(Dosper,
DOTAP,FuGENE
6)
CPG Biotech Co
(GeneLimo
Plus,GeneLimo
Super)
Promega
(Transfast,
Tfx,
Transfectam)
阳离子聚合物带正电的聚合物与
核酸带负电的磷酸
基团形成带正电的
复合物后与细胞表
面带负电的蛋白多
稳定转染,
瞬时转染,
所有细胞
除了具有阳离子脂质体的转染效
率高,操作简单,适用范围广,
重复性好等特点外,还具有在体
内,转染效率高,细胞毒性低等
特点,是新一代的转染试剂。
Sunma(梭华-
Sofast®)
Qbiogene
(jetPEI™)
Qiagen(SuperF
糖相互作用,并通过
内吞作用进入细胞。
ect,Polyfect)
病毒介导法逆转
录病
毒
(RNA)
通过病毒中膜糖蛋
白和宿主细胞表面
的受体相互作用而
进入宿主细胞,之后
反转入酶启动合成
DNA并随机整合到宿
主基因组中
稳定转染,
特定宿主细
胞
可用于难转染的细胞、原代细胞,
体内细胞等,但携带基因不能太
大(<8kb),细胞需处分裂期,
需考虑安全因素
中国科学院典
型培养物保藏
委员会
腺病
毒(双
链
DNA)
先和细胞表面的受
体结合,继而在αv
整合素介导下被细
胞内吞
瞬时转染,
特定宿主细
胞
可用于难转染的细胞,需考虑安
全因素
中国科学院典
型培养物保藏
委员会
Biolisti c 颗粒传递法(基因枪粒子轰击法)将DNA用显微重金属
颗粒沉淀,再将包被
好的颗粒用弹道装
置投射入细胞,DNA
在胞内逐步释放,表
达
瞬时转染,
稳定转染
可用于:人的表皮细胞,纤维原
细胞,淋巴细胞系以及原代细胞
显微注射法用显微操作将DNA直
接注入靶细胞核
稳定转染,
瞬时转染
转染细胞数有限,多用于工程改
造或转基因动物的胚胎细胞
电穿孔法高脉冲电压破坏细
胞膜电位,DNA通过
膜上形成的小孔导
入
稳定转染,
瞬时转染,
所有细胞
适用性广,除了质粒外,还可转
染大的基因组(>65kb)但细胞致
死率高,DNA和细胞用量大,需
根据不同细胞类型优化电穿孔实
验条件,拷贝数较少1-20。