(2)不同种非金属元素的原子间形 成的共价键是极性键。
2021
4
练习:指出下列微粒中的共价键类型
1、O2 2 、CH4 3 、CO2 4、 H2O2 5 、O226 、OH-
非极性键
极性键
(H-O-O-H)
极性键
极性键 非极性键 非极性键
极性键
2021
5
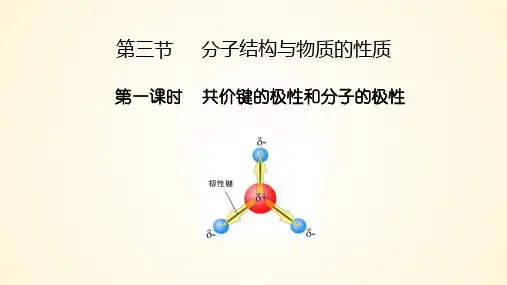
第三节 分子的性质
(二)分子的极性
假设:分子中正电荷的作用集中于一点——正电中心 负电荷的作用集中于一点——负电中心
看正电中心 和负电中心 是否重合
(1)看键的极性,也看分子的空间构型 (2)化学键202的1 极性的向量和是否等于7零
从力学的角度分析: 分子中各键的极性向量和
在ABn分子中,A-B键看作AB原 子间的相互作用力,根据中心原子A 所受合力是否为零来判断,F合=0,为 非极性分子(极性抵消), F合≠0, 为极性分子(极性不抵消)
正四面体型 ,对称结构,C-H键的极性 互相抵消( F合=0) ,是非极性分子
2021
12
小结:键的极性与分子的极性的关系
分子
极性分子
极性键形成,空间结构不对称,键 的极性不抵消,
全部非极性键形成(H2、Cl2
非极性分子 P4等)
极性键形成,空间结构对称, 键的极性抵消(CH4、CO2)
2021
13
2021
8
O
C
F1
F合=0
180º
OC=O键是极性键,但
从分子总体而言CO2 是直线型分子,两个
C=O键是对称排列的,
两键的极性互相抵消
( F合=0),∴整个 F2 分子没有极性,电荷
分布均匀,是非极性
分子