化学知识结构框图(超详细)
- 格式:doc
- 大小:351.00 KB
- 文档页数:35
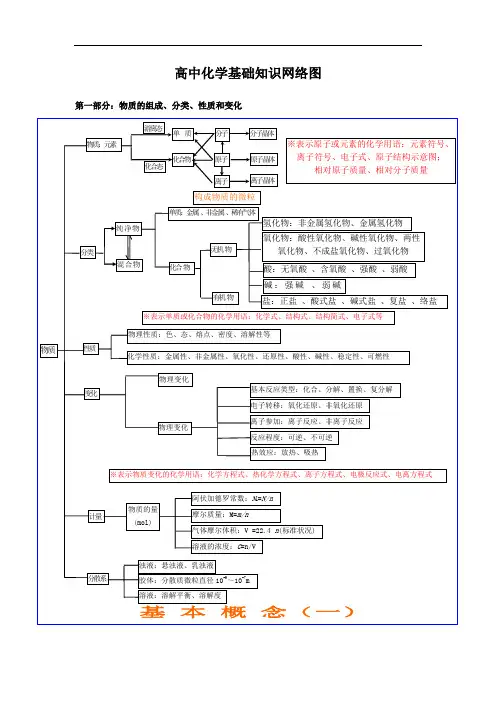
. 专业学习资料 .第一部分 基本理论 基本概念【物质结构】. 专业学习资料.晶体结构. 专业学习资料.晶体熔沸点比较表. 专业学习资料.【元素周期律】. 专业学习资料.【化学反应速率与化学平衡】. 专业学习资料.. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【胶体】【电解质溶液】.. 专业学习资料.. 专业学习资料.【氧化还原反应电化学】. 专业学习资料.【各种化学反应的关系】. 专业学习资料..专业学习资料.【化学反应规律】. 专业学习资料.. 专业学习资料.. 专业学习资料 .【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数). 专业学习资料..第二部分 元素及其化合物【元素化合物概述】【非金属元素】. 专业学习资料.【卤族元素】. 专业学习资料.PbS. 专业学习资料.. 专业学习资料... . .. . ... 专业学习资料 .【金属元素】.. . .. . ..【铝及其化合物】. 专业学习资料.. 专业学习资料.. 专业学习资料.【化工生产】. 专业学习资料.第三部分 有机物【有机物导学】[有机物推断]浓H2SO4加热苯的硝化醇分子内、间脱水酯化光照——烷基卤代[官能团特征反应]聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3 CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n2HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。

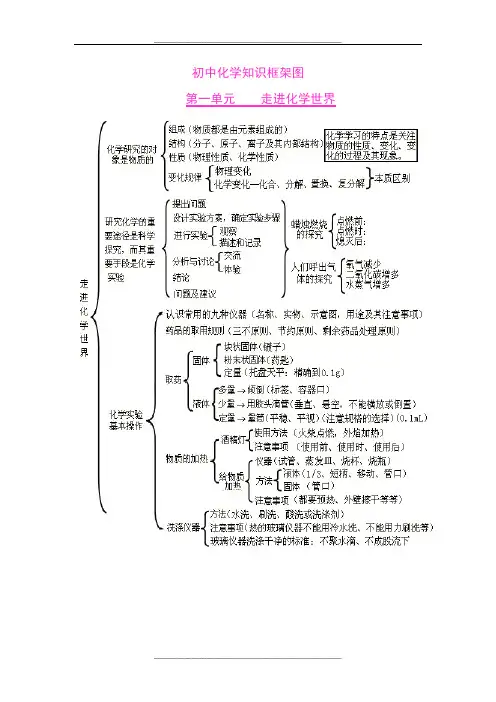
第一单元 走进化学世界f 育法(水洗、刷洗、酸洗或洗涤剂)洗涤仪器彳注意事项(热的玻璃仪器不能用冷水i 总 不能用力刷洗等〉I 玻璃仪器洗涤干净的标准:不聚水辖U 不成股流下1锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。
2、 催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改 变 3、 由一种元素组成的物质可能为单质,也可能为混合物。
如氧气02和臭氧03两种单质混合得到混合物,也只由氧(O )元素组成。
金刚石C 和石墨C 的混合物,只由碳(C )元素组成等。
只有说由一种元素 组成的纯净物,才能说一定是单质。
冰水混合物是纯净物,冰是水的固态,还是水。
优学研究的对象是物质的 组成(物质都是由元素组成的〉结构(分子、原子、离子及其商部结构) 〈性质(物理性质、化学隍质)变化规律r 物理变化[化学变化一k 合、分摒、置换、复分解}本质区别走 进 化 学 世 界硏究化学的重 要途径是科学 探究,而其重 要r提出间題设计实验有案.确定貓歩骤 迸行实验・ 分析与讨论* 结论I 间题及建议r 观察1摊述和记录交赢 体■验J 占嵌时.、、体的探究峙二氧化碳增多 水蒸气增多/认识常用的九种仪器(名称、实物、示宜图,用途及其注言事项〉 药品的取用规则(三不原则、节约J®则、剩余葯品处理原则)取药&化学实验J基耳操作%. 「块状固您(辍子)固体・粉耒状固悴(药匙)L 定量(托盘天平:精确到0*1或「多壘-倾倒(:标签,容器口)襪体{少壘T 用胶头滴管〔垂宜、悬空,不能横放或倒置) ' L 定堇一壘筒(平稳、平视)(注意规格的选择)(0. ImL )「使用右法〔火柴点燃,外焰加热〉 I 注意車项〔使用前、使用时、使用后〉 「仪器■(试管、葵发皿、烧杯、烧瓶) 、吐J 液体茨短柄、移动、管口) 万京1固体(管口)I 注意事项(都要预热、外壁擦干等等)广酒周丁 物I 质的加热J4、原子是化学变化中的最小粒子。
第一部分 基本理论 基本概念晶体结构晶体熔沸点比较表【元素周期律】【化学反应速率与化学平衡】..【胶体】【电解质溶液】【氧化还原反应电化学】【各种化学反应的关系】【化学反应规律】【物质的量】nVV n m =→nm M =Vn C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数)第二部分元素及其化合物【元素化合物概述】【非金属元素】【卤族元素】PbS....【金属元素】【铝及其化合物】【化工生产】第三部分 有机物 【有机物导学】[有机物推断]浓H 2SO 4加热 苯的硝化 醇分子内、间脱水 酯 化 稀H 2SO 4加热 酯的水解 糖类水解 NaOH 水溶液加热 酯的水解 卤代烃的水解 NaOH 醇溶液加热—卤代烃消去 Cu 、加热—醇的氧化 脱水 醇的消去、羟基间脱水 羧基间脱水 羟基与羧基间脱链酯 环酯 光照——烷基卤代 [官能团特征反应] 聚酯反应类型与官能团的关系官能团(或物质)的特征反应[各类有机物之间的相互关系]2 =CH 2CH 3 —CH 3CH CH CH 2 O HCH 3 CH 3 C H 2 C lCH 2 CH 2 Cl CH C HO CHClCH 2-CH NH 2n22HOCH 2 CH 2OHCH 3 C OOHCH 3 C OO CH 2 CH 3第四部分 化学实验导学[物质的分离和提纯][物质的检验][常见气体的实验室制法]第五部分 化学计算。
初中化学知识框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐一、化学用语1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO4.5H2O ;碳酸钠晶体Na2CO3.10H2O ;氨水NH3.H2O ;二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁五、复分解反应发生的条件反应:有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物六、溶液的酸碱性与酸碱度的测定1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值---溶液的酸碱度:pH<7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH>7溶液为碱性(越大碱性越强)七、离子的检验Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。

初中化学各单元知识点框架图work Information Technology Company.2020YEAR初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料第九单元溶液第十单元 酸、碱、盐(一)化学用语1电离方程式:-++=24422SO H SO H ;-++=OH Na NaOH ;-++=24334232)(SO Al SO Al2物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO 3;食盐的主要成分NaCl ;纯碱、口碱Na 2CO 3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO 4·5H 2O ;碳酸钠晶体Na 2CO 3·10H 2O ;氨水NH 3·H 2O 。
(二)金属活动性 1金属活动性顺序:K >Ca >Na >Mg >Al >Zn >Fe >Sn >Pb(H)Cu >Hg >Ag >Pt >Au 2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁 3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO 4(实验室制二氧化碳时不用稀硫酸的原因)Ag 2SO 4(鉴别-24SO 和-Cl 时,不用硝酸银的原因)MgCO 3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO 3、NaNO 3、AgNO 3、BaSO 4不能做复分解反应的反应物。

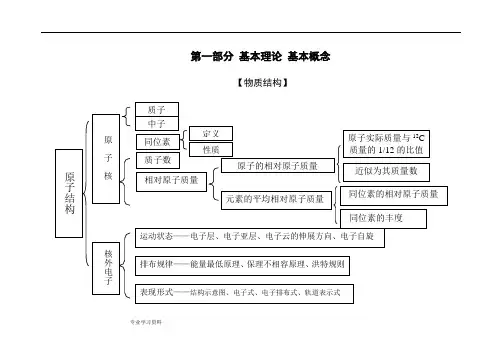
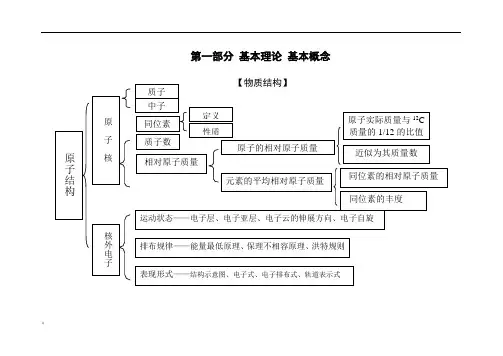
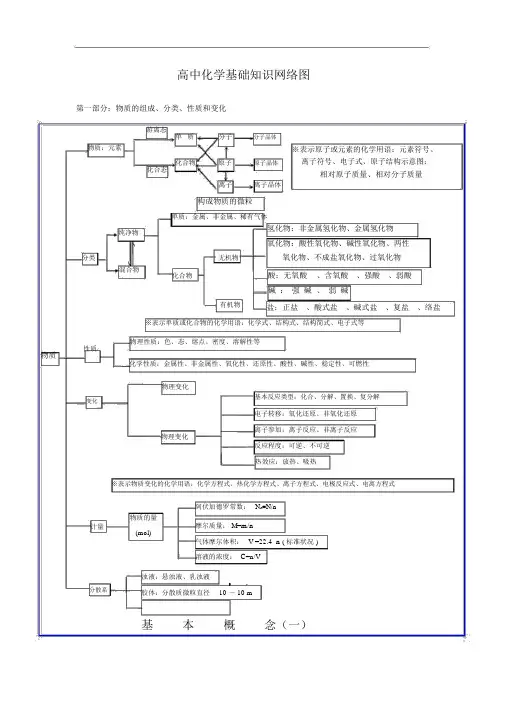
化学知识结构框图(超详细)!第一部分基本理论基本概念质子和中子是构成原子核的基本粒子。
物质结构指的是物质的构成方式,包括原子的相对原子质量、原同位素、质子数等概念。
原子的相对原子质量可以近似看作其质量数,同位素的相对原子质量和丰度也是物质结构的重要概念。
原子的结构包括核和核外电子。
电子排布规律包括能量最低原理、保里不相容原理和洪特规则,可以用结构示意图、电子式、电子排布式和轨道表示式等形式表现。
化学键是化合物形成的基础。
极性共价键和非极性共价键是常见的两种共价键类型。
离子键和金属键也是化合物中常见的键类型。
晶体结构包括分子晶体、离子晶体、原子晶体和金属晶体。
元素周期律是元素周期性变化的规律。
周期表的结构包括短周期、周期长周期和不完全周期。
元素周期律可以用来预测元素的性质,如农药、半导体、合金、催化剂、光电管等应用。
化学反应速率是指化学反应中物质消失或生成的速度。
它可以用平均速率来表示,受内因、温度等多种因素影响。
化反应中,元素守恒和电荷守恒都得到满足,但能量高的物质生成能量低的物质的作用更大,因此反应发生。
化学反应是化学变化的过程,可以分为不同类型的反应。
其中,分解反应是一种将一种物质分解成两种或更多种物质的反应,化合反应是两种或更多种物质结合成一种物质的反应,氧化还原反应是指物质的氧化产生电子,还原则是指物质的还原接受电子。
离子反应是指离子之间的反应,包括置换反应和复分解反应。
在化学反应中,有一些规律需要遵守。
电荷守恒规律指的是反应前后电荷总量不变,元素守恒规律指的是反应前后元素总量不变,溶解度规律指的是溶解度较大的物质生成溶解度较小的物质,强弱规律指的是能量高的物质生成能量低的物质。
在实际应用中,需要根据具体情况确定哪种规律影响更大,以此决定反应的发生。
氧化还原反应是一种特殊的化学反应,涉及到还原剂和氧化剂的作用。
还原剂具有还原性,可以引起氧化反应,被氧化的物质叫做还原剂。
氧化剂具有氧化性,可以引起还原反应,被还原的物质叫做氧化剂。

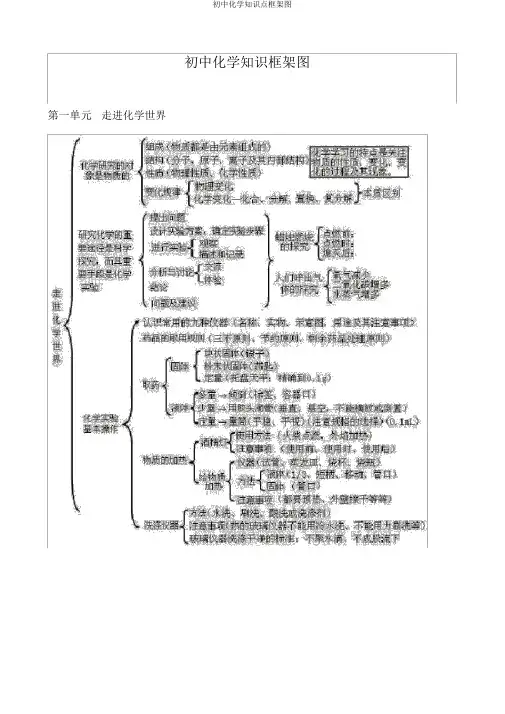
初中化学知识框架图第一单元走进化学世界第二单元我们四周的空气第三单元自然界的水第四单元物质组成的神秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属资料九、溶液十、酸碱盐一、化学用语1、电离方程式2、物质的俗称和主要成分:生石灰 CaO;熟石灰、消石灰、石灰水的主要成分 Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾 CuSO4.5H2O;碳酸钠晶体 Na2CO3.10H2O;氨水 NH3.H 2O;二、金属活动性1、金属活动性次序: K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性次序的意义:在金属活动性次序中,金属地点越靠前,金属在水溶液 ( 酸溶液或盐溶液 ) 中就越简单失电子而变为离子,它的活动性就越强。
3、金属活动性次序的应用:(1) 排在氢前的金属能置换出酸里的氢( 元素 ) 。
(2)排在前面的金属才能把排在后边的金属从它们的盐溶液中置换出来(K、Ca、Na 除外 ) 。
三、酸、碱、盐的溶解性1、常有盐与碱的溶解性:钾( 盐) 、钠( 盐) 、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾 ( 盐) 、钠 ( 盐) 、铵( 盐) 。
碱类物质溶解性:只有 ( 氢氧化 ) 钾、 ( 氢氧化 ) 钠、( 氢氧化 ) 钙、 ( 氢氧化 ) 钡溶。
2、八个常有的积淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2( 石灰水注明“澄清〞的原由) 、CaSO4( 实验室制二氧化碳时不用稀硫酸的原由 )Ag2SO4( 鉴识 SO42-和 Cl -时,不用硝酸银的原由 ) 、MgCO3( 碳酸根离子不可以用于在溶液中除掉镁离子的原由)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁四、复分解反应发生的条件反应:有气体、水或积淀生成( 即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只好与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应 (3)KNO、NaNO3、AgNO3、BaSO4不可以做复分解反应的反应物五、溶液的酸碱性与酸碱度的测定1、指示剂 --- 溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液 ( 特例:碳酸钠的水溶液显碱性)2、pH值--- 溶液的酸碱度: pH<7溶液为酸性 ( 越小酸性越强 ) ;ph=7 溶液为中性;ph>7 溶液为碱性 ( 越大碱性越强 )六、离子的查验Cl - ( 在溶液中 )---在被测溶液中参加硝酸银溶液, 假如生成不溶于硝酸的白色沉淀,那么原被测液中含氯离子。

纯干货:初中化学各单元知识框架图(收藏)第一单元:走进化学世界第二单元:我们周围的空气第三单元:自然界的水第四单元:物质构成的奥秘第五单元:化学方程式第六单元:碳和碳的氧化物第七单元:燃料及其利用第八单元:金属和金属材料第九单元:溶液第十单元:酸碱盐1化学用语1、电离方程式:2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O;3、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O。
2金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
3酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁4复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。