高中化学知识体系结构图(1)教学教材
- 格式:doc
- 大小:108.50 KB
- 文档页数:2


第一节原子结构与元素周期表微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念。
教师:元素周期表揭示了元素间的内在联系,使元素构成了一个较为系统的体系。
元素周期表的建立成为化学发展史上的重要的里程碑之一。
教师提问:20世纪初,原子结构的奥秘被揭示后,人们对元素周期表的认识更加完善。
那么,原子结构与元素周期表之间有怎样的关系呢?教师:引出本节课学习内容在老师的带领下,对问题进行思考。
引出本节课内容。
简单的思维训练能够让学生不害怕对本节课知识点学习,感悟本节课的知识点。
讲授新课教师利用多媒体设备向学生投影出下面【新课讲解】原子结构教师:原子由原子核和核外电子构成,原子核由质子和中子构成。
记录笔记,认真倾听。
通过书写和口述帮助学生对知识点进行记忆。
【新课讲解】质量数【新课讲解】原子结构教师:在含有多个电子的原子力,电子分别在能量不同的区域内运动。
把不同的区域简化为不连续的壳层,也称作电子层。
(有人把这种电子层模型比拟为洋葱式结构)。
分别用n=1,2,3,4,5,6,7或K、L、M、N、O、P、Q来表示从内到外的电子层。
【新课讲解】原子结构中的电子层【思考讨论】教师:在多电子原子中,电子的能量是不相同的。
那么在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。
由于原子中的电子是处在原子核的引力场中,电子总是从内层排起,当一层充满后再填充下一层。
那么,每个电子层最多可以排布多少个电子呢?答案:根据Na元素的核外电子排布,我们可以发现,K层最多可以排布2个电子,L层最多可以排布8个电子。
记录笔记,认真倾听。
老师和同学一起讨论,思考问题。
老师和同学一起讨论,思考通过书写和口述帮助学生对知识点进行记忆。
通过讨论,帮助同学对知识点的掌握。
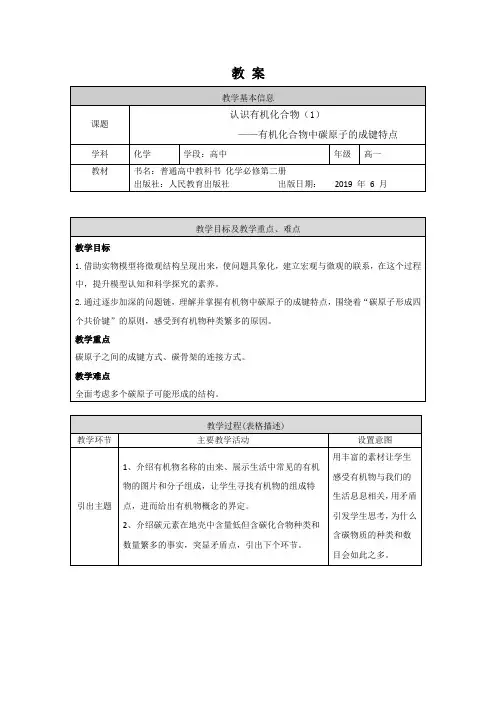
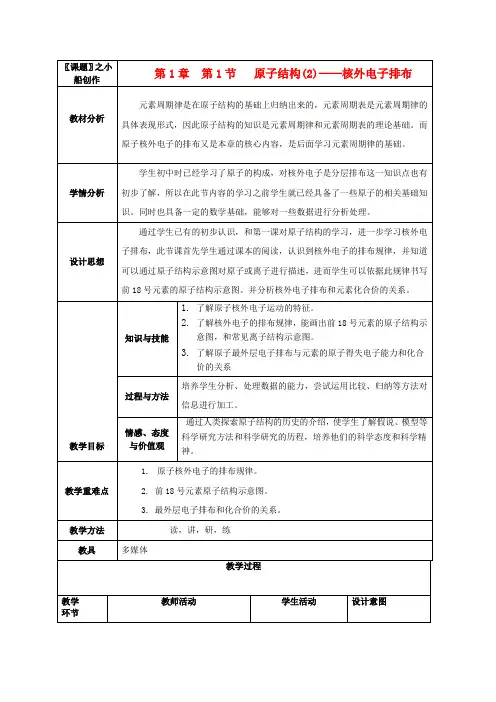
通过讨论,加深对知识点的印【思考讨论】下表是稀有气体元素原子的电子层排布,根据表格回答问题。
【复习回顾】1.构成原子的微粒有哪些,它们之间的关系是什么?2.为什么原子不显电性?3.为什么说原子的质量主要集中原子核上?思考回顾,回答问题巩固已学的关于原子结构的知识,并过渡到新课【过渡引导】我们已经知道,原子是由原子核和核外电子构成的,原子核的体积很小,仅占原子体积的几千亿分之一,就好像一个大型的体育场中一个小蚂蚁,那么核外电子是什么样的呢?在这“广阔”的空间里,电子又是怎样运动的呢?联想并回顾上节课中关于电子的相关信息:1.电子质量小2.电子带负电3.电子运动空间“大”通过对上节课内容的复习,过渡到新课的引入;由新的问题的提出,给出将要学习的内容,创设一种学习的氛围。
【板书总结】一、电子的特征:1.质量很小2.电子带负电3.运动空间小(如果相对于原子核,则“较大”)4.运动速度快(接近光速)宏观物体电子质量很大很小速度较小很大(接近光速)位移可测位移、能量不可同时测定能量可测轨迹可描述没有确定轨道整理归纳,体会核外电子的特征。
通过PPT展示学生能够感知的宏观物体和微观电子做对比,更深刻的体会核外电子的特征。
【质疑】那核外的电子又是怎样运动的呢?引入核外电子排布的学习【视频】通过视频体会人类探索原子结构的历史使学生了解假说,模型等科学研究方法和科学研究的历程,培养科学态度和科学精神。
【阅读】课本P6关于核外电子的排布介绍阅读并结合视频体会核外电子的分层运动培养通过各种方式获取信息的能力【交流研讨】电子在原子核外是怎样运动的?根据阅读的内容,小组交流,归纳整理,回答自己的结果。
培养学生获得信息后,能够进行整理归纳,并且表述出自己的成果。
【板书总结】二、核外电子排布的规律:1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布,总是尽先排在能量低的电子层里;2.每层最多容纳的电子数为2n2(n代表电子层数);3.最外层电子数不超过8个(第一层为最外层时,电子数不超过2个)。
4.次外层最多不超过18个电子。






人教版高中化学教材整体目录第一册第一章物质的结构与性质1.1 物质的结构1.2 物质的性质1.3 物质的变化第二章化学反应与能量2.1 化学反应的基本概念2.2 化学反应的类型2.3 化学反应与能量第三章有机化合物3.1 有机化合物的结构3.2 有机化合物的性质3.3 有机化合物的制备第四章化学实验4.1 化学实验的基本操作4.2 化学实验仪器4.3 化学实验方案的设计与评价第二册第五章物质的变化与化学平衡5.1 物质的变化5.2 化学平衡的基本概念5.3 化学平衡的移动第六章电化学6.1 电化学基本概念6.2 原电池6.3 电解质溶液第七章物质的分析与检测7.1 物质的分离与提纯7.2 物质的量测定7.3 物质组成与结构的分析第八章化学与STSE8.1 化学与生活8.2 化学与环境8.3 化学与科技第三册第九章烃9.1 烷烃9.2 烯烃和炔烃9.3 芳香烃第十章立体化学10.1 立体化学基本概念10.2 有机化合物的立体结构10.3 立体化学在有机合成中的应用第十一章卤代烃和醇11.1 卤代烃11.2 醇11.3 酚第十二章醚、胺、糖和脂肪12.1 醚12.2 胺12.3 糖12.4 脂肪第四册第十三章化学反应的速率和化学平衡13.1 化学反应速率13.2 化学平衡13.3 反应速率和平衡的调控第十四章酸碱平衡与沉淀溶解平衡14.1 酸碱平衡14.2 沉淀溶解平衡14.3 酸碱滴定第十五章金属的腐蚀与防护15.1 金属的腐蚀15.2 金属的防护15.3 电镀第十六章化学与材料16.1 金属材料16.2 有机高分子材料16.3 新型材料第五册第十七章化学与生命17.1 生命的化学基础17.2 生物大分子17.3 生物体内的化学反应第十八章化学与自然资源和环境18.1 自然资源的开发与利用18.2 环境污染与防治18.3 绿色化学第十九章研究型研究课题19.1 研究型研究概述19.2 研究型研究案例分析19.3 研究型研究评价与反思第六册第二十章化学实验选编20.1 化学实验的基本技能20.2 化学实验方案的设计与评价20.3 化学实验研究性研究第二十一章化学与STSE21.1 化学与科学21.2 化学与技术21.3 化学与社会第二十二章拓展视野22.1 化学与人类文明22.2 化学与科技创新22.3 化学与未来发展以上为人教版高中化学教材的整体目录,供您参考。
精选全文完整版(可编辑修改)人教版化学必修1第2章化学物质及其变化单元教学设计学号:联系方式:人教版必修1第2章 化学物质及其变化单元教学设计一、教材内容和体系分析 1.位置分析本单元处于高中人教版化学必修1的第二章,是高中化学从化学学科内容方面展开化学科学的起始章。
本单元作为从学科内容方面使学生认识化学科学的开始,是连接义务教育阶段《化学》、《科学》与高中化学的纽带和桥梁,对于发展学生的科学素养,引导学生有效地进行高中阶段的化学学习,具有非常重要的承前启后的作用。
“承前”意味着要复习义务教育阶段化学的重要内容,“启后”意味着在复习的基础上要进一步提高和发展,从而为化学课程其他章节的学习,乃至整个高中阶段的化学学习奠定重要的基础。
因此,本章在全书中占有特殊的地位,具有重要的作用,是整个高中化学的教学重点之一。
2.结构分析本单元的一条基本线索就是对化学物质及其变化的分类,化学学科的核心思想——分类观始终贯穿于单元始终。
包括物质分类法、胶体、电解质与离子反应、氧化还原反应基础四部分内容。
单元内容结构如图所示:三、 课程目标与教学目标化学课程目标由国家控制,以化学学科课程标准的形式向社会公布。
是实施该门课程管理、教学评价的基本依据。
化学教学目标由任课教师编制,是教师在调研了化学教学系统各要素之后对教学的预设。
化学课程目标是课时教学目标的基础。
编制化学教学目标时最具挑战性的是化学教师如何选择恰当的行为动词来表达对该任务的教学强度。
从教育的层级转化来讲,先有国家的教育目的、学校的培养目标,然后才有课程目标、学期目标、单元目标,最后才是课时的教学目标。
按照美国课程论专家泰勒的观点,教学目标和教学活动、教学评价是三位一体的关系。
化学教学目标是在调研了课程目标、化学教材、学校教学条件和学习者的实际之后,对化学教学所作的一种终极预设。
故本单元课程目标转化为三维教学目标过程如下:(一)先研读课程标准,其第三部分内容标准之“常见无机物及其应用” 对化学物质及其变化这个知识点的要求为:1.能根据物质的组成和性质对物质进行分类。