计算+电解原理及其应用复习
- 格式:ppt
- 大小:439.50 KB
- 文档页数:15
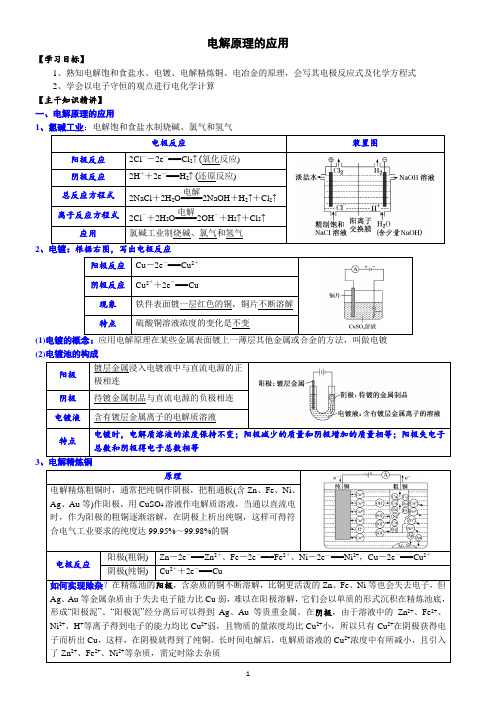
电解原理的应用【学习目标】1、熟知电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及化学方程式2、学会以电子守恒的观点进行电化学计算【主干知识精讲】一、电解原理的应用1、氯碱工业:电解饱和食盐水制烧碱、氯气和氢气电极反应装置图阳极反应2Cl --2e -===Cl 2↑ (氧化反应)阴极反应2H ++2e -===H 2↑ (还原反应) 总反应方程式 2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑ 离子反应方程式 2Cl -+2H 2O=====电解2OH -+H 2↑+Cl 2↑应用 氯碱工业制烧碱、氯气和氢气 2、电镀:根据右图,写出电极反应阳极反应 Cu -2e -===Cu 2+阴极反应 Cu 2++2e -===Cu现象铁件表面镀一层红色的铜,铜片不断溶解 特点硫酸铜溶液浓度的变化是不变 (1)电镀的概念:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法,叫做电镀 (2)电镀池的构成阳极镀层金属浸入电镀液中与直流电源的正极相连 阴极 待镀金属制品与直流电源的负极相连电镀液 含有镀层金属离子的电解质溶液特点 电镀时,电解质溶液的浓度保持不变;阳极减少的质量和阴极增加的质量相等;阳极失电子总数和阴极得电子总数相等3原理电解精炼粗铜时,通常把纯铜作阴极,把粗通板(含Zn 、Fe 、Ni 、Ag 、Au 等)作阳极,用CuSO 4溶液作电解质溶液,当通以直流电时,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,这样可得符合电气工业要求的纯度达99.95%~99.98%的铜电极反应 阳极(粗铜)Zn -2e -===Zn 2+、Fe -2e -===Fe 2+、Ni -2e —===Ni 2+,Cu -2e -===Cu 2+阴极(纯铜) Cu 2++2e -===Cu 如何实现除杂?在精炼池的阳极,含杂质的铜不断溶解,比铜更活泼的Zn 、Fe 、Ni 等也会失去电子,但Ag 、Au 等金属杂质由于失去电子能力比Cu 弱,难以在阳极溶解,它们会以单质的形式沉积在精炼池底,形成“阳极泥”。

考点40电解原理及应用1.复习重点1.电解原理及其应用,放电顺序,电极反应式的书写及有关计算; 2.氯碱工业。
2.难点聚焦一、理解掌握电解池的构成条件和工作原理1、要判断电解产物是什么,必须理解溶液中离子放电顺序阴极放电的总是溶液中的阳离子,与电极材料无关。
放电顺序是K +、Ca 2+、Na +、Mg 2+、Al 3+、Zn 2+、Fe 2+(H +)、Cu 2+、Hg 2+、Ag +、Au 3+放电由难到易阳极:若是惰性电极作阳极,溶液中的阴离子放电,放电顺序是 S 2-、I -、Br -、Cl -、OH -、含氧酸根离子(NO 3-、SO 42-、CO 32-)、F -失电子由易到难若是非惰性电极作阳极,则是电极本身失电子。
要明确溶液中阴阳离子的放电顺序,有时还需兼顾到溶液的离子浓度。
如果离子浓度相差十分悬殊的情况下,离子浓度大的有可能先放电。
如理论上H +的放电能力大于Fe 2+、Zn 2+,但在电解浓度大的硫酸亚铁或硫酸锌溶液时,由于溶液[Fe 2+]或[Zn 2+]>>[H +],则先在阴极上放电的是Fe 2+或Zn 2+,因此,阴极上的主要产物则为Fe 和Zn 。
但在水溶液中,Al 3+、Mg 2+、Na +等是不会在阴极上放电的。
2、电解时溶液pH 值的变化规律电解质溶液在电解过程中,有时溶液pH 值会发生变化。
判断电解质溶液的pH 值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H 2,阳极上无O 2产生,电解后溶液pH 值增大;②若阴极上无H 2,阳极上产生O 2,则电解后溶液pH 值减小;③若阴极上有H 2,阳极上有O 2,且222O H V V =,则有三种情况:a 如果原溶液为中性溶液,则电解后pH 值不变;b 如果原溶液是酸溶液,则pH 值变小;c 如果原溶液为碱溶液,则pH 值变大;④若阴极上无H 2,阳极上无O 2产生,电解后溶液的pH 可能也会发生变化。

电解原理的应用知识点一、知识概述《电解原理的应用知识点》①基本定义:电解就是把电流通过电解质溶液或熔融态电解质,在阴、阳两极引起氧化还原反应的过程。
比如说就像水往低处流一样,电子在电解过程中也会朝着能让它稳定的地方去,从阳极流向阴极。
②重要程度:在化学学科里是个超重要的部分,很多工业生产像电镀啊、金属精炼啊都得靠它。
可以说没有电解原理的应用,很多现代化工产品就得不出来,就像生产汽车少了发动机一样。
③前置知识:得先知道氧化还原反应的概念和原理,还有离子的放电顺序等知识。
就好像要盖房子,得先有砖头水泥一样,这些前置知识就是电解原理应用学习的基础材料。
④应用价值:在工业上用来制取纯净金属,比如精炼铜。
生活中电镀能让物品表面好看又耐用,就像给物品穿上一层保护又漂亮的外衣。
二、知识体系①知识图谱:电解原理的应用位于电化学这一重要板块里,它和原电池知识相互联系又有区别。
②关联知识:和氧化还原反应、电解质溶液的性质等知识点密切相关。
就像一伙儿的小伙伴,互相配合和影响。
③重难点分析:- 掌握难度:有点难。
要搞清楚不同离子在电极上的放电顺序这个不容易。
比如说,为啥这个离子先反应而不是那个离子。
- 关键点:理解电极反应式的书写以及整个电解过程中的能量变化。
就像解开密码锁一样,掌握了这两个,就基本掌握了电解原理应用这个难题。
④考点分析:在考试中这是必考的呀。
会从电极反应式书写、电解产物判断、根据电解计算这些方面来考查。
就像在射击场上,出题老师会从这些角度向同学们瞄准来考查大家。
三、详细讲解【理论概念类】①概念辨析:核心就是利用电解反应来实现各种物质的制取或者改变物品表面性质。
②特征分析:- 一定是在外接电源下发生反应。
没有电源这个推动器就启动不了。
- 有阴极和阳极,阴极得到电子,阳极失去电子,就像有两个阵营,电子在这两个阵营间转移。
③分类说明:- 按电解质状态可分为溶液电解和熔融态电解。
溶液电解就像在水里搅拌下发生反应,熔融态电解则是在把盐类等融化之后的状态下反应。

第三课时电解原理及其应用【课时目标】1、电解原理、装置、构造。
2、电极的判断、电极反应、电极方程式的书写3、电解原理的应用:铜的电解精练、电镀、氯碱工业等4、离子的放电顺序、电解的有关计算教学环节复习提问:1、铅蓄电池的电极反应式2、氢氧燃料电池的电极反应式①硫酸做电解液②氢氧化钾做电解质授课:一、知识梳理(一)电解原理1、电解定义。
电解池是把电能转化为化学能的装置,装置特点:借助于电流引起氧化还原反应的装置。
2、从装置名称、能量转化、电极名称、电极反应、溶液中的离子移方向、电子流向对原电池与电解池进行对比,从而理解电解的原理。
更清晰的认识原电池与电解池的特点。
3、电极产物的判断:阳极放电顺序:S2->I->Br->Cl->OH->含氧酸根阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na +>Ca2+>K+。
处理有关电解池两极产物的问题,一定要先看电极是活性电极还是惰性电极。
活性电极在阳极放电,电极溶解生成相应的金属离子,此时阴离子在阳极不放电。
对于惰性电极,则只需比较溶液中定向移动到两极的阴阳离子的放电顺序即可。
学生根据放电顺序书写电极反应方程式。
并有阴阳极的产物判断恢复到原状态需要加入的物质,判断溶液PH值的变化。
(二)电解的应用1、氯碱工业①阴阳极电极反应式及总反应式的书写②阴阳极的产物及检验方法③了解离子交换膜的作用④食盐的精制2、电解精炼,阳极材料是——粗铜,阴极材料是——精铜,电解质溶液是CuSO4溶液(或Cu(NO3)2溶液)。
粗铜中的杂质去向,3、电镀(1)形成条件:①电解时镀层金属作阳极;②镀件作阴极;③含镀层金属离子的电解质溶液作电镀液;④用直流电源。
(2)特征:①阳极本身放电被氧化;②宏观上看无新物质生成;③电解液的总量、浓度、pH均不变。

【一. 教学内容:电解原理及应用二. 教学目标理解电解原理,驾驭电极反应式的书写及电解原理的应用三. 教学重点、难点电解原理[教学过程]一、电解原理:电解是电流通过电解质溶液而在阴、阳两极发生氧化还原反应的过程;电解池是将电能转化为化学能的装置;构成条件为:必需连接有直流电源,要有电极(阴、阳极),以及电解质溶液或熔融电解质。
在电解过程中与电源正极相连的极称为阳极,在阳极上发生氧化反应;与电源负极相连的极称为阴极,在阴极上发生还原反应;电解质溶液中的阴离子移向阳极,阳离子移向阴极。
说明:1、电解质溶液的导电过程实质上就是其电解过程。
在电解池中电子流向:电子由电源的负极→电解池的阴极,再由电解质溶液→电解池的阳极→电源正极。
溶液中离子的移动方向:溶液中阳离子向阴极移动,阴离子向阳极移动。
3、电解池与原电池的推断:有外加电源的装置肯定是电解池,无外加电源的装置肯定是原电池, 多池组合时, 一般是含有活泼金属的池为原电池,其余都是在原电池带动下工作的电解池;若最活泼的电极相同时,则两极间活泼性差别较大的是原电池,其余为电解池。
4、电解池的反应原理:放电:阳离子得到电子或阴离子失去电子。
离子放电的依次取决于离子的本性,也与离子浓度和电极材料有关。
(1)阳极产物的推断先看电极,若是活泼电极(金属活动依次表Ag以前,包含Ag),电极放电,溶液中的阴离子不放电;若是惰性电极(如铂、石墨等),则看溶液中阴离子的失电子实力。
在惰性电极上,阴离子放电依次为:(2)阴极产物的推断:干脆依据阳离子放电依次进行推断,阳离子放电依次为:留意:高价含氧酸根离子一般不放电5、分析电解问题的基本思路:通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
通电时:阴离子移向阳极,阳离子移向阴极,结合放电依次分析谁优先放电。
写电极反应式,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的改变、pH改变等。
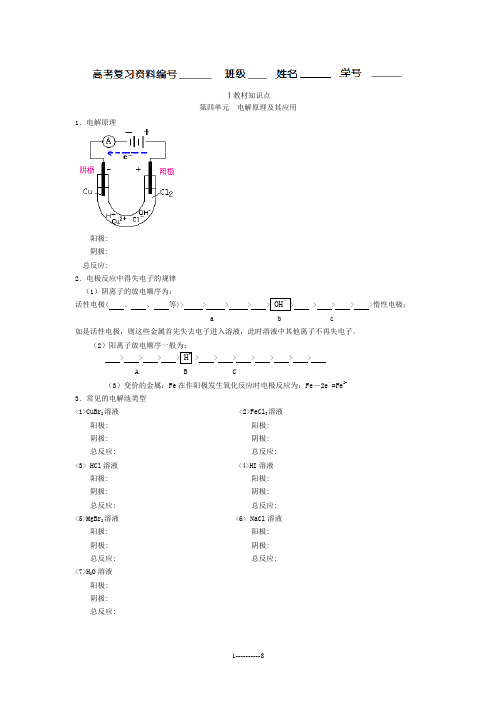
Ⅰ教材知识点第四单元电解原理及其应用1.电解原理阳极:阴极:总反应:2.电极反应中得失电子的规律(1)阴离子的放电顺序为:活性电极( 、、等)> > > > > > > > > >惰性电极;a b c如是活性电极,则这些金属首先失去电子进入溶液,此时溶液中其他离子不再失电子。
(2)阳离子放电顺序一般为:> > > > > > > > > > >A B C(3)变价的金属:Fe在作阳极发生氧化反应时电极反应为:Fe-2e-=Fe2+3.常见的电解池类型<1>CuBr2溶液 <2>FeCl3溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<3> HCl溶液 <4>HI溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<5>MgBr2溶液 <6> NaCl溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<7>H2O溶液阳极:阴极:总反应:<8> NaOH溶液 <9>KOH溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<10> CuSO4溶液 <11> AgNO3溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<12>HNO3溶液 <13>H2SO4溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:<14>KNO3溶液 <15>Na2SO4溶液阳极: 阳极:阴极: 阴极:总反应: 总反应:Ⅱ习题精练一、选择题1.标明下列装置中的阴阳极(或正负极)并写出电极反应式①阳极: ②阳极:阴极: 阴极:总反应: 总反应:③阳极: ④阳极:阴极: 阴极:总反应: 总反应:2、如上图,X,Y分别是电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 [ ]3.在某电解质溶液里,用M和N做电极,通电一段时间后,发现M极质量减小,N极质量增大,符合这一情况的是 [ ]A.电解质溶液是稀硫酸B.金属M是阳极,金属N是阴极C.M和N是石墨电极D.M是阴极,N是阳极4、当两极都用银片作电极电解AgNO3溶液时,在阳极上的产物是()A、只有银B、银和氧气C、只有氢气D、上述都不对5.当用铜作电极电解硫酸铜水溶液时,在阴极的产物是()A、CuB、Cu和O2C、O2D、H26.氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。
电解原理的应用计算1. 简介电解是通过电流在电解质溶液中引起化学反应的过程。
在许多领域中,电解原理都有着广泛的应用。
本文将介绍电解原理的应用计算方法。
2. 电解方程式电解方程式描述了电解质溶液中化学反应的化学方程式。
电解方程式的形式可以根据具体反应的类型来确定。
以下是常见的电解方程式形式:•离子间转移:例如,氯离子在溶液中氧化成氯气的电解方程式可以表示为:2Cl^- -> Cl2 + 2e^-•水的电离:例如,水在电解质溶液中电离成氢离子和氧离子的电解方程式可以表示为:2H2O -> 2H2 + O23. 电解质浓度计算在电解过程中,电解质的浓度对反应速率和产物生成量有着重要影响。
为了计算电解质的浓度,我们可以使用下面的公式:浓度 = 电量 / 电荷数 / Faraday常数 / 溶液体积其中,电量表示通过溶液的总电荷数,电荷数表示参与反应的离子的电荷数,Faraday常数表示电解质在1mol电子转移过程中所需电荷数,溶液体积表示电解质溶液的体积。
4. 电流密度计算电流密度表示通过单位面积的电流量,常用单位为安培/平方米(A/m^2)。
在电解反应中,电流密度对于研究电解过程的效率和性能具有重要意义。
电流密度的计算公式如下:电流密度 = 电流 / 电极表面积其中,电流表示通过电解系统的总电流量,电极表面积表示参与电解反应的电极的表面积。
5. 电解反应速率计算电解反应速率是指在电解过程中反应物消耗或产物生成的速率。
电解反应速率的计算方法取决于具体的反应类型和机制。
一般来说,电解反应速率可以通过测量反应物浓度的变化来确定。
以下是一种常见的电解反应速率计算方法:•定量测量反应物浓度:选取适当的时间间隔,测量反应物浓度的变化,并绘制浓度随时间变化的曲线。
•根据浓度变化确定速率:根据浓度随时间的变化曲线,确定反应物消耗或产物生成速率的斜率。
6. 电解过程的能量计算电解过程中,能量的转化也是一个重要的因素。