3、2NH4HSO4 + 2NaOH == (NH4)2SO4 + Na2SO4+ 2H2O 为什么?
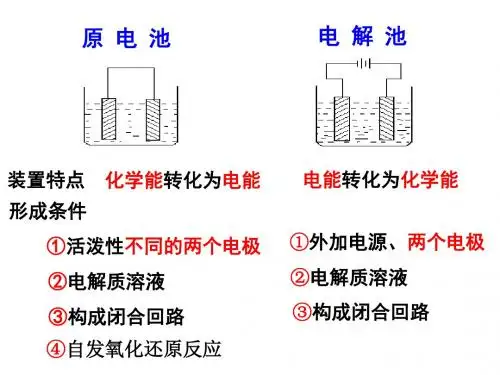
原电池反应的基础是氧化还原反应,故从理论上说任何一个自 发进行的氧化还原反应因都会有电子转移的存在,都可能成为 原电池反应
双液原电池
(1)盐桥? (2)作用? 导线的作用是传递电子, 沟通外电路。 盐桥的作用:1.连接内电 路,形成闭合回路 2.平 衡电荷,使原电池不断产 生电流
第三步:根据电池总反应式和正极反应式写出电池的负极反应式 电池的总反应和正、负极反应之间有如下关系:电池的总反应式=电池正极反应式+ 电池负极反应式故根据第一、二步写出的反应,有:电池的总反应式-电池正极反应 式=电池负极反应式,注意在将两个反应式相减时,要约去正极的反应物O2。
银锌电池(电解质为KOH)
_正__(A__g_)__电极。
原电池的设计
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设 计一个单液原电池,一个双液原电池画出原电
池的示意图,并写出电极反应。
参
(-)
Zn
盐桥
C (+)
FeCl3 溶液
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
虑氢、氧的氧化还原):
(1)放电时电解液中 H2SO4 的浓度将变_____小_________;
当外电路通过 1 mol 电子时,理论上负极板的质量增加
____4__8__g。
(2)在完全放电耗尽 PbO2 和 Pb 时,若按右图连接,电解
一段时间后,则在 A 电极上生成___P__b___,B 电极上生 成对___P_换_b__O__2___,此时铅蓄电池的正负极的极性将