物理化学第一章-热力学
- 格式:ppt
- 大小:8.98 MB
- 文档页数:126
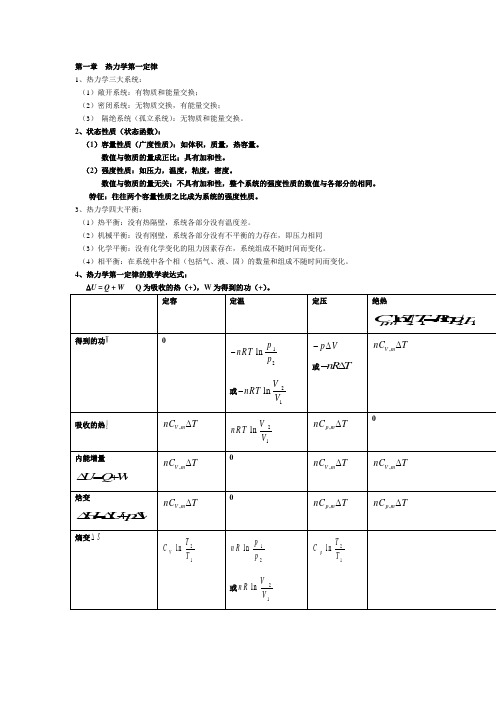
第一章 热力学第一定律 1、热力学三大系统:(1)敞开系统:有物质和能量交换; (2)密闭系统:无物质交换,有能量交换; (3) 隔绝系统(孤立系统):无物质和能量交换。
2、状态性质(状态函数):(1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
(2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
3、热力学四大平衡:(1)热平衡:没有热隔壁,系统各部分没有温度差。
(2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同 (3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。
(4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。
4、热力学第一定律的数学表达式:∆U = Q + W Q 为吸收的热(+),W 为得到的功(+)。
定容定温定压绝热,2121l n l n p m C T T Rpp = 得到的功W12lnp nRT p -或21lnV nRTV -p V-∆或n R T -∆,V m nC T∆吸收的热Q,V m nC T∆21ln V nR T V,p m nC T∆内能增量 U Q W ∆=+ ,V m nC T∆,V m nC T∆,V m nC T∆焓变H U pV ∆=∆+∆ ,V m nC T∆,p m nC T∆,p m nC T∆熵变S∆21ln V TC T12ln p n R p或21lnV n RV21ln p T C T亥姆霍兹(定温定容) A U T S ∆=∆+∆ pdV-⎰吉布斯(定温定压) G H T S ∆=∆-∆21lnp nRT p12、在通常温度下,对理想气体来说,定容摩尔热容为:单原子分子系统,V mC =32R双原子分子(或线型分子)系统 ,V m C =52R 多原子分子(非线型)系统 ,V mC 632R R ==定压摩尔热容:单原子分子系统 ,52p m C R =双原子分子(或线型分子)系统 ,,p m V m C C R -=,72p m C R =多原子分子(非线型)系统 ,4p m C R =可以看出:,,p m V m C C R -=13、,p mC的两种经验公式:,2p m C a b T c T =++ (T 是热力学温度,a,b,c,c’ 是经,2'p m c C a b T T=++ 验常数,与物质和温度范围有关)14、在发生一绝热过程时,由于0Qδ=,于是dU W δ= 理想气体的绝热可逆过程,有:,V m n C d T p d V=- ⇒22,11l n l n V m T V C R T V =-21,12l n ,l n V m p V C C pm p V ⇒=,,p m V mC p V C γγ=常数 =>1.15、-焦耳汤姆逊系数:J T T=()H pμ∂∂-J T μ->0 经节流膨胀后,气体温度降低;J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。





物理化学第二版习题答案物理化学是研究物质的物理性质和化学性质以及它们之间的相互关系的一门学科。
对于学习物理化学的学生来说,习题是巩固知识、提高能力的重要途径之一。
下面将为大家提供物理化学第二版习题的答案,希望对广大学生有所帮助。
第一章:热力学基础1. 答案:热力学是研究物质在能量转化过程中的规律的科学。
它主要研究能量的转化和守恒规律,以及物质在这个过程中的性质变化。
2. 答案:热力学第一定律是能量守恒定律,即能量可以从一种形式转化为另一种形式,但总能量守恒不变。
3. 答案:热力学第二定律是能量转化过程中的不可逆性原理,即自发过程的方向是从有序向无序的方向进行。
第二章:热力学函数1. 答案:热力学函数是描述物质性质和状态的函数,如内能、焓、自由能等。
2. 答案:内能是系统所拥有的全部能量的总和,包括系统的动能和势能。
3. 答案:焓是系统的内能和对外界做的功之和,常用符号表示为H。
第三章:热力学第一定律的应用1. 答案:热容量是物质吸收或释放热量时的温度变化与热量变化之比。
2. 答案:绝热过程是指在过程中系统与外界没有热交换,即系统的热容量为零。
3. 答案:等温过程是指在过程中系统的温度保持不变,即系统与外界的热交换量为零。
第四章:热力学第二定律的应用1. 答案:熵是描述系统无序程度的物理量,表示系统的混乱程度。
2. 答案:熵增原理是热力学第二定律的数学表达式,它指出孤立系统的熵总是增加的。
3. 答案:卡诺循环是一种理想的热机循环,它由等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程组成。
第五章:相变和化学平衡1. 答案:相变是指物质由一种相转变为另一种相的过程,如固态到液态、液态到气态等。
2. 答案:平衡态是指系统各种性质的变化不再随时间变化,达到动态平衡的状态。
3. 答案:化学平衡是指在封闭容器中,反应物和生成物浓度达到一定比例时,反应速率前后保持不变的状态。
第六章:化学动力学1. 答案:化学动力学是研究化学反应速率和反应机理的学科。
第一章总结一热力学基本概念①系统分类:敞开、封闭、孤立②平衡态:各部分宏观性质不变,无宏观流③性质分类:广度,强度④状态函数及特点:1)2)3)⑤过程分类:恒温、恒容、绝热、恒压⑥可逆过程:无损耗、过程无限缓慢、做功最大或最小⑦理想气体物态方程:PV=nRT二热力学定律1)热力学第零定律:分别于第三物体达到平衡的两物体,他们彼此也一定互呈热平衡(确定温度)2)热力学第一定理:dU=δQ+δW焓的定义:dH=dU+d(PV)3)热力学第二定律:ds≥δQ/T=>“>”不可逆过程,T表环境温度“=”可逆过程,环境温度等于体系温度“<”熵变小于热温商过程不可能发生自发过程特征:一定方向和限度;不可逆;存在方向限度的决定因素。
又卡诺定理推出热力学第二定理:η=(Q1+ Q2)/Q1=(T1- T2)/T1=>(T2-T1)/T2>1+Q1/Q2 (卡诺定理)=>Q1/T1+Q2/T2<0=>dS≥δQ/T4)热力学第三定理:0K时任何完美晶体熵等于0理想气体各可逆过程重要变量计算过程 W Q △U △H △S自由膨胀 0 0 0 0 nRIn(V2/V1) 恒容 0 n Cv.m dT n Cv.m dT n m .p C dT n Cv.m In(V2/V1) 恒温 nRTIn(V2/V1) nRTIn(V2/V1) 0 0 nRTIn(V2/V1) 绝热 n Cv.m dT=(P2V2-P1V1)/(r-1) 0 n Cv.m dT n m p .C dT 0恒压 -pdT n m .p C dT n Cv.m dT n m .p C dT n m .p C In(V2/V1)。