吡啶衍生物
C O O H
C ONH2
N
N
烟酸
烟酰胺
C ONHNH2 N
异烟肼
即维生素PP,是B族维生 素之一,它能促进组织新 陈代谢,体内缺乏时能引 起粗皮病。
又称“雷米封 (Rimifon)”, 是治疗结核病 的良好药物。
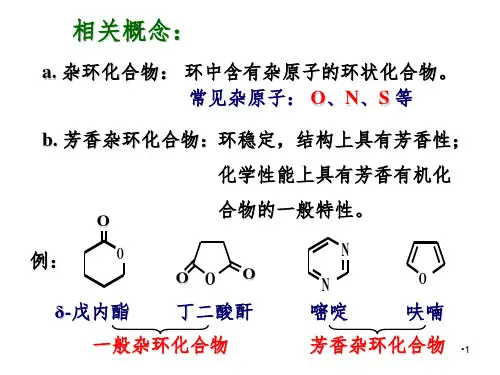
三、嘧啶及其衍生物
4
5
3
6
2
1
环上电子云密度比吡啶更低, 亲电取代更困难
2、键长的平均化程度较差
139pm
3、
Π
6 5
,环上电子云密度比苯环大, 亲电取代活性更高
二、吡咯、呋喃和噻吩的化学性质
(一)吡咯的酸碱性
吡咯的碱性? (N孤电子对接受H+的能力)
吡咯的酸性? (N孤电子对参与共轭, N-H键极性增强)
+ KOH N H
N K+
+ H2O
(二)亲电取代反应
1、亲电取代的难易程度? 原因? 2、取代位置?
Classification :
按杂原子数目分:
一个、两个或多个杂原子的杂环
按环的形式分:
单杂环和稠杂环
按环的大小分:
五元杂环和六元杂环
小于五元或大于六元的杂环??
4
3β
5
1
N H
2α
吡咯(pyrrole)
五元杂环
4
3β
5 S 2α 1
噻吩(thiophene)
4
3β
5
2α
O
1
呋喃(furan)
易溶于水, 弱碱性(pKb=11.30)
嘧啶衍生物
NH2 N
O H
N
O