有机化学-第14章 杂环化合物
- 格式:ppt
- 大小:699.50 KB
- 文档页数:59


有机化学基础知识点整理杂环化合物的性质与应用杂环化合物是有机化学中一类具有杂原子(通常是氮、氧、硫等非碳原子)构成的环状分子。
它们具有多种独特的性质和广泛的应用。
本文将整理一些重要的有机化学基础知识点,涵盖杂环化合物的性质和应用。
一、杂环化合物的命名和结构杂环化合物的命名使用通常的有机化学命名法,如官能团命名法、光谱法等。
其结构通常由杂原子和碳原子组成,可以包含一个或多个杂环。
其中,氮杂环化合物如吡嗪、噻吩和咪唑等具有广泛的结构多样性和化学活性。
二、杂环化合物的性质1. 杂环化合物的稳定性:杂环化合物中的杂原子可以增加分子的稳定性,一些杂环化合物比它们的同系物更稳定。
例如,咪唑酮比噻唑酮更稳定,这是由于含氮原子的电子亲和力高于含硫原子的电子亲和力。
2. 杂环化合物的化学反应:杂环化合物中的杂原子可以参与许多重要的化学反应,如亲电取代、亲核取代、氧化还原等。
以氮杂环化合物为例,它们可以发生亲电取代反应,如芳香性亲电取代、加成反应等。
3. 杂环化合物的光学性质:杂环化合物中存在的共轭体系可以产生有趣的光学性质,如荧光、蓝光发射等。
研究人员利用这些性质开发出许多发光材料,应用于有机光电子器件、荧光探针等领域。
三、杂环化合物的应用1. 杂环化合物在药物领域的应用:许多杂环化合物具有药理活性,并被用作药物的活性成分。
例如,噻唑类和咪唑类化合物具有抗菌和抗肿瘤活性,吡唑类和吡唑酮类化合物被广泛应用于抗癌药物研究。
2. 杂环化合物在染料领域的应用:杂环化合物可以用作染料分子的基础结构,赋予染料分子良好的色谱性能和稳定性。
它们在纺织、油墨和染料敏化太阳能电池等领域有广泛应用。
3. 杂环化合物在有机电子器件中的应用:杂环化合物具有优异的载流子传输性能和独特的光学性质,因此被广泛应用于有机发光二极管(OLED)、有机太阳能电池和有机场效应晶体管等器件中。
四、结语本文对有机化学基础知识中的杂环化合物的性质和应用进行了整理和阐述。



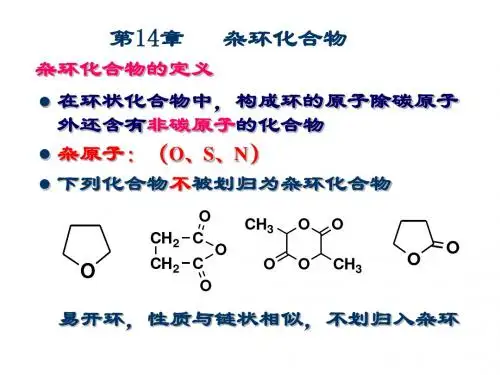
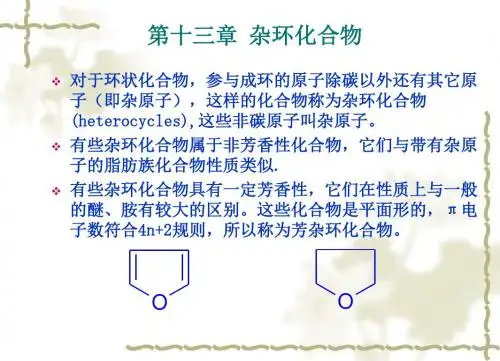




第14章杂环化合物杂环化合物是由碳原子和非碳原子共同组成环状骨架结构的一类化合物。
这些非碳原子统称为杂原子,常见的杂原子为氮、氧、硫等。
前面已经学过的内酯、内酰胺、环醚等化合物都是杂环化合物,但是这些化合物的性质与同类的开链化合物类似,因此都并入相应的章节中讨论。
本章将主要讨论的是环系比较稳定、具有一定程度芳香性的杂环化合物,即芳杂环化合物。
杂环化合物的种类繁多,数量庞大,在自然界分布极为广泛,许多天然杂环化合物在动、植物体内起着重要的生理作用。
例如:植物中的叶绿素、动物血液中的血红素、中草药中的有效成分生物碱及部分苷类、部分抗生素和维生素、组成蛋白质的某些氨基酸和核苷酸的碱基等都含有杂环的结构。
在现有的药物中,含杂环结构的约占半数。
因此,杂环化合物在有机化合物(尤其是有机药物)中占有重要地位。
第一节分类和命名一、杂环化合物的分类芳杂环化合物可以按照环的大小分为五元杂环和六元杂环两大类;也可按杂原子的数目分为含一个、两个和多个杂原子的杂环,还可以按环的多少分为单杂环和稠杂环等。
见表14-1。
表14-1 有特定名称的杂环的分类、名称和标位二、杂环化合物的命名杂环化合物的命名比较复杂。
现广泛应用的是按IUPAC(1979)命名原则规定,保留特定的45个杂环化合物的俗名和半俗名,并以此为命名的基础。
我国采用“音译法”,按照英文名称的读音,选用同音汉字加“口”旁组成音译名,其中“口”代表环的结构。
见表14-1。
(二)杂环母环的编号规则当杂环上连有取代基时,为了标明取代基的位置,必须将杂环母体编号。
杂环母体的编号原则是:1.含一个杂原子的杂环含一个杂原子的杂环从杂原子开始编号。
见表14-1中吡咯、吡啶等编号。
2.含两个或多个杂原子的杂环含两个或多个杂原子的杂环编号时应使杂原子位次尽可能小,并按O、S、NH、N 的优先顺序决定优先的杂原子,见表14-1中咪唑、噻唑的编号。
3.有特定名称的稠杂环的编号有其特定的顺序有特定名称的稠杂环的编号有几种情况。