天津育才中学人教版初中9年级化学第三章简答题专项测试题(含答案解析)
- 格式:docx
- 大小:354.11 KB
- 文档页数:15

一、解答题1.下图形象地表示甲、乙两种变化,其中“●”和“○”分别表示氧原子和氢原子,请从微观角度回答下列问题。
(1)甲、乙这两种变化的本质区别是:__________;(2)乙中与分子构成的不同点为______。
解析:甲变化不生成新物质、乙变化生成新物质;“”是同种原子(氧原子)构成“”是由两种原子(氢原子和氧原子)构成(或:一种分子是由一种原子构成的,另一种分子是由两种原子构成的)。
(1)甲变化是水分子之间的间隙变大,没有新分子生成,是物理变化;而乙变化是氢分子和氧分子转化为水分子,有新分子生成,是化学变化。
(2)的1个分子是由2个氧原子构成,的1个分子是由两个氢原子和1个氧原子构成。
2.模型是联系宏观与微观的桥梁。
(1)图1是钠原子结构示意图,图中“X”的数值为 _____ 。
(2)某化学反应的微观示意图如图2所示,据图回答问题,请写出这个反应的化学方程式: _____ 。
(3)2017年5月9日,中国科学院发布了 113号、115号、117号及118号四种元素的中文名称,其中一种元素在元素周期表中的信息如图3所示,下列有关该元素说法错误的是_____ 。
A.相对原子质量为288 B.核内有115个质子C.是非金属元素 D.核内有173个中子(4)图4中ABCD四种粒子的结构示意图都具有 _____ 结构。
2H S+3O=2SO+2H O C 相对稳定(或最外层电子数相同)解析:2222【分析】(1)根据原子结构示意图的意义解答;(2)根据化学反应的微观示意图分析反应物、生成物写出反应的化学方程;(3)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析解答即可。
(4)根据最外层电子数都为8,属于稳定结构解答。
(1)原子结构示意图中质子数等于核外电子数,求得x=8;(2)由图2可知,反应物是H2S和O2,生成物是SO2和H2O,故反应方程式为:2H S+3O=2SO+2H O;2222(3)A、由图可知,相对原子质量为288,正确;B、核内质子数等于原子序数,故核内由115个质子,正确;C、由图可知,该元素为金属元素,错误;D、中子数=相对原子质量-质子数,288-115=173 ;正确。
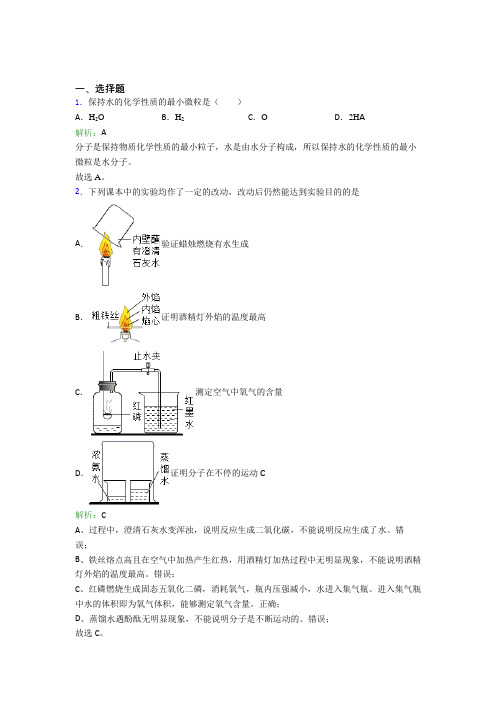
一、选择题1.保持水的化学性质的最小微粒是()A.H2O B.H2C.O D.2H A解析:A分子是保持物质化学性质的最小粒子,水是由水分子构成,所以保持水的化学性质的最小微粒是水分子。
故选A。
2.下列课本中的实验均作了一定的改动,改动后仍然能达到实验目的的是A.验证蜡烛燃烧有水生成B.证明酒精灯外焰的温度最高C.测定空气中氧气的含量D.证明分子在不停的运动C解析:CA、过程中,澄清石灰水变浑浊,说明反应生成二氧化碳,不能说明反应生成了水。
错误;B、铁丝熔点高且在空气中加热产生红热,用酒精灯加热过程中无明显现象,不能说明酒精灯外焰的温度最高。
错误;C、红磷燃烧生成固态五氧化二磷,消耗氧气,瓶内压强减小,水进入集气瓶。
进入集气瓶中水的体积即为氧气体积,能够测定氧气含量。
正确;D、蒸馏水遇酚酞无明显现象,不能说明分子是不断运动的。
错误;故选C。
3.下列各组元素中,元素符号的大写字母完全相同的一组是()A.镁、锰、锌B.铝、银、汞C.氖、钠、硅D.氯、钙、铜D解析:DA、镁、锰、锌元素符号分别为Mg、Mn、Zn,元素符号的大写字母不完全相同,A错误。
B、铝、银、汞元素符号分别为Al、Ag、Hg,元素符号的大写字母不完全相同,B错误。
C、氖、钠、硅元素符号分别为Ne、Na、Si,元素符号的大写字母不完全相同,C错误。
D、氯、钙、铜元素符号分别为Cl、Ca、Cu,元素符号的大写字母完全相同,D正确。
故选:D。
4.建立宏观和微观之间的联系对学习化学十分重要。
下列事实的微观解释错误的是()A.香水挥发﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.液氧与气态氧气都能支持燃烧﹣﹣同种物质的分子,性质相同D.10mL 水与 10mL 酒精混合后体积小于 20mL﹣﹣分子间有间隔B解析:BA、香水挥发,是因为香水中物质的分子是在不断的运动的,运动到空气中,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,水分子没发生改变,故选项解释错误。

一、选择题1.用分子的知识解释下列现象,其中合理的是A.水银温度计测体温的原理,是因为温度升高,分子的间隔增大B.变瘪了的乒乓球放在热水中鼓起,是由于分子的体积变大C.加入糖的水变甜,是由于分子永不停息的做无规则运动D.1L大豆与1L水混合后总体积小于2L,是由于分子间有间隙C解析:CA、水银是汞的俗称,汞是由原子构成的,水银温度计测体温的原理,是因为温度升高,原子的间隔增大,选项说法不合理;B、变瘪了的乒乓球放在热水中鼓起,是由于分子的间隔变大,而不是体积变大,选项说法不合理;C、分子是在永不停歇的做无规则运动的,所以加入糖的水变甜,选项说法合理;D、1L大豆与1L水混合总体积小于2L,大豆是宏观的物质,不能说明分子间有间隔,选项说法不合理。
故选:C。
2.从氧化汞分子分解示意图中我们能获得许多信息,其中描述错误的是A.这是一个分解反应B.分解反应的生成物都是单质C.在化学变化中,分子可分而原子不可分D.分子、原子都能构成物质B解析:BA、由图示可知:氧化汞分解过程中,氧化汞分子变成了汞原子和氧分子,既一种物质生成两种物质的反应,属于分解反应,故A的描述正确;B、该图示可知汞、氧气都含有一种元素,属于单质,但并不是所有的分解反应生成物都是单质,如过氧化氢分解制氧气同时生成水,故B描述错误;C、由图示可知:氧化汞分解过程中,氧化汞分子变成了汞原子和氧分子,因此分子种类发生改变而原子的种类没有变化,故C描述正确;D、由图示可知:氧化汞与氧气由分子构成,而汞由原子构成,因此分子、原子都能构成物质,故D描述正确;故选:B。
3.从下图所示的两种微粒结构示意图中,所获取信息不正确的是A.它们属于不同种元素B.它们的核外电子层数相同C.它们的核外电子数相同D.它们都属于金属元素D解析:DA、元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),同种元素的粒子是质子数相同,两种微粒的质子数分别为8、10,不属于同种元素,故选项说法正确。

一、选择题1.如图所示的是氧原子结构示意图和硫元素在元素周期表中的信息。
下列说法正确的是A.氧原子核外有6个电子B.硫属于金属元素C.硫原子的相对原子质量为32.06gD.一个硫原子有16个质子D解析:DA、由图可知,氧原子核外有8个电子,不符合题意;B、由“石”字旁可知,硫元素属于非金属元素,不符合题意;C、在元素周期表中,元素名称下方的数字表示相对原子质量,故硫原子的相对原子质量为32.06,相对原子质量是一个比值,单位为“1”,常省略不写,不符合题意;D、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=16,符合题意。
故选D。
2.北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。
在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法正确的是A.锰属于非金属元素B.原子核内中子数为25C.相对原子质量为54.94gD.锰原子变成锰离子是化学变化D解析:DA、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是锰,带“钅”字旁,属于金属元素,故选项说法错误。
B、根据元素周期表中的一格可知,左上角的数字为25,表示原子序数为25;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数和核外电子数为25,而不是中子数为25,故选项说法错误。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94,相对原子质量单位是“1”,不是“克”,故选项说法错误。
D、锰原子变成锰离子,是由原子构成的物质生成了由离子构成的物质,有新物质生成,属于化学变化,故选项说法正确。
故选:D。
3.推理是学习化学的一种重要的方法,下列推理得出的相关结论合理的是()A.阳离子一定带正电荷,所以带正电荷的粒子一定是阳离子B.化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物C.氧化物中含有氧元素,所以含氧元素的化合物都是氧化物D.分子、原子可以构成物质,所以物质一定都是由分子或原子构成的B解析:BA、阳离子一定带正电荷,带正电荷的粒子不一定是阳离子,如质子不是阳离子,不符合题意;B、由两种或两种以上的元素组成的纯净物叫化合物,化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物正确,符合题意;C、氧化物中含有氧元素,含氧元素的化合物不都是氧化物,如高锰酸钾不是氧化物,因为氧化物只有两种元素,不符合题意;D、分子、原子可以构成物质,构成物质的微粒有三种:分子、原子、离子,不符合题意。

一、选择题1.下列根据粒子结构示意图归纳出的信息正确的是()A.①②两种元素化学性质相似B.只有③④具有相对稳定结构C.③④都属于阴离子D.②③属于同种元素的不同种粒子D解析:DA、最外层电子个数相同,元素的化学性质相似,①中只有一个电子层,该电子层上有两个电子,已达到稳定结构,②的最外层电子数是2,小于4,易失去最外层电子,化学性质不稳定。
所以①②两种元素化学性质不相似,此选项错误;B、③④的最外层电子数是8,已达到稳定结构,①中只有一个电子层,该电子层上有两个电子,已达到稳定结构,具有稳定结构的是①③④;此选项错误;C、③中,质子数>核外电子数,为阳离子;④中质子数<核外电子数,为阴离子,此选项错误;D、②③的质子数相同,电子数不同,属于同种元素的不同种粒子,此选项正确。
故选D。
2.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的原子结构示意图如图所示。
下列说法不正确的是()A.铷属于金属元素B.m的值是37,n的值是1C.铷的相对原子质量为85.47D.氯化铷的化学式为RbCl2D解析:D【分析】本题考查学生对元素周期表中的信息提取能力。
A、37号元素的名称是“铷”,带“钅”字旁,属于金属元素,不符合题意;B、“铷”的原子序数为37,即质子数为37,核电荷数为37,原子结构示意图中m表示质子数或核电荷数,故m的值为37,则n= m-(2+8+18+8)=1,不符合题意;C、由图可知铷的相对原子质量为85.47,不符合题意;D、铷的最外层电子数为1,容易失去一个电子形成“Rb+”,所以氯化铷的化学式为“RbCl”,而不是“RbCl2”,符合题意。
故选D。
【点睛】易错点:1、n、m值,2、氯化铷的化学式书写,要结合最外层电子数。
3.北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。

第三单元测评(时间:45分钟满分:100分)一、快乐点击(每小题3分,共30分)1.下列粒子中,能表示2个氢分子的是()A.2HB.2H+C.H2OD.2H22.已知锰原子的质子数为25,相对原子质量为55,则锰原子的电子数为()A.25B.30C.55D.803.如图为某化学反应的微观模拟图,表示氧原子,表示氢原子,表示水分子。
下列说法错误的是()A.该反应的基本类型是化合反应B.生成物为混合物C.原子是化学变化中的最小粒子,元素的种类在反应前后不变D.在化学变化中分子分成原子,原子又重新组合成新物质的分子4.下列粒子结构示意图中,表示阴离子的是()5.下列各图中和分别表示两种不同元素的原子,其中表示混合物的是()6.下列有关分子、原子、离子的说法正确的是()A.分子是保持物质性质的最小粒子B.物质都是由分子构成的C.原子是由原子核、中子、电子构成的D.原子得失电子后形成离子7.与铝元素的化学性质关系最密切的是()A.铝原子的核外电子数B.铝原子的最外层电子数C.铝元素的相对原子质量D.铝元素的核电荷数8.铷元素在元素周期表中的信息与铷原子结构示意图如图所示,下列说法不正确的是()A.m=37,n=1B.铷原子的相对原子质量是85.468C.铷原子在化学变化中容易得到电子D.铷原子的质量主要由构成其原子核的质子和中子的质量决定9.下列说法中,不正确的是()A.Cl-是氯原子得到1个电子后形成的B.“Cu”可以表示铜原子,也可以表示铜元素C.碘原子的质子数为53,可推知其核外电子数为53D.铝原子的最外层有3个电子,在化学反应中易得到电子10.如图为元素周期表的一部分。
下列叙述错误的是()A.钙的核电荷数是20B.镁在化学反应中较易失去电子C.硫离子的结构示意图是D.每个周期结尾元素的化学性质都比较稳定二、积累运用(共39分)11.(3分)科学研究证实,物质是由粒子构成的,例如铁是由铁原子构成的。
天津育才中学九年级化学上册第三单元《物质构成的奥秘》测试题(含答案解析)一、选择题1.关于氧气、过氧化氢、二氧化碳中的每个分子中都含有A.2个氧原子B.1个氧分子C.氧元素D.氧气2.以下微观解释不正确的是()A.教室进行消杀后室内充满消毒液气味,说明分子在不断运动B.等质量的氧气和液氧,氧气体积比液氧大,说明分子间隔发生了变化C.氮气和氧气的化学性质不同,是因为构成这两种物质的分子不同D.和两种原子最外层电子数相同,所以它们具有相似的化学性质3.下列物质中,由分子构成的是A.铁B.硅C.氯化钠D.二氧化碳4.下列课本中的实验均作了一定的改动,改动后仍然能达到实验目的的是A.验证蜡烛燃烧有水生成B.证明酒精灯外焰的温度最高C.测定空气中氧气的含量D.证明分子在不停的运动5.下列物质中肯定为纯净物的是A.只由一种元素组成的物质B.只由氢,氧元素组成的物质C.只由一种分子构成的物质D.洁净的空气6.下列说法不正确的是A.燃烧、动植物的呼吸、金属锈蚀都是氧化反应B.硫在氧气中燃烧,集气瓶底要放少量的水,并在通风橱内进行C.发现元素周期律并编制元素周期表的化学家为道尔顿D.氮气的化学性质不活泼,食品包装中充氮气可以防腐7.推理是学习化学的一种重要方法,下列推理合理的是()A.离子是带电荷的粒子,则带电荷的粒子一定是离子B.单质是由同种元素组成的,但只含一种元素的不一定是单质C.同种元素的粒子具有相同的质子数,所以具有相同质子数的粒子一定属于同一种元素D.催化剂在化学变化前后质量不变,则在化学变化前后质量不变的一定是催化剂8.某元素R的原子序数为m,能够形成核外有x个电子的R n-离子,则下列关系正确的是A.m=nB.m=n+xC.m=n-xD.m=x-n9.下列说法正确的是A.春天里柳絮飘扬,说明分子是不断运动的B.氢气球在高空膨胀,是因为氢气分子体积变大C.水蒸发由液态变成气态的过程中,水分子之间的间隔保持不变D.水和二氧化碳性质不同,是因为不同分子的构成不同10.下列对宏观事实的微观解释错误的是A.夏天钢轨之间的缝隙变小——原子受热时体积变大B.闻到远处饭菜的香味——分子在不断地运动C.氢气和液氢都可做燃料——相同物质的分子,其化学性质相同D.水的三态变化一一分子的间隔发生了改变二、填空题11.根据图中提供的信息,回答下列问题:(1)汞元素属于_______(填“金属”或“非金属”)元素;(2)汞原子的核内质子数为_______;(3)A、B、C、D四种粒子中具有相对稳定结构的是_______(填字母,下同),属于同种元素的是_______;(4)当E中x=12时,该粒子属于_______(填“阳离子”或“阴离子”)。
一、解答题1.原子序数为1~18的元素的原子结构示意图等信息如下,请认真分析并回答下列问题。
(1)原子序数为12的元素位于元素周期表中第____周期,它属于____(填“金属”或“非金属”)元素。
(2)在化学反应中,原子序数为16的元素的原子容易_____(填“得到”或“失去”)电子,所形成的粒子的符号是______。
(3)根据氟原子和氯原子的结构示意图分析,由于氟原子和氯原子的_____相同,所以氟元素与氯元素的化学性质相似。
(4)同周期元素,从左到右,各元素原子随原子序数的增加,最外层电子数依次______。
解析:三金属得到 S2-最外层电子数增多【解析】试题分析:(1)12号元素是镁元素,其原子核外有3个电子层,所以在元素周期表中位于第三周期,镁属于金属元素;(2)16号元素是硫,其原子最外层有6个电子,在化学反应中易得到2个电子形成带两个单位负电荷的硫离子;(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,氟元素和氯元素化学性质相似的原因是它们的原子的最外层电子数相同;(4)同一周期元素之间从左到右,各元素原子随原子序数的增加,最外层电子数从1到8依次递增。
考点:考查原子结构示意图与离子结构示意图及元素周期表的特点及其应用的知识。
2.浓氨水有一股难闻的刺激性气味,在老师指导下,同学们对原实验装置进行了改进,改进后的装置如图所示,回答下面问题。
(1)实验中观察到B、C试管内的溶液都变成红色,但C试管内液体变色速率较快,由此实验现象得出的结论是①___②___。
(2)E所起的作用是___。
解析:氨分子不断运动温度越高,氨分子运动越快对比实验(1)BC中的酚酞变为红色,说明AD中的氨气分子运动到了BC 中使酚酞变红,故说明分子做无规则的运动。
C中的酚酞比B中的酚酞变红较快,说明D中的氨气分子运动速率较快,故可得温度越高,氨分子运动越快。
(2)装置E是为了和装置BC对比。
一、解答题1.如下图:A是铝在元素周期表中的有关信息,B~E是几种粒子的结构示意图。
(1)元素的相对原子质量为__________。
(2)上图中B、C、D、E四种粒子属于_________种元素,其中化学性质相似的是________(填字母),D粒子的化学符号是________。
(3)如图是甲和乙在一定条件下反应生成丙和丁的微观示意图,请根据图示回答问题.①一个丁分子是由______构成的.②该反应的化学方程式是_____________________________.解析:98 三 BE Al3+两个氢原子和一个氧原子 CO2+3H2 CH3OH+H2O (1)由图可知,该元素的相对原子质量为:26.98 。
(2)元素的种类是由质子数决定的,B、C、D、E四种粒子的质子数分别是8、13、16,故是三种元素的粒子。
元素的化学性质由最外层的电子数决定,图BE的最外层电子数相同,化学性质相似。
D粒子是13号元素的粒子,该粒子的核内质子数比核外电子数大3,故是带3个单位的正电荷的铝离子,符号为:Al3+。
(3)①、由图可知,1个丁分子是由2个氢原子和1个氧原子构成。
②、由图可知,该反应的反应物是CO2和H2 生成物是CH3OH和H2O,根据配平得化学方程式为:CO2+3H2 CH3OH+H2O。
2.如图是1~18号元素原子最外层电子数与原子核电荷数的关系图。
请回答下列问题:(1)1~18号元素中属于稀有气体元素的有______(填元素符号)。
(2)He和Be元素的原子最外层均有2个电子它们的化学性质是否相似?______。
(填“相似”或“不相似”)。
(3)某元素的原子序数为16,它在化学反应中一般易电子______(填“得到”或“失去”)。
(4)由图可知得到的信息是______解析:He、Ne、Ar 不相似得到随着原子核电荷数的递增,元素原子最外层电子数呈现周期性变化(1)因有一个电子层时,电子数为2即为稳定结构,则He为稀有气体。
一、填空题1.地壳中含量最多的元素是_____;保持水的化学性质的最小粒子是_____;与元素的化学性质关系最密切的是原子的_____。
O(或氧)水分子(或H2O)最外层电子数解析:O(或氧)水分子(或H2O)最外层电子数地壳中含量最多的元素是O(或氧);由分子构成的物质,分子是保持其化学性质的最小微粒,因此保持水的化学性质的最小粒子是水分子(或H2O);与元素的化学性质关系最密切的是原子的最外层电子数。
2.大千世界形形色色的物质都是由最基本成分――元素组成的。
回答下列问题:(1)一种元素与另一种元素的根本区别是______数不同.元素的化学性质与原子_________关系密切.(2)地壳中含量第二的非金属元素是_____(填“元素名称”);地壳中含量第二的金属元素是_____(填“元素符号”).质子最外层电子数硅Fe解析:质子最外层电子数硅 Fe(1)元素是质子数相同的一类原子的总称,故一种元素和另一种元素的最根本的区别是质子数不同,原子最外层电子数的多少决定了原子失去电子或得到电子,所以原子的最外层电子数与元素的化学性质密切相关。
(2)地壳中元素含量由多到少前五位的分别是氧、硅、铝、铁、钙,硅是含量第二的非金属元素,铁是含量第二的金属元素。
3.在宏观、微观和符号之间建立联系是化学学科的特点,请回答下列问题。
(1)图1中A、B、C、D是四种粒子的结构示意图。
①图中A、B、C、D属于___________种元素的粒子,A的微粒符号___________。
②A、B、C、D四种粒子中,不具备稳定结构的是___________(填序号)。
③D中X=___________(2)图2中●和〇分别表示不同元素的原子,则其中表示混合物的是___________(填序号,下同),表示纯净物的有___________。
Mg2+B8ACBD解析:Mg2+ B 8 AC BD(1)①图1中的四种粒子的质子数有三种情况,所以表示有3种元素,A粒子的质子数为12,核外有10个电子,是带有2个单位正电荷的镁离子Mg2+;②最外层有8个电子的结构(氦为2个)属于稳定结构,D中,质子数=电子数,所以X=8,则A、C、D均属于稳定结构,B粒子的最外层有2个电子,在化学反应中易失去最外层的2个电子,属于不稳定结构;故填:B;③D粒子的质子数为18,是稀有气体元素的原子--氩原子,其质子数=核外电子数,所以X=8;(2)A中存在不同种原子,属于混合物;B中只存在一种分子,属于纯净物;C中存在两种分子,属于混合物;D中只存在一种分子,属于纯净物;E中只存在一种原子,可能是纯净物(如金刚石),也可能是混合物(如金刚石与石墨组成的混合物);故填:AC;BD。
一、解答题1.根据下列粒子结构示意图,回答问题。
(1)A、B、C、D所示四种粒子共表示________种元素(填数字)。
(2)B所示粒子在化学反应中容易________电子(填“得到”或“失去”)。
(3)若E中x=10时,则该粒子属于________(填“原子”或“离子”)。
(4)B和D形成化合物的化学式为________,构成该物质的微粒是________(填微粒符号)。
解析:3;失去;原子; MgCl2, Mg2+、Cl-。
(1)元素的种类是由质子数决定,图中的质子数分别是8,12,17,故由三种元素。
(2)B表示的粒子的最外层电子数是2,易失去2个电子。
(3)若X=10,则该粒子的核内质子数=核外电子数,故是原子。
(4)B是镁元素,D是氯元素,镁与氯形成的化合物的化学式为MgCl2。
MgCl2由Mg2+、Cl-构成。
2.下表为元素周期表中某一周期元素的原子结构示意图请回答下列问题:(1)表中磷原子的核电荷数x= __________;(2)表中具有相对稳定结构的元素是_________;(3)镁元素与氯元素形成的化合物化学式为 __________;(4)从上表可以看出这8种元素的原子结构中___________ 相同。
解析:Ar(或答氩) MgCl2电子层数【解析】(1)原子中,质子数=核外电子数;(2)若粒子的最外层电子数为8,属于相对稳定结构;(3)根据化合物化学式的书写方法进行解答;(4)根据元素周期表规律分析解答。
(1)原子中,质子数=核外电子数,则X=2+8+5=15;(2)氩原子的最外层电子数是8,为稳定结构;(3)根据化合物化学式的书写方法,镁元素容易失去2个电子显+2价,氯元素得到1个电子显-1价,镁元素与氯元素形成的化合物化学式为MgCl2;(4)由表中图示可知,这8种元素的原子结构中电子层数相同,都有四层电子。
3.如图是1~18号元素原子最外层电子数与原子核电荷数的关系图。
请回答下列问题:(1)1~18号元素中属于稀有气体元素的有______(填元素符号)。
(2)He和Be元素的原子最外层均有2个电子它们的化学性质是否相似?______。
(填“相似”或“不相似”)。
(3)某元素的原子序数为16,它在化学反应中一般易电子______(填“得到”或“失去”)。
(4)由图可知得到的信息是______解析:He、Ne、Ar 不相似得到随着原子核电荷数的递增,元素原子最外层电子数呈现周期性变化(1)因有一个电子层时,电子数为2即为稳定结构,则He为稀有气体。
有两个以上电子层时,最外层电子数为8的为稳定结构,由图可知则Ne、Ar为稀有气体。
故填:He、Ne、Ar;(2)因He有一个电子层,则最外层电子数是2为稳定结构,化学性质稳定,但Be元素的原子有两个电子层,最外层电子数是2,则容易失去2个电子而形成稳定结构,化学性质较活泼,则它们的性质不相似;(3)因元素的原子序数为16的是S元素,其最外层电子数为6,则容易得到2个电子而形成最外层8电子的稳定结构;(4)由图可知得到的信息是:随着原子核电荷数的递增,元素原子最外层电子数呈现周期性变化。
4.如表是元素周期表中第1、2、3周期的元素,请回答有关问题(1)下列各组具有相似化学性质的元素是______(填字母序号)。
A O、SB Na、ClC F、ClD C1、Ar(2)写出一条第三周期元素原子的核外电子排布规律______。
(3)第7号元素与第12号元素的原子形成化合物的化学式为______。
Mg N解析:AC 从左往右,原子的最外层电子数依次增多32(1)下列各组具有相似化学性质的元素是AC,这是因为它们的最外层电子数相等;(2)第三周期元素原子的核外电子排布规律:从左往右,原子的最外层电子数依次增多;(3)第7号元素(氮元素)与第12号元素(镁元素)的原子形成化合物是氮化镁,氮化镁中镁元素化合价是+2,氮元素化合价是-3,根据化合物中元素化合价代数和为零可知,氮化镁化学式是Mg2N3。
5.下表为元素周期表中某一周期元素的信息:请回答下列问题:(1)表中磷原子的核电荷数x = _________(2)表中其原子具有相对稳定结构的元素名称是_______________(3)在化学反应中,每个铝原子失去____________个电子形成铝离子;(4)镁元素与氯元素形成的化合物化学式为 _________解析:氩 3 MgCl2(1)根据磷原子的结构示意图可知,磷原子核外有15个电子,磷原子的核电荷数也为15;故答案为15;(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,当最外层电子数为8,则具有相对稳定结构,所以具有相对稳定结构的元素是氩元素;故答案为氩;(3)铝原子最外层电子数为3,容易失去3个电子;故答案为3;(4)根据化合物化学式的书写方法,镁元素容易失去2个电子显+2价,氯元素得到1个电子显-1价,镁元素与氯元素形成的化合物化学式为MgCl2;故答案为MgCl2。
6.回答下列有关的问题。
(1)水和过氧化氢组成元素相问,但化学性质不同的原因是________;(2)钠元素和镁元素不是同种元素的原因是________________________;(3)铁丝在空气中很难燃烧,而在氧气中可以燃烧是因为氧气________不同;(4)钠原子与钠离子化学性质不同的原因是________________________;解析:分子的构成不同质子数不相同浓度最外层电子数不同(1)水和过氧化氢的组成元素相同,但分子的构成不同,不同种的分子性质不同,所以水和过氧化氢的化学性质不同;故填:分子的构成不同;(2)决定元素种类的是质子数,所以钠元素和镁元素不是同种元素,是因为质子数不相同;故填:质子数不相同;(3)空气中的氧气不如纯氧浓度大,从而得出不同的现象,即是反应物的浓度影响了反应速率;故填:浓度;(4)最外层电子数不同决定化学性质,故钠原子与钠离子化学性质不同的原因是最外层电子数不同;故填:最外层电子数不同。
7.在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。
(1)如图是四种粒子结构示意图。
①D中的x=_______,C粒子的符号为_________②A、B、C、D中属于同种元素的粒子是_______(填序号)。
③A和B两种粒子的________相同,所以它们具有相似的化学性质。
(2)汽车尾气催化转换器可减少有害气体排放,其反应过程的微观变化如图所示。
①已知丁是一种单质,则丁是____________(写化学式)。
②根据图示得出的结论中,正确的有__________。
A化学反应是原子的重组过程B该反应是化合反应C参加反应的甲和乙的质量比为14:15D生成丙和丁的分子个数为1:1解析:Cl- BC 最外层电子数 N2 AC(1)①在原子中质子数等于核外电子数,所以D中的x=18-2-8=8,C粒子的质子数是17,电子数是18,是氯离子,符号为:Cl-;②B和C的质子数相同,属于同种元素。
③A和B两种粒子的最外层电子数、相同,所以它们具有相似的化学性质。
(2)由图示和质量守恒定律可知,丁是一种单质,单质为氮气,该反应是一氧化碳和一氧化氮反应生成二氧化碳和氮气,反应的化学方程式为:2CO+2NO 催化剂2CO2+N2①由上述分析可知,丁的化学式是:N2;②A.由微粒的变化可知,化学反应是原子的重组过程,故A正确;B.该反应的生成物是两种,不是化合反应,故B错误;C.由方程式可知,参加反应的甲和乙的质量比为(28×2):(30×2)=14:15,故C正确;D.由方程式可知,生成丙和丁的分子个数为2:1故D错误。
故答案为:(1)①8,Cl-;②BC;③最外层电子数。
(2)①N2,②AC。
8.下面是几种原子的基本结构,分析表中数据,你能得出什么结论?(答出两条即可)名称符号质子数中子数核外电子数氢H101氧O888钠Na111211氯Cl171817解析:原子的质子数等于核外电子数、氢原子没有中子。
【分析】本题考查学生对原子的了解以及表格数据提取能力。
由表格数据可知,氢、氧、钠、氯原子中的质子数等于核外电子数,并且只有氢原子没有中子;故填:原子中质子数等于核外电子数、氢原子没有中子。
【点睛】氢原子不含中子。
9.科学家用先进的科学仪器不仅能够直接观察到一些分子和原子,还能移动原子。
(1)有人说:“要计算每一勺水里的分子的数量,就像用勺子计算大西洋的水一样。
”这句话说明分子具有的特征是(26)。
(2)如图所示,将酚酞溶液分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5mL浓氨水。
用一个大烧杯罩住A、C两个小烧杯。
①请填写下表中的空白;烧杯A烧杯B实验现象(27)(28)解释(29)(此处不必填写)②B烧杯在实验中是不可缺少的,它体现了一种科学实验的方法,这种方法是(30)。
(3)在课堂上,魏老师取气密性良好的两支大小相同的医用注射器,将栓塞向外拉,分别吸入等体积的空气和水,用手指顶住针筒末端的小孔,将栓塞慢慢推入(如图所示),发现盛空气的注射器容易被压缩,其原因是(31)。
解析: (26) 分子很小(27) A中液体颜色逐渐变红(28) B中无明显现象(28)分子在做不断的运动。
氨水中氨气分子运动到A中使酚酞溶液变红(29)对照实验法(30) 空气(31) 气态物质分子间间隔大于液态物质分子间间隔(1)“要计算每一勺水里的分子的数量,就像用勺子计算大西洋的水一样.”这句话说明分子具有的特征是分子很小;故答案为分子很小.(2)浓氨水具有挥发性,挥发出氨气分子氨气分子遇水显碱性能使酚酞试液变红;故答案为A中液体颜色逐渐变红;B中无明显现象;分子在做不断的运动,氨水中氨气分子运动到A中使酚酞溶液变红;对照实验法.(3)气体易压缩,而液体不易压缩,说明气态物质分子间间隔大于液态物质分子间间隔;故答案为气态物质分子间间隔大于液态物质分子间间隔10.一个碳-12原子的质量为n㎏,某元素一个原子的质量为2n㎏,求该原子的相对原子质量。
解析:24【解析】试题分析:根据相对原子质量的计算,原子的相对原子质量是原子的实际质量与标准碳原子质量的1/12,那么根据题意:该原子的相对原子质量= 2n㎏/(n㎏×1/12)=24考点:相对原子质量的计算11.化学是在分子、原子水平上研究物质的组成、结构、性质与变化规律的科学.如图是物质与其构成粒子之间的关系图,回答下列问题:(1)分析上述物质与其构成粒子之间的关系图,空白方框中应填____________;(2)金属铁是由铁_____________(填“原子”、“分子”或“离子”)构成的,氧化镁是由____________构成的(同上);(3)原子得到或失去电子后形成离子,某粒子的结构示意图为当a=________时,该粒子是原子;当a=8时,该粒子是_________(填“阳离子”或“阴离子”),其符号为____________;(4)据专家介绍,节能灯管内含有一定量的汞,废弃的节能灯管破碎后,瞬间可使周围空气中的汞浓度严重超标.一旦进入人体,可能破坏人的中枢神经.试从原子的角度解释汞进入空气的原因是_________________.解析:(1)分子(2)原子;离子;(3)10;阴离子;O2﹣;(4)因为汞是由汞原子构成的,原子是在不停运动着的,节能灯管破碎后,汞原子就会不断运动到空气中.【解析】(1)原子能结合生成分子,故填:分子;(2)金属铁是由铁原子构成的,氧化镁是由镁离、氯离子构成的;(3)当a=10时,核内质子数等于核外电子数,表示的是原子;当a=8时,核内质子数小于核外电子数,表示的是阴离子;其符号为 O2﹣;(4)汞进入空气的原因是因为汞是由汞原子构成的,原子是在不停运动着的,节能灯管破碎后,汞原子就会不断运动到空气中.【点评】本题考查了物质构成的知识,完成此题,可以依据已有的知识进行.12.用分子的观点解释:(1)酒香不怕巷子深(2)气体很容易被压缩,而固体和液体不易被压缩解析:(1)分子在不断运动。