3.3 蛋白质的二级结构
- 格式:ppt
- 大小:10.50 MB
- 文档页数:88


蛋白质二级结构比对1. 蛋白质的二级结构蛋白质是生物体内最重要的有机分子之一,它们在细胞中扮演着各种功能角色。
蛋白质的二级结构是指由氢键相互作用形成的局部空间结构,包括α-螺旋、β-折叠和无规卷曲等形式。
1.1 α-螺旋α-螺旋是一种紧密卷曲的结构,由多个氨基酸残基组成。
在α-螺旋中,每个氨基酸残基都与其前一个和后一个残基之间通过氢键相互作用。
这种稳定的氢键网络使得α-螺旋具有较高的稳定性。
1.2 β-折叠β-折叠是由多个β链段组成的平行或反平行排列而成。
在β链段中,相邻氨基酸残基之间通过氢键相互作用形成平面片状结构,并且这些片状结构可以堆叠在一起形成立体结构。
1.3 无规卷曲除了α-螺旋和β-折叠之外,蛋白质的二级结构还包括无规卷曲。
无规卷曲是指蛋白质中没有明显的局部空间结构,呈现出随机弯曲的状态。
2. 蛋白质二级结构比对方法蛋白质二级结构比对是一种将两个或多个蛋白质的二级结构进行比较和分析的方法。
通过比对不同蛋白质的二级结构,可以揭示它们之间的相似性和差异性,从而进一步理解它们在生物学功能上的差异。
2.1 序列比对蛋白质序列比对是最常用的比对方法之一。
它通过将两个或多个蛋白质序列进行对齐,寻找相同或相似的氨基酸残基,并根据残基之间的差异性评估二级结构的相似性。
2.2 结构比对蛋白质结构比对是通过将两个或多个蛋白质的三维结构进行重叠,并计算其二级结构元素之间的相似性来进行比较。
这种方法可以更直接地揭示不同蛋白质之间的二级结构差异。
2.3 动态比对动态比对是一种基于蛋白质的二级结构动力学特性进行比较的方法。
通过对蛋白质中氢键、主链和侧链之间的相互作用进行分析,可以揭示不同蛋白质之间二级结构的动态变化。
3. 蛋白质二级结构比对的应用蛋白质二级结构比对在生物学研究中具有广泛的应用价值。
3.1 结构预测通过将未知蛋白质的序列与已知蛋白质序列进行比对,可以预测未知蛋白质的二级结构。
这有助于理解蛋白质的功能和相互作用方式,并为药物设计和疾病治疗提供指导。


蛋白质结构与功能入门pdf 标题:蛋白质结构与功能入门PDF引言概述:蛋白质是生命体中不可或缺的分子,它们在细胞内发挥着各种重要的功能。
了解蛋白质的结构与功能对于深入理解生命的基本原理具有重要意义。
本文将通过PDF形式的介绍,全面阐述蛋白质结构与功能的基本知识。
正文内容:1. 蛋白质的结构1.1 氨基酸的组成1.2 氨基酸的结构特点1.3 蛋白质的多级结构1.3.1 一级结构:氨基酸序列1.3.2 二级结构:α螺旋和β折叠1.3.3 三级结构:立体构型1.3.4 四级结构:亚单位组装2. 蛋白质的功能2.1 结构功能2.1.1 细胞骨架蛋白2.1.2 信号传导蛋白2.2 酶功能2.2.1 催化反应的酶2.2.2 调节酶活性的蛋白2.3 运输功能2.3.1 氧气运输蛋白2.3.2 载脂蛋白2.4 免疫功能2.4.1 抗体2.4.2 免疫调节蛋白2.5 激素功能2.5.1 胰岛素2.5.2 生长激素3. 蛋白质结构与功能的关系3.1 结构决定功能3.2 功能调控结构3.3 蛋白质结构与疾病关联总结:蛋白质结构与功能是生命科学中的重要研究领域。
通过本文的介绍,我们了解了蛋白质的基本结构和功能,包括氨基酸的组成和结构特点,蛋白质的多级结构以及蛋白质在细胞中的各种功能。
我们还探讨了蛋白质结构与功能之间的关系,包括结构对功能的决定性作用,功能对结构的调控以及蛋白质结构与疾病的关联。
深入了解蛋白质结构与功能的基本知识,对于进一步研究生命科学和应用蛋白质在医药和生物技术领域具有重要意义。

蛋白酶水解的作用位点引言蛋白质是构成生物体的基本组成部分,它们在生物体内起着各种重要的生理功能。
然而,蛋白质的功能依赖于其三维结构,而生物体需要通过蛋白酶的作用来控制蛋白质的结构和功能。
蛋白酶主要通过水解蛋白质中的特定化学键来改变其结构和功能。
本文将详细介绍蛋白酶水解的作用位点。
1. 什么是蛋白质的作用位点?蛋白酶水解的作用位点指的是蛋白质链上特定的化学键,这些化学键在蛋白酶的作用下被切割或水解,导致蛋白质的结构改变。
2. 水解作用的种类蛋白酶水解的作用位点可以分为多种类型,下面将介绍其中几种常见的作用位点。
2.1 按照酶的位置分为内切位点和外切位点内切位点是指蛋白质链上由酶水解的化学键位于蛋白质的内部,而外切位点则是位于蛋白质的两端。
根据位置的不同,内切位点的水解作用能够改变蛋白质的整体结构,而外切位点的水解则可能导致蛋白质的降解或者调控。
2.2 按照酶的特异性分为专一性位点和非专一性位点蛋白酶水解的作用位点可以根据酶的特异性分为专一性位点和非专一性位点。
专一性位点是指蛋白酶只能识别蛋白质链上的特定序列,并在此处进行水解。
非专一性位点则是指蛋白酶可以在蛋白质的任意位置进行水解。
3. 蛋白质的作用位点识别蛋白质的作用位点识别是蛋白酶水解的关键步骤。
蛋白酶通过与蛋白质的特定部分相互作用,以识别作用位点。
以下是几种常见的蛋白质作用位点识别的方式:3.1 底物的序列特异性识别专一性蛋白酶通过与底物的序列相互作用来识别作用位点。
这种序列特异性识别通常需要底物的特定氨基酸残基在作用位点上暴露出来,并且与蛋白酶的结构域相互作用。
3.2 扩散限制非专一性蛋白酶对作用位点的识别相对较为宽松。
它们可以通过扩散限制的方式,即与蛋白质链上的某个或多个特定氨基酸残基相互作用,将底物定位到正确的位置。
3.3 二级结构蛋白酶还可以通过识别底物的二级结构来确定作用位点。
许多蛋白质的特定二级结构在水解之前会发生改变,这种结构改变可以作为蛋白酶识别作用位点的信号。
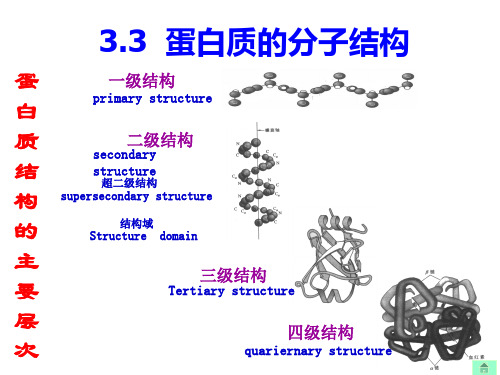
基础生物化学Basic Biochemistry3 蛋白质(Protein)化学3.1 氨基酸3.2 肽3.3 蛋白质的分子结构3.4 蛋白质结构与功能的关系3.5 蛋白质的重要性质、分类蛋白质的超二级结构(super-secondary structure)和结构域(Domain)☐超二级结构和结构域都是介于蛋白质构象中二级结构与三级结构之间的一个层次。
⑴超二级结构(super-secondary structure)超二级结构是多肽链内顺序上相互邻近的若干二级结构单元在空间折叠中靠近,相互作用形成规则的在空间上能辨认的结构组合体(combination)锌指(Zine finger,ZF) 亮氨酸拉链(Leucine Zipper)EF手(EF-hand)⑵结构域(domain)多肽链在超二级结构基础上进一步绕曲折叠而成的相对独立的三维实体称结构域。
小分子蛋白质的结构域和三级结构往往是同一个意思。
由4个βαβ组成的α/β桶结构域免疫球蛋白(IgG)由12个结构域组成,其中两个轻链上各有2个,两个重链上各有4个;补体结合部位与抗原结合部位处于不同的结构域。
蛋白质的三级结构蛋白质的三级结构是多肽链在各种二级结构的基础上,通过侧链基团的相互作用,借助次级键维系,进一步盘绕折叠形成具有一定规律的三维空间结构。
稳定蛋白质三级结构的主要是次级键,包括:氢键、疏水键、盐键以及范德华力等。
这些次级键可存在于一级结构序列相隔很远的氨基酸残基的R基团间,因此蛋白质的三级结构主要指氨基酸残基侧链间的结合。
氢键范德华力疏水作用盐键次级键都是非共价键,易受环境中pH、温度、离子强度等的影响,有变动的可能性。
二硫键不属于次级键,但在某些肽链中能使远隔的二个肽段联系在一起,对于蛋白质三级结构的稳定上起着重要作用。
蛋白质的三级结构是指蛋白质分子主链折叠盘曲形成构象的基础上,分子中的各个侧链所形成一定的构象。
侧链构象主要是形成结构域。
蛋白质分子中肽链并非直链状,而是按一定的规律卷曲(如α-螺旋结构)或折叠(如β-折叠结构)形成特定的空间结构,这是蛋白质的二级结构。
蛋白质的二级结构主要依靠肽链中氨基酸残基亚氨基(—NH—)上的氢原子和羰基上的氧原子之间形成的氢键而实现的。
主要有:
1、纤维蛋白(fibrousprotein):一类主要的不溶于水的蛋白质,通常都含有呈现相同二级结构的多肽链许多纤维蛋白结合紧密,并为单个细胞或整个生物体提供机械强度,起着保护或结构上的作用。
2、角蛋白(keratin):由处于α-螺旋或β-折叠构象的平行的多肽链组成不溶于水的起着保护或结构作用蛋白质。
3、胶原(蛋白)(collagen):是动物结缔组织最丰富的一种蛋白质,它是由原胶原蛋白分子组成。
原胶原蛋白是一种具有右手超螺旋结构的蛋白。
每个原胶原分子都是由3条特殊的左手螺旋(螺距0.95nm,每一圈含有3.3个残基)的多肽链右手旋转形成的。
《生物化学》常用名词解释(二)1.构型(configuration):一个有机分子中各个原子特有的固定的空间排列。
这种排列不经过共价键的断裂和重新形成是不会改变的。
构型的改变往往使分子的光学活性发生变化。
2.构象(conformation):指一个分子中,不改变共价键结构,仅单键周围的原子旋转所产生的原子的空间排布。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
3.肽单位(peptideunit):又称之肽基(peptidegroup),是肽链主链上的重复结构。
是由参与肽键形成的氮原子和碳原子和它们的4个取代成分:羰基氧原子、酰胺氢原子和两个相邻的α-碳原子组成的一个平面单位。
4.蛋白质二级结构(proteinsecondarystructure):在蛋白质分子中的局部区域内氨基酸残基的有规则的排列,常见的二级结构有α-螺旋和β-折叠。
二级结构是通过骨架上的羰基和酰胺基团之间形成的氢键维持的。
5.蛋白质三级结构(proteintertiarystructure):蛋白质分子处于它的天然折叠状态的三维构象。
三级结构是在二级结构的基础上进一步盘绕、折叠形成的。
三级结构主要是靠氨基酸侧链之间的疏水相互作用、氢键范德华力和盐键(静电作用力)维持的。
6.蛋白质四级结构(quaternarystructure):多亚基蛋白质的三维结构。
实际上是具有三级结构的多肽链(亚基)以适当方式聚合所呈现出的三维结构。
7.α-螺旋(α-helix):蛋白质中常见的一种二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。
每个氨基酸残基(第n个)的羰基氧与多肽链C端方向的第4个残基(第n+4个)的酰胺氮形成氢键。
在典型的右手α-螺旋结构中,螺距为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。
8.β-折叠(β-sheet):是蛋白质中的常见的二级结构,是由伸展的多肽链组成的。