自然界中氮的循环以及氮循环中的重要物质
- 格式:ppt
- 大小:9.79 MB
- 文档页数:24





3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
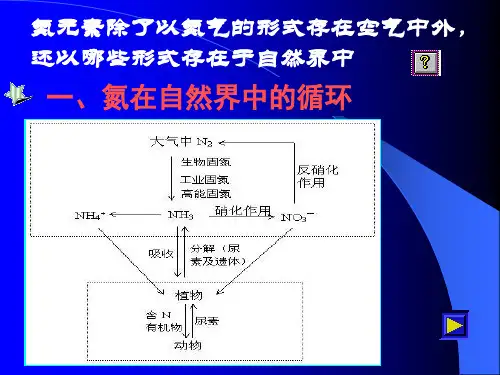
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。

氮的循环一、氮在自然界中循环1、氮的固定使空气中游离态的氮转化为含氮化合物的过程叫氮的固定,简称固氮。
正是通过氮的固定,开始了氮在自然界中的循环,氮的固定有自然固氮和人工固氮两种方式。
2、自然固氮(1)生物固氮:大豆、蚕豆等豆科植物的根部含有根瘤菌,能把空气中的N2转变为硝酸盐,被植物吸收。
故豆类植物不需要施用氮肥,这种固氮方式占整个自然固氮的90%。
(2)高能固氮:通过闪电等高能量途径把N2固定的方式为高能固氮。
涉及到的反应主要有:N2+O22NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO可知,N2最终变成HNO3,即正常的雨水略呈酸性。
HNO3与土壤中的矿物作用,得到硝酸盐,被植物吸收,这就是“雷雨发庄稼”的科学道理。
3、人工固氮人们在工业生产中把N2转化为氮的化合物的方法为人工固氮,又叫工业固氮。
常见的方法有:(1)N2与H2合成NH3:,该反应为工业制HNO3的基础反应。
(2)仿生固氮:用某些金属有机化合物做催化剂,实现常温、常压固氮,这些金属有机物类似于根瘤菌,故又叫仿生固氮,这是目前科学界较为关注的研究性课题。
4、氮在自然界中的循环人们在生产活动中也涉及到了氮的循环,其中主要是利用N2与H2合成工业中重要的生产原料——NH3,即人工固氮。
涉及到两种很重要的物质:NH3、HNO3。
二、氮循环中的重要物质及其变化1、氮气,常况下是一种无色无味的气体,难溶于水,通常无毒。
氮气占空气体积总量的78.12%,是空气的主要成份。
氮气的化学性质很不活泼,只在特殊条件下,才能以下反应。
①与氧气反应:通常状况下氮气和氧气不反应,但在放电条件下,却可以直接化合生成NO。
反应的化学方程式为:★N2+O2闪电2NO②与氢气反应:在高温、高压、催化剂作用下,氮气和氢气可以反应制得氨气。
反应的化学方程式为:★N2 + 3H22NH3 此反应是工业合成氨的反应③与金属镁反应:金属镁可以在氮气中燃烧,生成氮化镁。




氮的循环生态系统中的氮元素氮是地球上最常见的元素之一,它在生态系统中扮演着重要的角色。
氮的循环是一种复杂的过程,涉及到氮的转化和利用。
了解氮的循环对于我们理解生态系统的健康和平衡具有重要意义。
氮元素的不同形式氮在自然界中存在着不同的形式,包括氮气(N2)、氨(NH3)、亚硝酸盐(NO2-)和硝酸盐(NO3-)等。
氮气是大气中最主要的形式,占据了大气氮的绝大部分,但它对大多数生物来说是不可利用的。
氨是一种在土壤和水中广泛存在的形式,它可以被植物和微生物利用。
亚硝酸盐和硝酸盐是土壤中的重要形式,它们是植物的主要氮源。
氮的转化过程氮的转化过程涉及到氮的不同形式之间的相互转化。
这些转化包括氮的固氮、氨化、硝化、反硝化和氮化等过程。
固氮是指将大气中的氮气转化为氨或亚硝酸盐的过程,这个过程主要由一些细菌和蓝藻完成。
氨化是将氮气或亚硝酸盐转化为氨的过程,这个过程由一些细菌和真菌负责。
硝化是将氨或亚硝酸盐转化为硝酸盐的过程,这个过程由一些细菌完成。
反硝化是将硝酸盐还原为氮气的过程,这个过程由一些细菌完成。
氮化是指将氮气转化为氮化合物的过程,这个过程主要发生在工业生产中。
氮的利用过程氮的利用是指氮被生物体吸收和利用的过程。
植物通过根系吸收土壤中的氮元素,然后利用它们合成蛋白质和其他有机物。
动物通过摄食植物或其他动物来获取氮元素,并将其合成为自己的蛋白质和DNA 等。
微生物在土壤和水中利用氮元素进行生物合成和能量产生。
氮的利用过程是氮循环中至关重要的一部分,它可以维持生态系统的稳定和平衡。
氮的流失和污染氮的循环过程中,可能会发生氮的流失和污染。
流失是指氮元素从一个环境转移到另一个环境的过程,这可能会导致氮在某些环境中过量积累或在其他环境中不足。
氮的流失通常发生在土壤和水体中,可以通过冲刷和渗漏等途径发生。
氮的污染是指环境中氮浓度过高,超出了生态系统的承受能力。
氮污染常常来自农业排放和工业废水等,会对水体和土壤造成污染,并对附近的生物体产生负面影响。
氮气与氮的固定氨与铵态氮肥氮的循环 硝酸及其应用人类活动对氮循第 3 章 自然界中的元素第 2 节氮的循环一、教材分析〔一〕学问脉络氮及其化合物是元素化合物学问的重要组成局部。
本节教材通过闪电这一自然现象,激发 学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO 、NO 、氨、铵盐、硝酸等,然后通过观看思考、试验探究生疏这些重要物质的性质、用 2途。
在学习过程中了解人类活动对自然界氮循环和环境的影响。
〔二〕学问框架〔 氮 气 的性质,氮的固定〕〔氨的性质,〔硝酸的性质〕〔酸雨、光化学烟雾、富养分化〕〔三〕教材的主要特点:从培育学生终身进展所必备的学问和力气动身,重点介绍重要代表物的性质与用途,同时留意培育学生的观看力气和综合分析问题的力气。
二.教学目标〔一〕学问与技能目标1、了解自然界中的氮循环及人类活动对氮循环的影响;2、通过了解生物固氮和人工固氮形式,生疏N 2 、NO 、NO 2 的性质;3、通过观看思考活动,生疏NH 3、铵盐的性质及铵态氮肥的使用问题;4、通过观看思考活动,生疏 HNO 的性质。
3〔二〕过程与方法目标1、培育学生通过观看试验现象,总结分析物质性质的力气;2、初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的思想。
〔三〕情感态度与价值观目标1、通过介绍合成氨进展的艰辛历程,体会从试验室争论到工业生产的过程,渗透化学与技术关系的教育;2、通过介绍酸雨,光化学烟雾和富养分化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。
三、重点、难点〔一〕学问上重点、难点重点:氮气、氨、铵盐和硝酸的性质。
难点:硝酸的氧化性。
〔二〕方法上重点、难点培育学生通过观看试验现象总结分析物质性质的力气,并使学生初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的重要性。
四、教学预备〔一〕学生预备1、预习其次节-氮的循环2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。