最新第三章伏安法和电位溶出分析法
- 格式:ppt
- 大小:1.56 MB
- 文档页数:96


第三章伏安分析法一、填空题1.同样浓度的铅离子(0.01 mol·L-1)在0.lmol·L-1KCl介质中所产生的极限扩散电流比在水中所产生的极限扩散电流约低一倍左右,这是由于__________________。
2.不可逆极谱波在达到极限扩散电流区域时,电流是受________________控制。
3.根据极谱波的对数分析图,对可逆极谱波,对数分析曲线的斜率为________________ ________________________________________________。
4.当金属离子形成较稳定的络离子之后,其可逆极谱波的半波电位往______方向移动。
5.根据简单金属离子以及络合物的可逆极谱波,已知电子转移数,可以测定络合物的_____ 和______________。
6.氯离子能在滴汞电极上进行下述电极反应:2Hg+2Cl- =Hg2Cl2+2e- (25℃)达到极谱波的半波电位时,半波电位E1/2与Cl-浓度的关系式为__________________- ________________________。
7.对于平行催化波:选择Z时,要求(1)______________________________________,(2)____________________________________,(3)____________________________________。
8.由于氢催化波是由氢放电而产生,因此可用______________________________________ 方法判断氢催化波。
9.氢催化波的峰电位与溶液酸度及催化活性物质浓度的关系,一般说来峰电位随pH值的增高而_______移,随催化活性物质浓度的______________ 而正移。
10.单扫描极谱测定某物质,其峰电流与扫描速度的二分之一次方成____比,此极谱波为_______波。

一、实验目的1.熟悉溶出伏安法的基本原理。
2.掌握汞膜电极的使用方法。
3.了解一些新技术在溶出伏安法中的应用。
二、方法原理溶出伏安法的测定包含两个基本过程。
即首先将工作电极控制在某一条件下,使被测物质在电极上富集,然后施加线性变化电压于工作电极上,使被富集的物质溶出,同时记录电流(或者电流的某个关系函数)与电极电位的关系曲线,根据溶出峰电流(或者电流函数)的大小来确定被测物质的含量。
溶出伏安法主要分为阳极溶出伏安法,阴极溶出伏安法和吸附溶出伏安法。
本实验采用溶出伏安法测定水中的Pb(Ⅱ)、Cd(Ⅱ),其两个过程可表示为:M2+(Pb2+、Cd2+)+2e-+Hg M(Hg)本法使用玻碳电极为工作电极,采用同位镀汞膜测定技术。
这种方法是将分析溶液中加入一定量的汞盐(通常是10-5~10-4mol·L-1Hg(NO3)2),在被测物质所加电压下富集时,汞与被测定物质同时在玻碳电极的表面上析出形成汞膜(汞齐)。
然后在反向电位扫描时,被测物质从汞中“溶出”,而产生“溶出”电流峰。
在酸性介质中,当电极电位控制位-1.0V(sv.SCE)时,Pb2+、Cd2+与Hg2+离子同时富集在玻碳工作电极上形成汞齐膜。
然后当阳极化扫描至-0.1V时,可得到两个清晰的溶出电流峰。
铅的波峰电位约为-0.4V左右,而镉的为-0.6V左右(sv.SCE)。
如图11—11所示。
本法可分别测定低至10-11 mol·L-1的铅、镉离子。
三、仪器和试剂a) 伏安仪(最好选择具有导数电流方式,或半微分电流方式的新型伏安仪)。
b) x—y函数记录仪。
c) 玻碳工作电极、甘汞参比电极及铂辅助电极组成测量电极系统。
d) 磁力搅拌器;秒表。
e) 1.0×10-2 mol·L-1铅离子标准储备溶液。
f) 1.0×10-2 mol·L-1镉离子标准储备溶液。
g) 5×10-3mol·L-1硝酸汞溶液。



电化学分析法:将电极插入被测物质的溶液中,组成化学电池,通过测量该电池的电学参数或参数的变化,进行物质的定性和定量分析。
概述和电化学基础一、电化学分析法的分类电位分析法——电池电动势——H及金属和非金属测定伏安分析法——电流电压曲线——金属离子和有机物测定电导分析法——电导——电解质总量分析库伦分析法——电量——金属和非金属测定二、电化学分析法的特点1. 灵敏度高2. 选择性好3. 样品用量少4. 分析速度快5. 仪器设备简单三、电化学基础(一)化学电池实现化学能与电能相互转化的装置1.化学电池的类型:原电池,电解池(1)原电池:能自发将化学能转变成电能的装置正得还,负失氧(2)电解池:只有加上外加电源后,两电极上才能发生氧化还原反应,将电能转变成化学能。
(3)原电池和电解池组成的共同点① 有两个半电池,且只有接通外电路时,半电池反应才能进行。
② 当电极分别插入两种不同的电解质溶液时,有液体接界装置。
③ 有两个电极:正极和负极,阳极和阴极。
阳极(anode): 发生氧化反应的电极。
阴极(cathode): 发生还原反应的电极。
2.原电池的表示方法(1)负极及有关溶液体系写在左侧,正极及有关溶液体系写在右侧;(2)用化学式表示电池中各种物质的组成并注明各物质的状态,溶液要注明活度或浓度,气体要注明压力;(3)用单竖线“|”表示能产生电位差的两相界面,双竖线“||”表示两电极体系用盐桥连接。
(二)电池电动势和电极电位1.电池电动势(1)定义:当通过原电池的电流为无限小时,电池两极的端电压就是此电池的电动势。
(2)电池电动势:电池中各个相界面上的相间电位的代数和。
(—) Zn (s) | Zn2+ (x mol/L) || Cu2+ (y mol/L) | Cu (s) (+)(1) 两金属电极之间的接触电位,以φ接触表示,此电位很小,可忽略不计;(2) 锌与硫酸锌溶液界面处的相间电位称为负极电位,用φ-表示;(3) 铜与硫酸铜溶液界面处的相间电位称为正极电位,用φ+表示;(4) 硫酸锌与硫酸铜溶液接界处的电位称为液体接界电位,用φj表示,实验中用盐桥降低此电位。



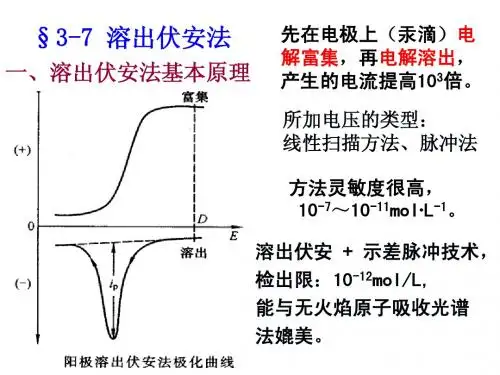
电化学分析—溶出伏安法一、办法原理溶出伏安法是将恒电位电解富集与伏安法测定相结合的一种电化学分析法。
溶出伏安法测定分为两个步骤:第一步为“电析”,即在一个恒电位下,将被测离子电解沉积,富集在工作电极上(实际只是溶液中被测离子的一部分被沉积),与电极上汞(普通工作电极有悬汞电极、银基汞膜电极或玻碳汞膜电极等)生成汞齐,反应式为: Mn++ne-+Hg=M(Hg) 其次步为“溶出”,即在富集结束后,普通静置30s或60s 后(静置的目的是使被测金属在汞膜中的浓度均一化,也使溶液中的对流作用基本静止),在工作电极上施加一个反向电压,使沉积在工作电极上的痕量物质重新溶出成为离子,测量溶出过程电流随电压变幻的曲线,称伏安曲线(或溶出极谱图)。
溶出伏安曲线中各个峰值电位是定性分析的依据;各个峰值电流(峰高)是定量分析的依据(见图2-22)。
当分析阳离子时,用法的是阳极溶出伏安法,可测30余种金属元素,敏捷度很高,能测定10-7~10-9 mol/L的金属离子,在相宜条件下敏捷度甚至可达10-11~10-12 mol/L。
此法所用仪器比较容易,操作便利,是一种很好的痕量分析手段。
当分析阴离子时,用法的是阴极溶出伏安法,可测定能与金属离子生成难融化合物的阴离子、有机阴离子和具有特别官能团化合物。
图2-22 Cu、Pb、Cd的溶出伏安曲线二、试验装置试验装置2-23所示。
将含金属离子的试样加入电解池后,可先通入N2以除去溶解O2对测定的干扰。
电解富集时,开启搅拌器,此时双向开关的电源正极衔接饱和甘汞电极(阳极),负极衔接悬汞电极(阴极)。
电解完成后,停止搅拌并静置30s,迅速转换双向开关,使电源正极衔接悬汞电极(阳极),负极衔接饱和甘汞电极(阴极),使富集在悬汞电极上的金属举行阳极溶出,观看I、V变幻,直至溶出电流减至最小即完成测定。
实测的溶出伏安曲线2-22所示。
它是在1.5mol/L HCl底液中,Cu2+为5×10-17 mol/L、Pb2+为1×10-6 mol/L、Cd2+为5×10-17 mol/L,悬汞电极在-0.8V电解3min后,由阳极氧化电流获得的阳极溶出伏安曲线。