溶出伏安法与电位溶出法
- 格式:ppt
- 大小:233.00 KB
- 文档页数:46







第一章绪论第二章样品的采集与处理一、选择题1、卫生化学的研究对象不包括:(D)A. 环境卫生学B. 营养与食品卫生学C. 劳动卫生学D. 分析化学2、下列分离方法哪一项不属于膜分离法范畴(B)A. 超滤B.顶空分析法C.透析法D.液膜法3、下列关于萃取操作描述不正确的是(C)A. 选择的溶剂对被测组分的分配比大B.被测组分在该溶剂中稳定C.萃取溶剂的分子量相差要大D.萃取时应少量多次二、填空题1、样品的保存方法有(密封保存法)、(冷藏保存法)、(化学保存法)2、样品溶液的制备方法有(溶解法)、(分解法)。
3、固相萃取法的步骤先后分别是:(活化)、(装样)、(清洗)、(洗脱)。
4、样品采集原则是(代表性)、(典型性)、(适时性)。
三、名词解释1、卫生化学:卫生化学是应用分析化学特别是仪器分析的基本理论和实验技术,研究预防医学领域与健康相关化学物质的质、量及变化规律的学科。
2、固相萃取法:利用样品中被分离组分和其它组分与萃取柱中固定相的作用力(吸附、分配、离子交换)不同进行分离的方法。
3、超临界流体萃取法:利用一种物质在超临界区约域形成的流体进行提取的方法,称“超临界流体萃取法”。
4、固相微萃取法:利用固相微量萃取器将被萃取的样品直接解吸入气相色谱仪或高效液相色谱仪中进行直接分析的方法。
5、膜分离法:依据选择性渗透原理,以外界能量或化学位差为动力,使组分从膜的一侧渗透至另一侧的方法。
五、计算题1. 1.15mg 0.165mg2. 43.3 99.96%第三章卫生分析数据的处理与分析工作的质量保证一.选择题1.卫生分析过程中不会产生误差的是( D )A.样品B.人员C.设备D.标准物质2.按有效数字规则,13.65+0.0092+1.627的结果是( D )A.15.2862 B.15.286 C.15.28 D.15.293. 系统误差由()因素决定( C )A.随机因素B.不确定因素C.稳定因素D.未知因素4.分析中反应系统误差和随机误差的综合指标是(A)A.准确度B.精密度C.灵敏度D.置信度5.用下列哪种方法可对可疑数据进行取舍(A )A.Grubbs检验法B.F检验法C.标准偏差D.相对误差6.在没有纯标准品时采用下列哪种方法进行定量分析( B )A.内标法B.归一化法C.直接比较法D.标准曲线法7.下列哪个属于过失误差(A )A.粗心大意 B.实验室温度变化 C.仪器故障 D.操作误差8.米尺的准确度可达到()米(B )A. 1/10 B. 1/100 C. 1/1000 D. 1/100009.标准曲线中的斜率,也称为( D )A.精密度 B.准确度 C.精确度 D.灵敏度10.直线回归方程中的相关系数r值,︱r︱值接近(),表示工作曲线的线性关系越好( C )A.>1 B.<1 C.=1 D.=0二.名词解释1.有效数字P282.误差P233.可疑数据P294.标准曲线P37三.问答题1.有效数字的修约规则是什么?P292.误差有哪些?随机误差、系统误差、过失误差3.如何在平均值质量控制图中评价分析工作的质量?P404. 精密度的表示方法有哪几种?(1)绝对偏差(2)平均偏差(3)相对平均偏差(4)标准偏差相对标准偏差是表示精密度的最好方法,可用于比较和评价不同浓度水平待测物质测量的精密度。

环境样品中痕量镉的化学分析方法分析作者:郭冬雪来源:《科技创新导报》2019年第18期摘; ;要:本文主要研究环境样品中痕量镉的检测方法,当前检测痕量镉的检测方法主要有以下几种:分光光度法、电化学分析法、原子吸收光谱法、原子荧光光谱法等,每一种方法具有各自的特点,主要用于环境大气、水资源的中镉的检测。
本文将对以上四种痕量镉检测方法进行详细的阐述,希望能够给读者带来一些启发,提升痕量镉的检测准确性。
关键词:环境样品; 痕量镉; 化学分析; 方法分析中图分类号:TF819.2; ; ; ; ; ; ; ; ; ; ; ; ; ; ; ;文献标识码:A; ; ; ; ; ; ; ; ; ; ; ; 文章编号:1674-098X(2019)06(c)-0111-021; 分光光度法根据镉的化学特性,镉可以和多种显色剂结合生成有色络合物,而如果采用分光光度法来检测镉,其灵敏性与选取的显色剂和显色体系密切相关。
以下选取几种比较典型的常用的用来检测镉的显色剂进行详细的阐述。
1.1 双硫腙使用双硫腙试剂来检测镉是当前应用最广泛的显色剂之一。
这种检测方法对仪器的要求简单,但是操作繁琐,需要使用三氯甲烷(CHCl3)进行萃取,同时为了掩蔽干扰离子还有使用具有剧毒性质的氰化钾(KCN)来避开干扰。
因此,操作繁琐,而且选择性较差,灵敏度欠佳。
但是在含有温吐-20,且pH6.0的乙酸—乙酸钠的环境下进行检测,使用双硫腙来检测镉时,其显色反应的灵敏度较好,所形成的络合物光的最大吸收值在500mm位置,摩尔光吸收系数在9.2×104L·mol-1·cm-1。
使用双硫腙可以用来检测水中微量的镉。
1.2 卤代吡啶偶氮试剂用该显色试剂来检测镉,其灵敏度较好,与镉结合形成的络合物稳定性较好,但是水溶性较差,在实验时需要加入大量的水溶性有机溶剂或者采用萃取光度法来进行检测。
在实验时可以使用5- Br-PADAP与镉按照2:1比例进行混合,形成红色络合物。
溶出伏安分析法用于食品中微量元素的测定龙蜀南 郭璇华 李万霞(华南理工大学化学科学学院 广州 510640)摘 要 本文介绍国内外近年来用溶出伏安法对食品样品中微量元素的分析研究进展,对阳极溶出伏安法,吸附伏安法和电位溶出法的应用展开评述,并对溶出伏安法在金属元素形态分析的应用进行讨论。
关键词 溶出伏安法 食品 微量元素 形态分析前言目前对食品中重金属的测定方法很多,较常见的有原子发射光谱法1,电感耦合等离子体发射光谱法2等,近年来溶出伏安法作为一种电化学分析方法在分析领域中显示出其巨大的潜力和优越性,该方法具有高灵敏度,可以在复杂的体系中测定,仪器结构简单,成本低,便于推广,应用范围广等优点3,在食品分析中的应用越来越多。
本文就溶出伏安分析法在食品中微量元素分析的应用作一介绍。
1 溶出伏安法在食品分析中的应用111 阳极溶出伏安法在食品分析中的应用溶出伏安法是以表面不能更新的液体或固体电极(如悬汞电极或汞膜电极)作工作电极,使被测组分预先富集在工作电极上,再逐步改变电极的电位(向反方向外加电压),使富集在工作电极上的物质重新溶出,根据溶出时的伏安曲线的峰高(或峰面积)进行定量分析。
Recai¨Inam等4将悬汞电极为工作电极,铂丝作为对极,饱和甘汞电极作参比电极,采用微分脉冲阳极溶出伏安法测定牛奶样品中铅的含量,不需要分离,浓缩样品,在2015V为沉积电位时测定牛奶样品中铅,线性范围为185~817μg・L21。
王月荣,倪永年等5在1%乙二胺011mol・L21酒石酸钠pH11182的Britton2Robinson缓冲溶液体系中,用悬汞电极为工作电极,Ag/AgCl电极为参比电极,同时测定食品中锌、铁和锰的含量,溶出峰电位分别为211184mV, 211392mV和-11456mV,最低检出浓度分布为010007μg・mL21,010014μg・mL21和010193μg・mL21。
阳极溶出伏安法的原理阳极溶出伏安法是一种电化学分析方法,可以用于测定金属材料中的微量元素含量、腐蚀速率和电极反应动力学等。
本文将介绍阳极溶出伏安法的原理、实验步骤以及应用领域。
1. 原理阳极溶出伏安法是一种电化学分析方法,它的原理基于电化学反应。
在阳极溶出伏安法中,我们将待测样品作为阳极,通过不断升高电位,使阳极发生氧化反应,从而使待测元素溶解到电解液中,然后通过电化学方法测定待测元素的浓度。
具体来说,阳极溶出伏安法的原理如下:(1)阳极氧化反应在阳极溶出伏安法中,我们将待测样品作为阳极,让它发生氧化反应。
这个过程可以用一个简单的反应式来表示:M → Mn+ + ne-其中,M表示待测元素,n表示电子数,Mn+表示待测元素的阳离子。
(2)阳极溶出反应在阳极氧化反应中,待测元素的阳离子溶解到电解液中。
这个过程可以用一个简单的反应式来表示:Mn+ → M + ne-其中,M表示待测元素。
(3)电化学分析在阳极溶出反应中,我们可以通过电化学方法测定待测元素的浓度。
具体来说,我们可以通过测量阳极溶出电流的大小来计算待测元素的浓度。
电流与浓度之间的关系可以用法拉第定律来描述:i = nFAc其中,i表示电流,n表示反应物的电子数,F表示法拉第常数,A表示电极的表面积,c表示溶液中反应物的浓度。
2. 实验步骤阳极溶出伏安法的实验步骤如下:(1)制备样品首先,我们需要制备待测样品。
具体来说,我们需要将样品加入到一定量的电解液中,然后将其搅拌均匀,使样品完全溶解。
(2)测定电位然后,我们需要测定阳极的电位。
具体来说,我们需要将阳极放入电解液中,然后通过电位计测量阳极的电位。
(3)升高电位接着,我们需要升高阳极的电位,使其发生氧化反应。
具体来说,我们需要通过恒定电位法或循环伏安法等方法将阳极的电位升高到一定的范围内,使阳极发生氧化反应。
(4)测定电流在升高电位的过程中,我们需要测定阳极的电流,以确定待测元素的浓度。
电化学分析—溶出伏安法一、办法原理溶出伏安法是将恒电位电解富集与伏安法测定相结合的一种电化学分析法。
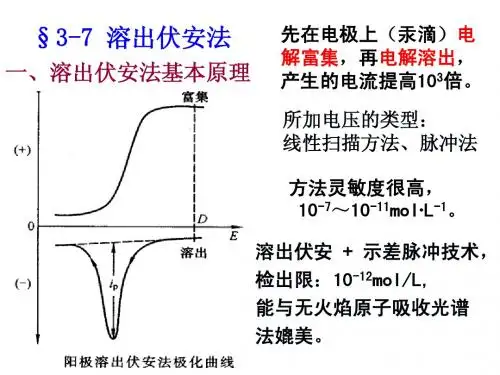
溶出伏安法测定分为两个步骤:第一步为“电析”,即在一个恒电位下,将被测离子电解沉积,富集在工作电极上(实际只是溶液中被测离子的一部分被沉积),与电极上汞(普通工作电极有悬汞电极、银基汞膜电极或玻碳汞膜电极等)生成汞齐,反应式为: Mn++ne-+Hg=M(Hg) 其次步为“溶出”,即在富集结束后,普通静置30s或60s 后(静置的目的是使被测金属在汞膜中的浓度均一化,也使溶液中的对流作用基本静止),在工作电极上施加一个反向电压,使沉积在工作电极上的痕量物质重新溶出成为离子,测量溶出过程电流随电压变幻的曲线,称伏安曲线(或溶出极谱图)。
溶出伏安曲线中各个峰值电位是定性分析的依据;各个峰值电流(峰高)是定量分析的依据(见图2-22)。
当分析阳离子时,用法的是阳极溶出伏安法,可测30余种金属元素,敏捷度很高,能测定10-7~10-9 mol/L的金属离子,在相宜条件下敏捷度甚至可达10-11~10-12 mol/L。
此法所用仪器比较容易,操作便利,是一种很好的痕量分析手段。
当分析阴离子时,用法的是阴极溶出伏安法,可测定能与金属离子生成难融化合物的阴离子、有机阴离子和具有特别官能团化合物。
图2-22 Cu、Pb、Cd的溶出伏安曲线二、试验装置试验装置2-23所示。
将含金属离子的试样加入电解池后,可先通入N2以除去溶解O2对测定的干扰。
电解富集时,开启搅拌器,此时双向开关的电源正极衔接饱和甘汞电极(阳极),负极衔接悬汞电极(阴极)。
电解完成后,停止搅拌并静置30s,迅速转换双向开关,使电源正极衔接悬汞电极(阳极),负极衔接饱和甘汞电极(阴极),使富集在悬汞电极上的金属举行阳极溶出,观看I、V变幻,直至溶出电流减至最小即完成测定。
实测的溶出伏安曲线2-22所示。
它是在1.5mol/L HCl底液中,Cu2+为5×10-17 mol/L、Pb2+为1×10-6 mol/L、Cd2+为5×10-17 mol/L,悬汞电极在-0.8V电解3min后,由阳极氧化电流获得的阳极溶出伏安曲线。