碘化丙啶 PI溶液的使用方及注意事项
- 格式:pdf
- 大小:63.79 KB
- 文档页数:2

100×PI染色液使用说明书货号:SL7091规格:1ml保存条件:-20度保存,有效期1年。
产品内容:产品内容SL7091100×PI染色液(1mg/mL)SL7090-1ml说明书1份产品简介:碘化丙啶(Propidium Iodide,PI)是一种常用的细胞核荧光染料,作为一种溴化乙锭(EB)的类似物,能够嵌入碱基之间实现与DNA结合。
这种结合没有或者几乎无序列倾向性,大约每4-5个DNA碱基对结合一个染料。
PI也能与RNA结合,需要用核酸酶处理来区分DNA和RNA染色。
水溶液中PI的最大激发/发射波长是493/636nm。
一旦与核酸结合,荧光信号明显增强20-30倍,最大激发波长向红色波段迁移~30-40nm,最大发射波长向蓝色波段迁移~15nm,从而使其最大激发/发射波长变为535/617nm。
PI的摩尔吸光系数相对比较低,但是其具有足够大的斯托克司频移来同时检测核酸DNA和荧光标记抗体,只需要使恰当的滤片。
PI适用于荧光显微镜,共聚焦显微镜,流式细胞仪以及荧光计分析。
PI不能穿透细胞膜而被排斥在活细胞外,但是可以穿过破损的细胞膜而对核染色。
利用这一特性,通常与Calcein-AM、Hoechst33258或Hoechst33342等活细胞荧光探针一起使用,同时对活细胞和死细胞染色和鉴定,用于细胞凋亡相关的研究。
也可以用作多重荧光染色的复染剂,兼容于各种细胞标记技术,包括直接或者间接的荧光抗体检测,mRNA原位杂交,细胞结构特异性的荧光探针检测法以及组织染色。
PI 的单独染色也可以进行细胞周期的检测。
使用说明:可以用PBS稀释到1×使用,或与细胞悬液按照1:100的比例使用。
PI染色操作步骤1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm,5min,弃上清液。
2、加入PBS1ml离心洗涤1次,弃上清。
3、加入2ml预冷的70%酒精,4℃固定30min,或是-20℃固定过夜。

PI染色法检测细胞周期一.实验原理及试剂配置1.实验原理P I , 即碘化丙锭,可以与细胞内DNA 和RNA 结合,采用RNA酶将RNA 消化后, 通过流式细胞术检测到的与DNA 结合的P I 的荧光强度直接反映了细胞内DNA含量的多少。
由于细胞周期各时相的DNA 含量不同, 通常正常细胞的G 1/ G 0 期具有二倍体细胞的DNA 含量( 2N) ,而G 2/ M 期具有四倍体细胞的DNA 含量( 4N) ,而S 期的DNA含量介于二倍体和四倍体之间。
因此,通过流式细胞术P I染色法对细胞内DNA 含量进行检测时,可以将细胞周期各时相区分为G 1/ G 0 期,S 期和G 2/ M 期,并可通过特殊软件计算各时相的百分率。
值得注意的是,PI不能通过细胞膜完整的细胞(如活细胞和早期凋亡细胞) ,在标本制备时, 必须先用乙醇或其他破膜剂增强细胞膜的通透性, 才能使P I进入细胞内与细胞内的核酸结合。
乙醇通常为终浓度为70 %的冷乙醇。
2.试剂配制RNase A,注意分装保存,防止反复冻融。
PI 购自Sigma公司货号P-4170,通常用过滤除菌的PBS配置成500μg/ml的储液避光保存备用,细胞染色时用PBS稀释到50μg/ml。
二.实验步骤1.细胞的收集:将处理好的细胞样品组用含EDTA的0.25%胰酶消化细胞呈单细胞悬液,DMEM+10%FBS终止消化后,200g离心3min沉淀细胞。
2.细胞的固定:将离心收集的细胞用500μL预冷的PBS悬起,200g离心3min沉淀细胞,弃上清,以充分去除残留的FBS和胰酶;加入-20℃预冷的70%乙醇500μL悬浮细胞,于4℃固定30min或-20℃固定过夜。
(此处,加乙醇时应注意边加入变吹起细胞,放置固定时细胞结成团,难以吹散而影响后续的检测)3.RNA的去除:将固定好的细胞,200g离心5min沉淀细胞弃去上清液;500μL预冷的PBS悬浮细胞,200g离心3min沉淀细胞,弃去上清液;用500μL 100μg/ml的RNase A 在37℃下温育30min以充分降解细胞内RNA。

碘化丙啶染色步骤
碘化丙啶染色是一种常见的核酸染色方法,在细胞和组织学研究中广泛应用。
其步骤如下:
1.取一定量的细胞或组织标本,用生理盐水或PBS洗涤去除表面杂质。
2.将样本固定在载玻片上,可以使用多种固定剂,如4%聚乙烯醇(PVA)、95%乙醛等。
3.用1%碘化丙啶溶液覆盖标本,染色时间一般为5-10分钟。
4.洗去碘化丙啶染色液,用70%乙醇洗涤10-20秒钟,可重复洗涤2-3次。
5.再用绝对乙醇洗涤10-20秒钟,可重复洗涤2-3次。
6.最后用苯酚溶液清洗数秒钟,然后用苯酚-乙醇(1:1)复制剂液备用。
7.用显微镜观察、拍照或判定分析。
注意事项:
1.碘化丙啶染色液颜色应呈鲜红色,如色泽变深则需要更换新液。
2.在染色前要保证标本充分固定,避免细胞或组织形态失真。
3.洗涤过程中应注意避免样本干燥和爆裂,避免对标本造成损害。
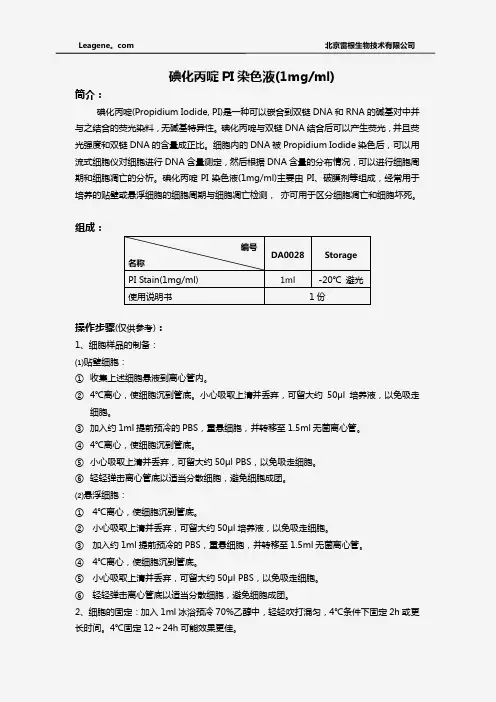
碘化丙啶PI 染色液(1mg/ml)简介:碘化丙啶(Propidium Iodide, PI)是一种可以嵌合到双链DNA 和RNA 的碱基对中并与之结合的荧光染料,无碱基特异性。
碘化丙啶与双链DNA 结合后可以产生荧光,并且荧光强度和双链DNA 的含量成正比。
细胞内的DNA 被Propidium Iodide 染色后,可以用流式细胞仪对细胞进行DNA 含量测定,然后根据DNA 含量的分布情况,可以进行细胞周期和细胞凋亡的分析。
碘化丙啶PI 染色液(1mg/ml)主要由PI 、破膜剂等组成,经常用于培养的贴壁或悬浮细胞的细胞周期与细胞凋亡检测, 亦可用于区分细胞凋亡和细胞坏死。
组成:操作步骤(仅供参考):1、细胞样品的制备:⑴贴壁细胞:① 收集上述细胞悬液到离心管内。
② 4℃离心,使细胞沉到管底。
小心吸取上清并丢弃,可留大约50μl 培养液,以免吸走细胞。
③ 加入约1ml 提前预冷的PBS ,重悬细胞,并转移至1.5ml 无菌离心管。
④ 4℃离心,使细胞沉到管底。
⑤ 小心吸取上清并丢弃,可留大约50μl PBS ,以免吸走细胞。
⑥ 轻轻弹击离心管底以适当分散细胞,避免细胞成团。
⑵悬浮细胞:① 4℃离心,使细胞沉到管底。
② 小心吸取上清并丢弃,可留大约50μl 培养液,以免吸走细胞。
③ 加入约1ml 提前预冷的PBS ,重悬细胞,并转移至1.5ml 无菌离心管。
④ 4℃离心,使细胞沉到管底。
⑤ 小心吸取上清并丢弃,可留大约50μl PBS ,以免吸走细胞。
⑥ 轻轻弹击离心管底以适当分散细胞,避免细胞成团。
2、细胞的固定:加入1ml 冰浴预冷70%乙醇中,轻轻吹打混匀,4℃条件下固定2h 或更长时间。
4℃固定12~24h 可能效果更佳。
编号 名称 DA0028 Storage PI Stain(1mg/ml) 1ml -20℃ 避光 使用说明书 1份3、细胞的清洗:①4℃离心,使细胞沉到管底。
②小心吸取上清并丢弃,可留大约50μl溶液,以免吸走细胞。

DNA含量检测试剂盒(细胞周期)使用说明DNA Content Quantitation Assay(Cell Cycle)货号:CA1510规格:20T/50T保存:-20℃避光保存,一年有效。
产品说明:细胞周期是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂结束所经历的整个过程。
在这个过程中,细胞遗传物质复制并加倍,且在分裂结束时平均分配到两个子细胞中去。
细胞周期又可以分为间期和有丝分裂期,细胞间期常划分为休眠期(G0),DNA合成前期(G1),DNA合成期(S),DNA合成后期(G2),整个周期可表示为G1→S→G2→M。
DNA周期检测可用来反应细胞周期的各个期的状况,即细胞增殖状况。
利用细胞内DNA能够和荧光染料(如碘化丙啶PI)结合的特性,细胞各个时期其DNA含量不同从而结合的荧光染料不同,流式细胞仪检测的荧光强度也不一样。
细胞发生凋亡时,由于胞浆和染色质浓缩,核裂解,产生凋亡小体,使细胞的光散射性质发生变化。
在细胞凋亡的早期,细胞对前向角光散射的能力显著降低,对90°角光散射的能力增加或没有变化。
在细胞凋亡的晚期,前向角和90°角光散射的信号均降低。
因此可以通过流式细胞仪测定细胞光散射的变化来观察凋亡细胞。
用PI对细胞进行染色,凋亡细胞由于总DNA 量降低,于正常G0/G1细胞群前出现DNA低染细胞群,即G1峰前出现亚二倍体峰(sub-G1),即细胞凋亡群。
本试剂盒可应用于培养细胞(悬浮、贴壁)的DNA含量(细胞周期)检测。
试剂盒组成:试剂名称CA1510-20T CA1510-50T保存条件RNase A 2.0mL 5.0mL-20℃PI染色液8.0mL20.0mL-20℃避光使用方法:(仅供参考)1、用适当的方法诱导细胞凋亡,同时设立阴性对照组,并收集细胞。
2、用PBS洗涤细胞一次,1500rpm,5min离心收集,调整细胞浓度为1×106/ml,取1ml单细胞悬液。

PI 染色荧光染料PI(碘化丙啶)是一种可对DNA染色的细胞核染色试剂,常用于细胞凋亡检测,英文全称是Propidium Iodide。
它是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光。
尽管PI不能通过活细胞膜,但却能穿过破损的细胞膜而对核染色。
PI经常被用来与Calcein-AM或者FDA等荧光探针一起使用,能同时对活细胞和死细胞染色。
PI-DNA复合物的激发和发射波长分别为535 nm 和615 nm。
PI可以用来进行活细胞、死细胞的双重染色钙黄绿素-AM(Calcein-AM)和碘化丙啶(PI)溶液,它们分别可对活细胞和死细胞染色。
Calcein -AM的乙酸甲基酯亲脂性很高,使其可透过细胞膜。
尽管Calcein -AM本身并不是荧光分子,但通过活细胞内的酯酶作用,Calcein -AM能脱去AM 基,产生的Calcein能发出强绿色荧光(激发:490 nm,发射:515 nm)。
因此Calcein -AM仅对活细胞染色。
另一方面,作为核染色染料的PI不能穿过活细胞的细胞膜。
它穿过死细胞膜的无序区域而到达细胞核,并嵌入细胞的DNA双螺旋从而产生红色荧光(激发:535 nm,发射:617 nm)。
由于Calcein和PI-DNA 都可被490 nm激发,因此可用荧光显微镜同时观察活细胞和死细胞。
用545 nm 激发,仅可观察到死细胞。
由于不同细胞系的最佳染色条件不同,我们建议个别确定PI和Calcein -AM的合适浓度。
I.试剂Calcein-AMPIII.用荧光显微镜观察细胞形态以HeLa细胞染色为例,请注意不同的细胞种类、不同浓度有不同的观察条件。
根据细胞条件,摸索不同条件下的细胞贴壁情况和试剂浓度的配制等最佳条件。
1.染色溶液的配制1)用1 ml无水DMSO溶解1 mg Calcein-AM,制备成1 mmol/l 的Calcein-AM储备液,-20℃下密闭冷冻保存。
O溶解1 mg PI,制备成1.5 mmol/l的PI储备液(1 mg PI/1 ml 2)用1 ml ddH2O),-20℃下密闭冷冻保存。


PI标记法检测细胞周期1.实验原理:PI染料即碘化丙啶,是流式检测细胞周期应荣最为广泛的荧光染料。
PI能与细胞内的双链DNA和RNA结合,被488nm激光激发后发射红荧光,与核酸结合后其发射荧光信号的能力会提高20~30倍。
PI染料不能自由穿过活细胞完整的细胞膜,标记时需先用乙醇固定细胞,使细胞膜的通透性增加,这样PI染料就能通过细胞膜进入细胞内与核酸结合,标记时需同时加入RNA酶消化细胞内的RNA,使PI只能与细胞内的DNA 结合,反映细胞内DNA的含量,继而通过细胞内DNA的含量确定细胞周期。
后来发展了用低渗的柠檬酸溶液一步标记PI燃料法,细胞在低渗的条件下其细胞膜的通透性增加,PI染料就可以进入细胞膜如细胞内的DNA结合,此法简便,快捷,应用更为广泛。
2.试验步骤PI标记方法一(乙醇固定法):(1)将需要分析的目标细胞制成单细胞悬液,取2x106细胞,离心沉淀,弃上清。
(2)200μl PBS重悬沉淀于1.5mlEppendorf管中,缓慢加入1ml预冷的(保存于4℃)的70%乙醇固定目标细胞。
充分混匀,4℃静置30min。
(3)离心沉淀,弃上清,200μl适当浓度的PI染液重悬细胞,同时加入RNA酶,充分混匀,4℃静置30min。
(4)离心沉淀,弃上清,200μl流式PBS重悬沉淀,流式上样分析。
PI标记方法二(低渗法)(1)低渗柠檬酸标记液配制:柠檬酸三钠0.25g,TritonX-100(聚乙二醇辛基苯基醚)0.75ml,PI 0.025g,RNA酶0.005g,用双蒸水补足至250ml。
(2)将需要分析的目标细胞制成单细胞悬液,取2x106细胞,离心沉淀,弃上清(3)1ml低渗柠檬酸标记液重悬沉淀,充分混匀,4℃静置30min.(4)离心沉淀,弃上清,200μl流式PBS重悬沉淀,流式上样分析。
3.注意事项检测细胞内DNA含量时必须保证样品内的细胞都是处于单细胞状态,但是在实际样品中经常会出现粘连的双细胞和多细胞团块,而流式细胞仪可能会将粘连在一起的两个二倍体细胞当作是一个四倍体的细胞,如果粘连的细胞较多而没有在分析时排除流式分析时就会得到比实际情况高很多的G2/M期细胞的比例,得到的流式结果就不准确。
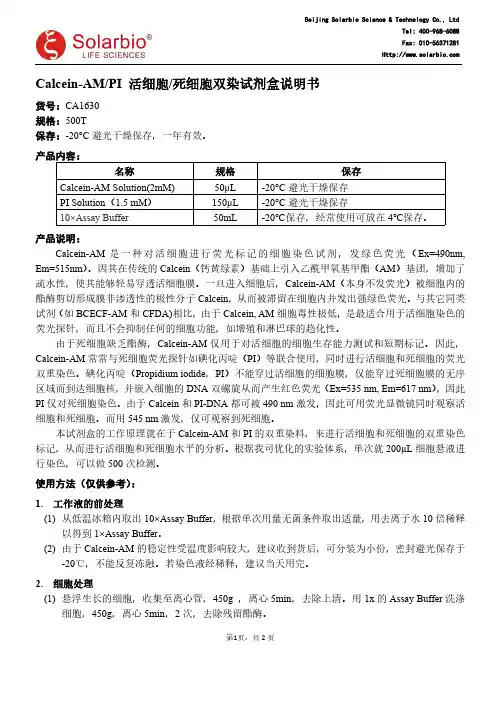
Calcein-AM/PI 活细胞/死细胞双染试剂盒说明书货号:CA1630规格:500T保存:-20°C 避光干燥保存,一年有效。
产品内容:名称规格保存Calcein-AM Solution(2mM)50μL -20°C 避光干燥保存PI Solution (1.5mM )150μL -20°C 避光干燥保存10×Assay Buffer 50mL -20℃保存,经常使用可放在4℃保存。
产品说明:Calcein-AM 是一种对活细胞进行荧光标记的细胞染色试剂,发绿色荧光(Ex=490nm,Em=515nm )。
因其在传统的Calcein (钙黄绿素)基础上引入乙酰甲氧基甲酯(AM )基团,增加了疏水性,使其能够轻易穿透活细胞膜。
一旦进入细胞后,Calcein-AM (本身不发荧光)被细胞内的酯酶剪切形成膜非渗透性的极性分子Calcein ,从而被滞留在细胞内并发出强绿色荧光。
与其它同类试剂(如BCECF-AM 和CFDA)相比,由于Calcein,AM 细胞毒性极低,是最适合用于活细胞染色的荧光探针,而且不会抑制任何的细胞功能,如增殖和淋巴球的趋化性。
由于死细胞缺乏酯酶,Calcein-AM 仅用于对活细胞的细胞生存能力测试和短期标记。
因此,Calcein-AM 常常与死细胞荧光探针如碘化丙啶(PI )等联合使用,同时进行活细胞和死细胞的荧光双重染色。
碘化丙啶(Propidium iodide ,PI )不能穿过活细胞的细胞膜,仅能穿过死细胞膜的无序区域而到达细胞核,并嵌入细胞的DNA 双螺旋从而产生红色荧光(Ex=535nm,Em=617nm ),因此PI 仅对死细胞染色。
由于Calcein 和PI-DNA 都可被490nm 激发,因此可用荧光显微镜同时观察活细胞和死细胞。
而用545nm 激发,仅可观察到死细胞。
本试剂盒的工作原理就在于Calcein-AM 和PI 的双重染料,来进行活细胞和死细胞的双重染色标记,从而进行活细胞和死细胞水平的分析。

水稻幼苗根尖PI染色一、原理PI:英文名:Propidium iodide 中文名:碘化丙啶染色原理:碘化丙啶(PI)是一种溴化乙啶(EB)的类似物。
PI在540nm波长(绿色光)的激发下,会在600nm(红色光)处发出明亮的荧光。
PI不能通过活细胞膜,但却能穿过破损的细胞膜而对核染色。
它能与细胞壁上的碳水化合物共价结合,对细胞壁进行标记。
Standard confocal laser microscopy was performed using a Leica SP5laser point scanning microscope. propidium iodide was excited using the 488 nm argon laser, and fluorescence emissions were captured between 580 nm and 640 nm for propidium iodide.二、染色过程1 固定:材料置于固定液(50%甲醇+10%醋酸)中,4℃放置至少12h (最长可放置1个月)2 用水清洗材料,置于1%高碘酸溶液中,室温放置40min。
(使细胞壁上的碳水化合物形成醛基)3 用水清洗材料,置于希夫试剂(含PI)1-2h或直至肉眼可见材料染上红色为止(醛基与PI共价结合)希夫试剂(含PI):焦亚硫酸100mMHCl 0.15NPI 100μg/ml(现加)4 取出样品置于载玻片上,用水合氯醛溶液覆盖样品,室温放置过夜(置于密闭容器中,防止溶液挥发)水合氯醛溶液:水合氯醛4g甘油1mlH2O 2ml5 除去多余水合氯醛溶液,滴数滴Hoyer’s solution,盖上盖玻片,放置3天后显微镜下观察。
Hoyer’s solution:水溶性阿拉伯胶30g水合氯醛200g甘油20gH2O 50ml三、注意事项:(1)由于PI可能具有致癌性,请小心操作。
(2)保存条件:4℃避光保存(3)对人体有刺激性,请注意适当防护。

碘化丙啶PI溶液的使用方及注意事项
货号:C0080
规格:1ml/1ml×10
保存:-20℃,有效期至少2年
产品说明:
碘化丙啶(Propidium Iodide,PI)是一种可对DNA染色的细胞核染色试剂。
它是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光。
PI不能穿透完整细胞膜,但对凋亡晚期细胞和死细胞的破损细胞膜能够穿透,并使细胞核红染。
PI经常被用来与Calcein-AM或者FDA等荧光探针一起使用,能同时对活细胞和死细胞染色。
PI-DNA复合物的激发和发射波长分别为535nm和615nm。
常用于流式细胞仪分析和显微镜观察,检测细胞凋亡(apoptosis)或细胞坏死(necrosis)。
本产品为PI水溶液,浓度为1mg/ml。
使用时根据实验不同直接将本产品用相应溶液稀释到工作浓度。
使用方法:(仅供参考)
培养细胞染色
1、取适量PI水溶液加到PBS中,制备成10-50µM(6.7-33.4µg/ml)的PI溶液。
2、将1/10培养基体积的PI溶液加入到细胞培养基中。
3、在37℃培养细胞10-20分钟。
4、用PBS或合适的缓冲液洗细胞两次。
5、置于荧光显微镜下观察,激发波长为535nm,发射波长为615nm。
注意事项:
1.PI被普遍认为具有致癌性,操作时应戴手套,并避免交叉污染。
2.本产品需避光,并尽量避免反复冻融。
PI单染检测细胞周期原理:碘化丙啶(Propidium ,简称PI)是一种双链DNA的荧光染料。
碘化丙啶和双链DNA结合后可以产生荧光,并且荧光强度和双链DNA的含量成正比。
细胞内的DNA被碘化丙啶染色后,可以用流式细胞仪对细胞进行DNA含量测定,然后根据DNA含量的分布情况,可以进行细胞周期和细胞凋亡分析。
操作步骤:1、对于悬浮细胞,直接离心收集细胞,弃上清,在4 ℃、1200rmp下用预冷的PBS洗细胞两次;对于贴壁细胞,先用不含EDTA的0.25%的胰酶消化再离心收集细胞;2、加入预冷的70%乙醇(PBS配制),于4℃固定过夜,或-20℃长期固定;3、离心收集细胞,以1 mL预冷的PBS洗细胞一次,加入预冷的PBS重悬细胞,调整细胞浓度为1.0×106,取出100 ul细胞悬液,加入RNase A酶,使RNase A终浓度为1 mg/ml,混匀后37 ℃水浴30 min;4、加入PI综合染色液,使PI终浓度为50 ug/mL,混匀,4℃冰箱避光保存;5、300目尼龙网过滤后,上机检测。
注意事项:1、细胞浓度一定要≧1×106/ml,特别是阴性对照管细胞量要大一些,以便样品电压调节;2、必须保证被检测样品为单细胞悬液;3、如果样品细胞为培养的贴壁细胞,将上清转入离心管(其中含有脱落的凋亡细胞),与不含EDTA的胰酶消化的细胞合并后离心收集细胞;4、在细胞固定时一定要将细胞吹开,吹成单细胞悬液;5、RNAse与PI综合染液分开的原因是RNAse的作用最适温度是37℃,而不是4℃,所以与教材有所不同;6、PI综合染液不能用蒸馏水配,否则细胞全部溶解,造成结果不可靠;7、4℃过夜一般隔天就进行检测,如果想推迟几天测,那就保存在-20℃,有资料显示-20℃可以至少保存一个月;8、70%~75%的酒精都可以用于PI单染固定。
关于PI(碘化丙啶)的讨论组织中的细胞周期和凋亡检测方法之一--PI法schoman无论是肿瘤或其它正常新鲜组织均可用PI(碘化丙啶)的方法来检测,这是一种常见而且便宜的方法。
主要操作步骤如下:1、组织块用0.25%胰酶消化30min-1h。
2、200-400目筛网过滤细胞,获得单细胞悬液。
3、75%乙醇(-20度预冷)固定细胞1h。
4、加入PI(终浓度50ug/ml)和无DNA酶污染的RNA酶(终浓度50ug/ml)1ml染色30min -1h。
5 、流式细胞仪检测细胞周期和凋亡。
注意事项:1、组织消化后使细胞形成单个细胞悬液是本检测方法的关键。
如组织难以消化,可加入适量胶原酶。
另外,消化前,用剪刀将组织剪成小块也不要忘了。
2、细胞可尽量的多准备(at least 100 thousand),这样流式检测方便,结果可靠。
3、每次消化的时间等条件应尽量一致,否则使实验结果CV值偏大。
4、细胞用乙醇固定后可以访置48小时(4度保存)后检测,便于无法立即检测的实验者,对实验结果基本没有影响。
其它也有一些检测凋亡的方法,均有商品化试剂盒。
在此不赘述。
yanzishenyang:我看相关的说明:碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的与DNA结合的荧光染料(如PI)不能时入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。
应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。
偶得细胞是用PI染色的,经过流氏细胞仪检测出现一个亚二倍体峰,是否能和坏死区别?因为偶用的作用细胞的蛋白本身可以造成细胞膜的损伤,所以PI可以进入细胞,这是否意味着我检测的结果无法区分凋亡和坏死?hdhdhd0000:用PI法识别凋亡时,有一种方法叫SUB-G1法,这种方法需要在染PI前加入适量的破膜剂(磷酸盐-枸橼酸盐缓冲盐),我们称之为PC液,它会让晚期凋亡所形成的DNA小碎片部分出膜而使胞内的DNA总含量减少,从而使流式上的DNA直方图的G0/G1峰前出现一个亚二倍体峰,也就是SUB-G1峰(凋亡峰)!用荧光2的面积做直方图可以清楚的看见凋亡峰,但是要区分APo和Nec需要少量的经验,而在荧光2高度图上,因为是用的是对数,所以可以把凋亡和坏死拉开,凋亡峰在不同的细胞周期特异性细胞凋亡时,都特异性的出现在10的2次方荧光道数处,坏死在10的1次方处,从而可以清楚的分清它们。
Revised: 05/17/99Product Information Propidium Iodide Nucleic Acid StainP-1304propidium iodideP-3566propidium iodide, 1 mg/mL solution in waterIntroductionPropidium iodide (PI) binds to DNA by intercalating between the bases with little or no sequence preference and with a stoichi-ometry of one dye per 4–5 base pairs of DNA.1 PI also binds to RNA, necessitating treatment with nucleases to distinguish be-tween RNA and DNA staining. Once the dye is bound to nucleic acids, its fluorescence is enhanced 20- to 30-fold, the fluores-cence excitation maximum is shifted ~30–40 nm to the red and the fluorescence emission maximum is shifted ~15 nm to the blue.2 Although its molar absorptivity (extinction coefficient) is relatively low, PI exhibits a sufficiently large Stokes shift to allow simultaneous detection of nuclear DNA and fluorescein-labeled antibodies, provided the proper optical filters are used.Propidium iodide is suitable for fluorescence microscopy, confo-cal laser scanning microscopy, flow cytometry and fluorometry.PI is membrane impermeant and generally excluded from viable cells. PI is commonly used for identifying dead cells in apopulation and as a counterstain in multicolor fluorescent tech-niques. The counterstaining protocols below are compatible with a wide range of cytological labeling techniques — direct or indi-rect antibody-based detection methods, mRNA in situ hybridiza-tion or staining with fluorescent reagents specific for cellular structures. These protocols can be modified for tissue staining.MaterialsStorage and HandlingUpon receipt, store the solid (P-1304) at room temperature,protected from light. The solid should be stable for at least a year. Store the solution of PI (P-3566) at 4°C, protected from light. To make a stock solution from the solid form, dissolve PI (MW = 668.4) in deionized water (dH 2O) at 1 mg/mL (1.5 mM)and store at 4°C, protected from light. When handled properly,solutions are stable for at least 6 months.Caution : PI is a known mutagen. Solutions containing PI should be poured through activated charcoal before disposal.The charcoal must then be incinerated to destroy the dye.Fluorescence Spectral CharacteristicsWhen bound to nucleic acids, the absorption maximum for PI is 535 nm and the fluorescence emission maximum is 617 nm (Figure 1). PI can be excited with a xenon or mercury-arc lamp or with the 488 line of an argon-ion laser. Molecular Probes offers high quality Omega Optical filter sets for fluorescence microscopy. Filter sets O-5725 and O-5729 are optimized to match the spectral properties of PI. Generally, PI fluorescence is detected in the FL2 channel of flow cytometers.Protocol for Counterstaining Adherent Cells for Fluorescence MicroscopySample PreparationUse the fixation protocol appropriate for your sample. PI stain-ing is normally performed after all other staining. Note that per-meabilization of the cells is required for counterstaining with PI.RNase TreatmentRNase treatment is required if samples are fixed in paraform-aldehyde, formaldehyde or glutaraldehyde. If samples are fixed with methanol/acetic acid or acetone, RNase treatment is usually not required.1.1 Equilibrate the sample briefly in 2X SSC (0.3 M NaCl,0.03 M sodium citrate, pH 7.0).Figure 1. Absorption and fluorescence emission profiles of propidium iodide bound to dsDNA.1.2 Incubate in 100 µg/mL DNase-free RNase in 2X SSC for20 minutes at 37°C.1.3 Rinse samples 3 times, 1 minute each, in 2X SSC. Counterstaining Protocol2.1 Equilibrate the sample in 2X SSC.2.2 Make a 500 nM solution of PI by diluting the 1 mg/mL (1.5 mM) stock solution 1:3000 in 2X SSC. About 300 µL is usually enough stain for one coverslip preparation. Incubate cells, covered with the dilute stain, for 1–5 minutes.2.3 Rinse samples several times in 2X SSC. Drain excess buffer from coverslip and mount in a medium with an antifade reagent such as provided in Molecular Probes’ SlowFade®Antifade Kit, SlowFade Light Antifade Kit or ProLong® Antifade Kit.2.4 View sample using a fluorescence microscope with appropri-ate filters (see Fluorescence Spectral Characteristics).Protocol for Counterstaining Cells in Suspension for Flow CytometrySample PreparationUse the fixation protocol appropriate for your sample, or use the following protocol.3.1 Collect a volume of cell suspension corresponding to 2 × 105 to 1 × 106 cells. Pellet the cells by centrifugation. Discard the supernatant, tap the tube to resuspend pellet in the residual liquid and add 1 mL of phosphate-buffered saline (PBS) at room tem-perature.3.2 Transfer the full volume of resuspended cells to 4 mL of absolute ethanol at -20°C by pipetting the cell suspension slowly into the ethanol while vortexing at top speed. Leave in ethanol at -20°C for 5 to 15 minutes.3.3 Pellet the cells by centrifugation, discard the ethanol, tap the tube to loosen the pellet and add 5 mL PBS at room temperature. Allow cells to rehydrate for 15 minutes. Counterstaining Protocol4.1 Make a 3 µM solution of PI by diluting the 1 mg/mL(1.5 mM) stock solution 1:500 in Staining Buffer (100 mM Tris,pH 7.4, 150 mM NaCl, 1 mM CaCl2, 0.5 mM MgCl2, 0.1% Nonidet® P-40). A 1 mL volume will be required for each cell sample.4.2 Centrifuge the cell suspension from step 3.3, discard the supernatant, tap to loosen the pellet and add 1 mL of PI-Staining Buffer. Incubate for 15 minutes at room temperature and analyze by flow cytometry in the presence of the dye. If the cells are to be viewed by fluorescence microscopy, centrifuge the sample, re-move the supernatant and resuspend the cells in fresh buffer. Apply a drop of the suspension to a microscope slide, cover with a coverslip and view.Protocol for Chromosome FISH Counterstaining Sample PreparationPrepare the specimen according to standard procedures.3,4 Briefly rinse the final preparations in dH2O before counter-staining to remove residual buffer salts from the slide. Air dry. This final rinse will help reduce nonspecific background staining on the glass.Counterstaining Protocol5.1 Make a 1.5 µM PI staining solution by diluting the 1 mg/mL (1.5 mM) stock solution 1:1000 in PBS. Pipet 300 µL of this staining solution directly onto the specimen. If necessary, RNaseA (freshly made) may be added to a final concentration of10 µg/mL. A plastic coverslip can be used to distribute the dye evenly on the slide.5.2 Incubate the specimen in the dark for 30 minutes at room temperature, or at 37°C if RNase is included.5.3 Remove the coverslip and rinse briefly with PBS or dH2O to remove unbound dye.5.4 Remove excess liquid from the slide by gently blotting around the sample with an absorbent tissue. Place a glass cover-slip on the slide, and seal the edges with wax or nail polish. Alternatively, the preparation can be mounted in an antifade re-agent according to the manufacturer’s directions.5.5 View sample using a fluorescence microscope with appropri-ate filters (see Fluorescence Spectral Characteristics).References1. J Mol Biol 13, 269 (1965);2. Meth Cell Biol 30, 417 (1989);3. Meth Enzymol 168, 741 (1989);4. Pardue, M.L. in Nucleic Acid Hybridization, A Practical Approach,. B.D. Hames and S.J. Higgins, Eds., IRL Press, Oxford, England (1985).Product List Current prices may be obtained from our Web site or from our Customer Service Department.Cat #Product Name Unit Size P-7481ProLong® Antifade Kit................................................................................................................................................................ 1 kit P-1304pro pidium io dide........................................................................................................................................................................100 mg P-3566propidium iodide *1.0 mg/mL solution in water*........................................................................................................................10 mL S-2828SlowFade® Antifade Kit............................................................................................................................................................. 1 kit S-7461SlowFade®Light Antifade Kit..................................................................................................................................................... 1 kitContact InformationFurther information on Molecular Probes' products, including product bibliographies, is available from your local distributor or directly from Molecular Probes. Customers in Europe, Africa and the Middle East should contact our office in Leiden, the Netherlands. All others should contact our Technical Assis-tance Department in Eugene, Oregon.Please visit our Web site for the most up-to-date informationMolecular Probes, Inc.PO Box 22010, Eugene, OR 97402-0469Phone: (541) 465-8300 Fax: (541) 344-6504Customer Service: 7:00 am to 5:00 pm (Pacific Time) Phone: (541) 465-8338 Fax: (541) 344-6504 order@ Toll-Free Ordering for USA and Canada:Order Phone: (800) 438-2209 Order Fax: (800) 438-0228 Technical Assistance: 8:00 am to 4:00 pm (Pacific Time) Phone: (541) 465-8353 Fax: (541) 465-4593 tech@ Molecular Probes Europe BVPoortGebouw, Rijnsburgerweg 102333 AA Leiden, The NetherlandsPhone: +31-71-5233378 Fax: +31-71-5233419 Customer Service: 9:00 to 16:30 (Central European Time) Phone: +31-71-5236850 Fax: +31-71-5233419 eurorder@probes.nlTechnical Assistance: 9:00 to 16:30 (Central European Time) Phone: +31-71-5233431 Fax: +31-71-5233419 eurotech@probes.nlMolecular Probes products are high-quality reagents and materials intended for research purposes only. These products must be used by, or directly under the supervision of, a technically qualified individual experienced in handling potentially hazardous chemicals. Please read the Material Safety Data Sheet provided for each product; other regulatory considerations may apply.Several of Molecular Probes products and product applications are covered by U.S. and foreign patents and patents pending. Our products are not available for resale or other commercial uses without a specific agreement from Molecular Probes, Inc. We welcome inquiries about licensing the use of our dyes, trademarks or technologies. Please submit inquiries by e-mail to busdev@. All names containing the designation ® are registered with the U.S. Patent and Trademark Office.Copyright 1999, Molecular Probes, Inc. All rights reserved. This information is subject to change without notice.。
Annexin V-FITC / PI荧光双染细胞凋亡检测试剂盒货号: P-CA-201规格: 20Assays / 50Assays / 100Assays / 200Assays产品编号产品名称20Assays 50Assays 100Assays 200Assays Storage P-CA-101 Annexin V-FITC 染色液100 μL250 μL500 μL 1 mL 2~8℃. 避光P-CA-151 Annexin V Binding Buffer(10×) 1.4 mL×2 5.5 mL 11 mL 11 mL×2 2~8°C 碘化丙啶(PI)染色液P-CA-161 100 μL250 μL500 μL 1 mL 2~8℃, 避光说明书一份保存条件2~8℃可保存1年。
Annexin V-FITC禁止冷冻保存。
实验原理Annexin V-FITC/PI 荧光双染细胞凋亡检测试剂盒,可用于检测悬浮细胞和贴壁细胞的凋亡。
Annexin V是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸(PS) 有高度亲和力。
当细胞发生凋亡时,膜内侧的磷脂酰丝氨酸(PS) 外翻到膜表面,而被荧光染料FITC标记的Annexin V结合,可通过流式细胞仪或荧光显微镜进行检测。
由于凋亡晚期或坏死细胞膜丧失完整性,而碘化丙啶(Propidium Iodide, PI)可与双链DNA特异性结合并产生强烈的荧光,与Annexin V搭配使用,可区分处于不同凋亡时期的细胞。
本试剂盒检测喜树碱诱导的Jurkat细胞凋亡效果如下图所示:Jurkat细胞用 5 μM喜树碱(Camptothecin)(左) 或未加药(右) 处理4 h,本试剂盒染色后流式检测。
Annexin V-FITC单阳细胞为早期凋亡细胞,AnnexinV-FITC和PI双阳细胞为坏死或晚期凋亡细胞,PI单阳细胞为裸核细胞。
流式细胞仪检测细胞凋亡——PI单染色法碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,细胞膜通透性无明显改变,相对分子质量大的与DNA结合的荧光染料(如PI)不能进入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。
应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。
基本原理其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。
这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面:1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。
研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。
许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。
2. 光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。
在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。
在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。
此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加。
细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。
但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。
因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。
根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。
BD556547凋亡试剂盒使⽤⽅法⼀、概述在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发⽣凋亡早期,膜磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧,这⼀变化早于细胞皱缩、染⾊质浓缩、DNA⽚断化和细胞膜的通透性增加等凋亡现象。
AnnexinV是⼀种磷脂结合蛋⽩,与磷脂酰丝氨酸有⾼度亲和⼒,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之⼀。
碘化丙啶(Propidium Iodide,PI)是⼀种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期的细胞和死细胞由于细胞膜通透性的增加,PI能够透过细胞膜⽽使细胞核染红。
因此将Annexin V与PI匹配使⽤,就可以将处于不同凋亡时期的细胞区分开来。
⼆、BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒的组份:556547a Annexin V Binding Buffer, 10X conc (51-66121E)556547b Annexin V-FITC (51-65874X)556547c Propidium Iodide Staining Solution(51-66211E)三、BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒的操作步骤:贴壁细胞需⽤0.25%的胰酶消化。
注意过度消化可损伤细胞。
在消化时可加2%的BSA可防⽌消化过度。
如果⽤含EDTA的胰酶消化时,注意必须清除EDTA:在标记前⽤1×PBS或1×bindingbuffer洗涤,清除EDTA,以免残余的EDTA与Ca2+螯合,影响Annexin V的结合。
(1)⽤去离⼦⽔将10×Binding Buffer稀释成1×Binding Buffer;(2)细胞收集。
悬浮细胞收集:离⼼5分钟;贴壁细胞:⽤不含EDTA的胰酶消化收集后(注:胰酶消化时间不宜过长,否则会影响细胞膜上磷脂酰丝氨酸与Annexin V-FITC的结合),于室温2000rpm离⼼5~10分钟,收集细胞)(3)细胞洗涤:⽤预冷1×PBS(4℃)重悬细胞⼀次,2000rpm离⼼5~10分钟,洗涤细胞;(4)加⼊300µL 的1×Binding Buffer 悬浮细胞;(5)Annexin V-FITC标记:加⼊5µL的Annexin V-FITC混匀后,避光,室温孵育15分钟;(6)PI标记:上机前5分钟再加⼊5µL的PI染⾊。
碘化丙啶PI溶液的使用方及注意事项
货号:C0080
规格:1ml/1ml×10
保存:-20℃,有效期至少2年
产品说明:
碘化丙啶(Propidium Iodide,PI)是一种可对DNA染色的细胞核染色试剂。
它是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光。
PI不能穿透完整细胞膜,但对凋亡晚期细胞和死细胞的破损细胞膜能够穿透,并使细胞核红染。
PI经常被用来与Calcein-AM或者FDA等荧光探针一起使用,能同时对活细胞和死细胞染色。
PI-DNA复合物的激发和发射波长分别为535nm和615nm。
常用于流式细胞仪分析和显微镜观察,检测细胞凋亡(apoptosis)或细胞坏死(necrosis)。
本产品为PI水溶液,浓度为1mg/ml。
使用时根据实验不同直接将本产品用相应溶液稀释到工作浓度。
使用方法:(仅供参考)
培养细胞染色
1、取适量PI水溶液加到PBS中,制备成10-50µM(6.7-33.4µg/ml)的PI溶液。
2、将1/10培养基体积的PI溶液加入到细胞培养基中。
3、在37℃培养细胞10-20分钟。
4、用PBS或合适的缓冲液洗细胞两次。
5、置于荧光显微镜下观察,激发波长为535nm,发射波长为615nm。
注意事项:
1.PI被普遍认为具有致癌性,操作时应戴手套,并避免交叉污染。
2.本产品需避光,并尽量避免反复冻融。