抗坏血酸,可滴定酸测定方法
- 格式:doc
- 大小:33.00 KB
- 文档页数:3

一. 目的掌握滴定法测定Vc含量的基本原理和操作。
二. 原理L-抗坏血酸(Vc)中的—C=C—基具有还原性,还原型L-抗坏血酸能与氧化剂染料2,6-二氯酚靛酚作用,染料本身被还原成无色的衍生物,同时还原态的L-抗坏血酸被氧化成无色的脱氢L-抗坏血酸。
一定量的样品提取液还原标准染料的量与样品中所含Vc的量成正比。
染料2,6-二氯酚靛酚在中性或碱性溶液中呈蓝色,在酸性溶液中呈粉红色。
用2,6-二氯酚靛酚滴定样品,在达到终点之前,滴下的2,6-二氯酚靛酚立即被还原成无色;当溶液中的L-抗坏血酸被消耗完时,滴下的过量的2,6-二氯酚靛酚在酸性体系里呈现粉红色。
所以当溶液从无色转变成微红色时,即为滴定终点。
三. 实验材料及设备1. 材料新鲜蔬菜2. 仪器电子天平3. 器材滴定管:25mL×1移液管:10mL×2 20mL×1容量瓶:100mL×1量筒:50mL×1锥形瓶:100mL×4研钵:1套烧杯:250mL×2 50mL×1洗瓶:1个纱布:20cm×20cm 1块四. 试剂的配制1. 草酸溶液(2%)每组配制250mL2. 2,6-二氯酚靛酚溶液分别称取2,6-二氯酚靛酚300mg、碳酸钠300mg,用热蒸馏水200mL溶解并定容至3000mL(过滤除去难溶颗粒,置于棕色瓶中,贮于冰箱中备用。
有效期一周,使用前需标定,见附注。
)五. 操作步骤1. 样品液的制备(1) 取材:称取新鲜黄瓜10g左右,准确记录称样量g,再称量2.5g草酸,与样品一起用纱布包裹住。
(2) 研磨:样品包置研钵中,加15mL2%草酸,用研棒挤压样包,将样品充分磨细。
将汁液转移到100mL容量瓶中。
残渣再加15mL2%草酸,继续研磨,汁液再合并到上述容量瓶中。
如此反复研磨2~3次,合并汁液。
(3) 定容:最后用2%草酸定容至V=100mL,摇匀备用。

滴定法测定维生素C含量一、本文概述维生素C,也被称为抗坏血酸,是一种重要的水溶性维生素,对人体健康具有多种益处,包括增强免疫力、促进铁质吸收、参与胶原蛋白的合成等。
由于其生理功能和广泛的应用,维生素C的含量测定在食品、药品、化妆品等领域具有重要意义。
滴定法作为一种经典的化学分析方法,因其准确度高、操作简便等优点,被广泛应用于维生素C含量的测定。
本文将详细介绍滴定法测定维生素C含量的原理、实验步骤、注意事项以及结果分析。
通过本文的阅读,读者可以了解滴定法的基本原理和实验操作,掌握维生素C含量测定的基本方法,为实际工作和研究提供有益的参考。
二、滴定法基本原理滴定法是一种常用的化学分析方法,通过测量一种已知浓度的试剂(称为滴定剂)与被测物质发生化学反应所需的量,从而确定被测物质的含量。
在维生素C含量的测定中,滴定法被广泛应用。
滴定法的基本原理是基于化学反应的定量关系。
在滴定过程中,滴定剂与被测物质按照一定的化学计量比进行反应,直到反应完全。
通过测量滴定剂的使用量,可以推算出被测物质的含量。
对于维生素C的滴定测定,通常使用碘作为滴定剂。
维生素C(抗坏血酸)具有还原性,可以与碘发生氧化还原反应。
在滴定过程中,碘逐渐与维生素C反应,直到维生素C完全消耗。
此时,通过测量剩余的碘的量,可以推算出样品中维生素C的含量。
滴定法的优点在于操作简便、准确度高、适用范围广。
然而,滴定法也需要注意一些影响准确度的因素,如滴定剂的纯度、操作误差等。
因此,在进行滴定法测定时,需要严格控制实验条件,确保测量结果的准确性。
通过滴定法,我们可以有效地测定样品中维生素C的含量,为食品、药品等产品的质量控制提供重要依据。
滴定法也为研究维生素C 的生理功能和代谢途径提供了重要的实验手段。
三、实验材料与方法试剂:维生素C标准品,碘酸钾(KIO₃),硫代硫酸钠(Na₂S₂O₃),淀粉指示剂,盐酸(HCl),氢氧化钠(NaOH)等。
标准溶液的制备:精确称取一定量的维生素C标准品,用适量水溶解后,转移到容量瓶中定容,得到标准溶液。

抗坏血酸的测定方法抗坏血酸,也称维生素C,是一种重要的水溶性维生素,对人体有着广泛的作用。
为了评估人体中维生素C的水平,需要进行准确可靠的测定方法。
本文将介绍一些常用的抗坏血酸测定方法。
一、滴定法滴定法是一种直接测定抗坏血酸浓度的方法,主要是利用抗坏血酸的还原性质来进行。
常用的滴定试剂是碘溶液,具体测定过程如下:1.取一定量的待测样品,在酸性条件下加入多余的碘溶液,使样品中的所有抗坏血酸完全被氧化为双价抗坏血酸。
2.再滴加淀粉指示剂,使溶液呈现蓝黑色。
3.继续滴加碘溶液,直至溶液由蓝黑色转变为无色为止。
4.记录滴加的碘溶液体积V,根据反应方程式,计算抗坏血酸浓度:C(抗坏血酸)=(V*m/体积)*M。
滴定法的优点是操作简单、快速,但存在一定的局限性,例如碘溶液的浓度需要严格控制,过量的碘会氧化其他还原物质,导致误差增加。
二、间接滴定法间接滴定法是将样品中的抗坏血酸与为之制备的滴定溶液进行滴定反应,例如利用四氢吡喃溶液作为指示剂,通过判断溶液颜色的变化来确定滴定终点。
三、比色法比色法是根据抗坏血酸颜色的变化来测定其浓度的方法。
常用的试剂有二甲基亚胺、二苯基胺等,通常形成有色络合物,并根据络合物的颜色强度来判断抗坏血酸浓度。
具体步骤如下:1.将待测样品加入试剂溶液中,溶液颜色逐渐变化。
2.将溶液转移到量筒或比色皿中,利用分光光度计测量波长范围内的吸光度。
3.根据标准曲线,将吸光度值转化为抗坏血酸浓度。
比色法的优点是操作简单、灵敏度高;缺点是需要制备标准曲线,对试剂的纯度和光度计的校准要求较高。
四、高效液相色谱法高效液相色谱法(HPLC)是一种准确且高效的抗坏血酸测定方法,主要是通过色谱柱对样品进行分离,再使用紫外光检测器检测抗坏血酸的浓度。
HPLC法的优点是精确度高,测量范围宽,对样品的处理方法相对简单;缺点是设备和试剂成本较高,操作技术要求较高。
总结:针对抗坏血酸的测定,滴定法、比色法、HPLC等方法是常用的测定方法。

维生素C片中抗坏血酸的测定维生素C,也称抗坏血酸,是一种重要的水溶性维生素,具有多种生理功能。
它可以促进铁的吸收和利用,有助于皮肤伤口的愈合、提高人体免疫力,还可以对抗自由基对细胞的损害等等。
由于人体自己无法自行合成维生素C,因此必须通过饮食或补充剂的方式来摄取。
但是,维生素C很容易氧化失去活性,因此在储存过程中需要特别注意。
本文将介绍维生素C片中抗坏血酸的测定方法。
测定原理维生素C是还原型物质,具有还原性,因此可以与氧化剂I2反应,形成色素。
I2在酸性环境下氧化生成I^-,接着I^-离子与维生素C反应成光吸收值较小的I3^-络合物,即维生素C滴定终点。
根据滴定所用的溶液浓度、用量以及生成络合物的光学性质,则可以确定维生素C的含量。
实验药品和设备1.溶液:维生素C浓度为10mg/mL的标准溶液、0.1M硫酸、0.1%淀粉溶液、0.1M碘酸钾溶液、0.1M硫酸铜溶液、0.1M氢氧化钠溶液、0.01M EDTA四钠盐溶液。
2.设备:分析天平、醇灯、10mL锥形瓶、10mL直口瓶、比色皿、可调式电位计、pH 计、定容瓶、移液管等。
实验步骤1.样品准备将维生素C片粉末磨碎,并按照说明书的要求将其溶解在约10mL水中。
磨碎时应避免光照和过度摩擦,以免影响维生素C的稳定性。
溶解后的维生素C片可通过定容转移至10mL锥形瓶内。
2.标准曲线的制备取一定量的维生素C标准溶液,分别置于10mL直口瓶中,通过不同稀释倍数制备不同浓度的标准溶液,计算出维生素C的浓度范围。
然后通过滴定操作得到对应浓度的滴定体积V1。
3.测定未知样品中维生素C的含量将溶解好的维生素C片转移至100mL定容瓶中,配成100mg/L的维生素C溶液。
取0.5mL溶液,加入10mL0.1M硫酸,并进行预滴定加样,加入0.1M碘酸钾溶液,在淀粉试验液的指导下终点处停止滴定至瓶底,记录滴定体积V2。
然后,按照下列公式计算出维生素C的含量:维生素C mg/kg = (V1 - V2) × C ×50 / ns其中,C为0.1M的碘酸钾溶液浓度,ns为加入样品容积,50为维生素C溶液的稀释倍数。

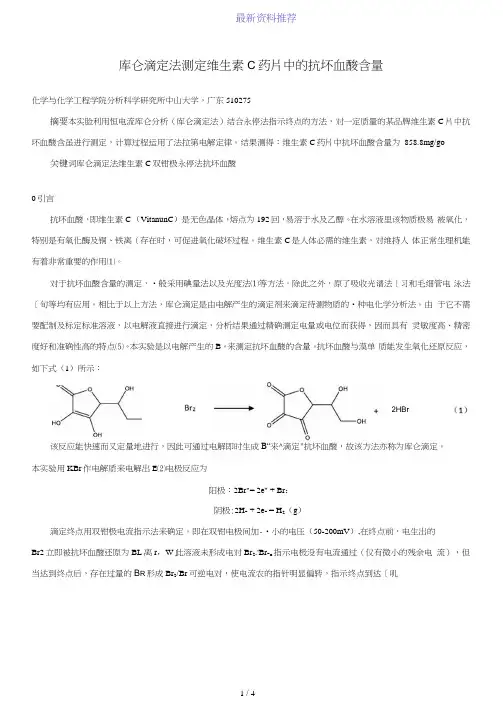
库仑滴定法测定维生素C药片中的抗坏血酸含量化学与化学工程学院分析科学研究所中山大学,广东510275摘要本实脸利用恒电流库仑分析(库仑滴定法)结合永停法指示终点的方法,对一定质量的某品牌维生素C 片中抗坏血酸含虽进行测定,计算过程运用了法拉第电解定律。
结果测得:维生素C药片中抗坏血酸含量为858.8mg/go 关键词库仑滴定法维生素C双钳极永停法抗坏血酸0引言抗坏血酸,即维生素C (VitanunC)是无色晶体,熔点为192回,易溶于水及乙醇。
在水溶液里该物质极易被氧化,特别是有氧化酶及铜、铁离(存在时,可促进氧化破坏过程。
维生素C是人体必需的维生素,对维持人体正常生理机能有着非常重要的作用⑴。
对于抗坏血酸含量的测定,•般采用碘量法以及光度法⑴等方法。
除此之外,原了吸收光谱法[习和毛细管电泳法〔旬等均有应用。
相比于以上方法,库仑滴定是由电解产生的滴定剂来滴定待测物质的•种电化学分析法。
由于它不需要配制及标定标准溶液,以电解液直接进行滴定,分析结果通过精确测定电量或电位而获得,因而具有灵敏度高、精密度好和准确性高的特点⑸。
本实验是以电解产生的B。
来测定抗坏血酸的含量。
抗坏血酸与漠单质能发生氧化还原反应,如下式(1)所示:2HBr该反应能快速而又定量地进行,因此可通过电解即时生成B“来^滴定"抗坏血酸,故该方法亦称为库仑滴定。
本实验用KBr作电解质来电解出E⑵电极反应为阳极:2Br"= 2e" + Br:阴极:2H- + 2e- = H2(g)滴定终点用双钳极电流指示法来确定。
即在双钳电极间加-•小的电压(50-200mV),在终点前,电生出的Br2立即被抗坏血酸还原为BL离r,W此溶液未形成电对Br2.'Br-o指示电极没有电流通过(仅有微小的残余电流),但当达到终点后,存在过量的B R形成Br2/Br可逆电对,使电流农的指针明显偏转,指示终点到达〔叽电解系统指示终点系统5 -15mA 50 ・200niV钳匚作电极电磁搅拌器图1采用电流法指示终点的库仑滴定装置定量计算根据法拉第电解定律来计算,有m = Qx^ (2)上式中,m-被滴定抗坏血酸的质量(mg); Q-电极反应所消耗的电量(本仪器所示电量为mC): W抗坏血酸的分了量(176.1): F- Faraday (法拉第)常数,其值为96485 C mol1: n・电极反应的电子转移数(2e )o1实验部分1.1仪器和试剂仪器:(1) KLT-1型通用库仑仪(江苏电分析仪器厂):(2)搅拌器;(3)超声波淸洗器;(4)移液枪(量程上限为1000M L):(5)电解池装置:双钳极工作电极和双钳极指示电极。

维生素c测定实验报告维生素 C 测定实验报告一、实验目的本次实验旨在准确测定样品中维生素 C 的含量,了解和掌握维生素C 测定的基本原理和实验方法。
二、实验原理维生素 C 又称抗坏血酸,具有较强的还原性。
本实验采用 2,6 二氯靛酚滴定法进行测定。
2,6 二氯靛酚是一种染料,在酸性溶液中呈红色,在中性或碱性溶液中呈蓝色。
其氧化型在酸性溶液中呈红色,可与维生素 C 发生氧化还原反应。
当维生素 C 全部被氧化后,稍过量的 2,6二氯靛酚会使溶液呈现红色,此时即为滴定终点。
通过滴定消耗的 2,6 二氯靛酚溶液的量,可以计算出样品中维生素 C 的含量。
三、实验材料与设备1、材料新鲜水果(如橙子、草莓等)、标准维生素 C 溶液。
2、试剂2%草酸溶液、0001mol/L 2,6 二氯靛酚溶液。
3、仪器电子天平、容量瓶、移液管、锥形瓶、酸式滴定管、玻璃棒、漏斗、滤纸。
四、实验步骤1、样品处理准确称取适量的新鲜水果,放入研钵中研磨成匀浆。
将匀浆转移至容量瓶中,用 2%草酸溶液定容至刻度,摇匀。
用漏斗过滤,收集滤液备用。
2、标准溶液的配制准确称取一定量的标准维生素 C 晶体,用 2%草酸溶液溶解并定容至一定体积,得到标准维生素 C 溶液。
3、滴定吸取一定量的样品滤液于锥形瓶中,加入2%草酸溶液至一定体积。
用 0001mol/L 2,6 二氯靛酚溶液进行滴定,边滴边摇动锥形瓶,直至溶液呈现淡红色,并保持 15 秒不褪色,即为滴定终点。
记录消耗的2,6 二氯靛酚溶液的体积。
同时进行空白实验,除不加样品滤液外,其他操作与样品滴定相同,记录空白实验消耗的 2,6 二氯靛酚溶液的体积。
五、实验数据处理1、计算 2,6 二氯靛酚溶液的实际浓度吸取标准维生素 C 溶液 1000mL 于锥形瓶中,加入 2%草酸溶液至50mL。
用 2,6 二氯靛酚溶液进行滴定,记录消耗的体积 V1(mL)。
2,6 二氯靛酚溶液的实际浓度(mol/L)=标准维生素 C 的浓度×1000÷V12、计算样品中维生素 C 的含量样品中维生素 C 的含量(mg/100g)=(V V0)×C×T×100÷W其中,V 为样品滴定消耗 2,6 二氯靛酚溶液的体积(mL);V0 为空白滴定消耗 2,6 二氯靛酚溶液的体积(mL);C 为 2,6 二氯靛酚溶液的实际浓度(mol/L);T 为 1mL 2,6 二氯靛酚溶液相当于维生素 C 的毫克数;W 为样品质量(g)。

维生素c的测定原理
维生素C是一种重要的水溶性维生素,也称作抗坏血酸。
维
生素C的测定方法有多种,其中常用的是间接滴定法和直接
滴定法。
间接滴定法基于维生素C与氧化剂间的反应。
在这个方法中,维生素C首先被氧化成二氧化碳和水,而氧化剂则被还原。
然后,剩余的氧化剂被一种指示剂检测,它会在氧化和还原之间发生颜色变化。
通过测量反应所需的氧化剂体积,可以确定维生素C的含量。
直接滴定法则是利用维生素C的还原性直接与含有已知浓度
氧化剂的溶液反应。
这个方法会产生电流,而该电流的大小与反应中维生素C消耗的数量成比例。
通过测量电流的强度,
可以得到维生素C的浓度。
无论是间接滴定法还是直接滴定法,都需要注意样品的制备和处理,以确保准确度和可重复性。
此外,选择适当的指示剂或电流计也很关键。
维生素C的测定方法广泛应用于食品、药
品和医学领域中,对于掌握维生素C的摄入量和相关疾病的
诊断具有重要意义。

维生素C片中抗坏血酸的测定摘要维生素C(又名抗坏血酸,分子式为C6H8O6)通常用于防治坏血病及各种慢性传染病的辅助治疗。
市售维生素C药片含淀粉等添加剂。
具有较强的还原性,在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。
即取一定量研磨好的样品,加入一定量冰醋酸和一定量新煮沸后冷却的蒸馏水,搅拌溶解。
而后,加入淀粉指示剂,立即用已知浓度的I2标准溶液进行滴定,直至溶液中的蓝色持续不褪为止。
根据消耗I2溶液的体积,算得维生素C片中抗坏血酸的含量。
关键词碘量法维生素C片抗坏血酸1.引言维生素C,分子式为C6H8 O6 , 是具有L系糖型的不饱和多羟基物,属于水溶性维生素。
是人类营养中最重要的维生素之一,它分布很广,植物的绿色部分及许多水果(如橘子、苹果、草莓、山楂等)、蔬菜(黄瓜、洋白菜、西红柿等)中的含量更为丰富。
它对物质代谢的调节具有重要的作用,缺少它时会产生坏血病。
近年来,发现它还有增强机体对肿瘤的抵抗力,并具有对化学致癌物的阻断作用。
维生素C(还原型)纯品为白色无臭结晶,熔点190~192℃,溶于水或乙醇中,不溶于油剂。
在水溶液中易被氧化,在碱性条件下易分解,在弱酸条件中较稳定,维生素C开始氧化为脱氢型抗坏血酸(有生理作用)。
如果进一步水解则生成2,3-二酮古乐糖酸,失去生理作用[5]。
维生素C具有很强的还原性。
它可分为还原性和脱氢型。
金属铜和酶(抗坏血酸氧化酶)可以催化维生素C氧化为脱氢型。
根据它具有还原性质可测定其金属含量。
经过查阅资料,总结出十种方法测定维生素C片中抗坏血酸的含量:1.1铁铵矾滴定法取一定量研磨好的维生素C片,溶解后,以磺基水杨酸为指示剂,用铁铵矾氧化直接滴定该样品中抗坏血酸的含量。
该法经济可靠,所用铁铵矾标准液无须标定,但因室温下铁(Ⅲ)直接氧化抗坏血酸的速度慢,需控制恒温约55℃。
[1]1.22,6-二氯酚靛酚滴定法取一定量研磨好的样品溶解后,用碱性2,6-二氯酚靛酚溶液滴定含有该样品的草酸溶液,当溶液由蓝色变为无色再变为红色时即为终点。
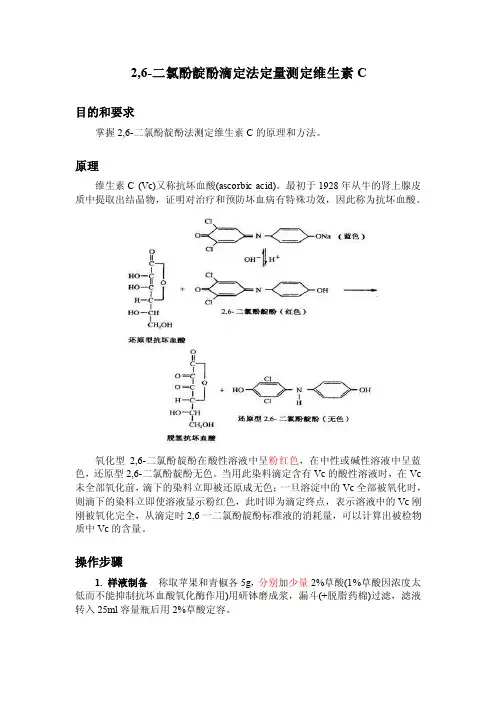
2,6-二氯酚靛酚滴定法定量测定维生素C目的和要求掌握2,6-二氯酚靛酚法测定维生素C的原理和方法。
原理维生素C (Vc)又称抗坏血酸(ascorbic acid)。
最初于1928年从牛的肾上腺皮质中提取出结晶物,证明对治疗和预防坏血病有特殊功效,因此称为抗坏血酸。
氧化型2,6-二氯酚靛酚在酸性溶液中呈粉红色,在中性或碱性溶液中呈蓝色,还原型2,6-二氯酚靛酚无色。
当用此染料滴定含有Vc的酸性溶液时,在Vc 未全部氧化前,滴下的染料立即被还原成无色;一旦溶淀中的Vc全部被氧化时,则滴下的染料立即使溶液显示粉红色,此时即为滴定终点,表示溶液中的Vc刚刚被氧化完全,从滴定时2,6一二氯酚靛酚标准液的消耗量,可以计算出被检物质中Vc的含量。
操作步骤1. 样液制备称取苹果和青椒各5g,分别加少量2%草酸(1%草酸因浓度太低而不能抑制抗坏血酸氧化酶作用)用研钵磨成浆,漏斗(+脱脂药棉)过滤,滤液转入25ml容量瓶后用2%草酸定容。
2. 标准液滴定准确吸取0.1mg/ml的标准抗坏血酸溶液各1.0ml,分置两个100ml锥形瓶中,加入1%草酸9.0ml,用微量滴定管以0.1%的2,6-二氯酚靛酚滴定至淡红色,并保持15s即为终点。
由所用染料的体积计算出T值(平均值),即1ml染料相当于多少mg的Vc。
3. 样液滴定准确吸取已制备的样品滤液各两份,每份10.0ml分别放入两个100ml锥形瓶内,滴定方法同前注意:1. 滴定过程宜迅速,一般不超过2min,因为样品中某些杂质亦能还原二氯酚靛酚,尽管其还原能力较弱且还原速度较Vc更慢。
2. 滴定所用染料宜控制于1~4ml,如果样品含Vc含量过高/低,可酌量增/减样液)。
3. 样品提取液应避免日光直射,否则会加速Vc氧化。
计算m=VT/m0×100式中m:100g样品中含Vc的质量(mg)V:滴定时所用去染料体积(ml)T:每毫升染料能氧化Vc质量数(mg/ml)m0:10ml样液相当于含样品之质量数(g)试剂和器材试剂1. 2%草酸溶液:草酸2g溶于100ml蒸馏水中。

一、实验目的1. 了解抗坏血酸的性质及其在食品中的分布情况。
2. 掌握抗坏血酸含量测定的原理和方法。
3. 通过实验,提高实验操作技能,培养严谨的科学态度。
二、实验原理抗坏血酸(维生素C)是一种水溶性维生素,具有抗氧化、促进生长发育、增强免疫力等生理功能。
本实验采用2,6-二氯靛酚滴定法测定抗坏血酸含量。
该法原理是:在酸性溶液中,2,6-二氯靛酚呈红色,能与还原型抗坏血酸发生氧化还原反应,使2,6-二氯靛酚还原成无色,根据反应消耗的2,6-二氯靛酚的量,可以计算出样品中抗坏血酸的含量。
三、实验材料与仪器1. 实验材料:新鲜水果(如橙子、苹果、香蕉等)、标准抗坏血酸溶液、2,6-二氯靛酚溶液、草酸溶液、蒸馏水等。
2. 实验仪器:电子分析天平、容量瓶、滴定管、锥形瓶、研钵、烧杯、漏斗等。
四、实验步骤1. 样品处理:将新鲜水果洗净,去皮去核,切成小块,用研钵研磨成浆状。
2. 样品提取:取适量研磨后的水果浆,加入适量的2,6-二氯靛酚溶液,混匀,静置10分钟。
3. 滴定:用标准抗坏血酸溶液滴定提取液,边滴定边振荡,直至溶液颜色由红色变为淡红色,记录滴定所用抗坏血酸溶液的体积。
4. 计算抗坏血酸含量:根据滴定所用抗坏血酸溶液的体积和浓度,计算出样品中抗坏血酸的含量。
五、实验结果与分析1. 实验结果以橙子为例,实验测得橙子中抗坏血酸含量为100mg/100g。
2. 结果分析本实验结果表明,橙子中含有较高的抗坏血酸,符合我国《食品安全国家标准食品中维生素C的测定》的规定。
六、实验讨论1. 影响抗坏血酸含量的因素(1)水果的品种和成熟度:不同品种的水果中抗坏血酸含量差异较大,成熟度较低的水果中抗坏血酸含量较高。
(2)储存条件:温度、湿度、光照等储存条件都会影响抗坏血酸的稳定性,导致含量降低。
(3)加工过程:加工过程中,抗坏血酸容易受到氧化,导致含量降低。
2. 提高抗坏血酸含量的措施(1)选择抗坏血酸含量较高的水果品种。
食品中抗坏血酸的测定实验报告食品中抗坏血酸的测定实验报告【导语】每天饮食中摄入足够的维生素C(抗坏血酸)对于维持人体健康至关重要。
然而,食品中抗坏血酸的含量并不总是能够被肉眼直接观察到,利用实验方法进行测量是一种可靠和准确的方式。
本文将介绍一种测定食品中抗坏血酸含量的实验方法,以及相关的结果和分析。
【目录】1. 引言1.1 抗坏血酸的重要性1.2 食品中抗坏血酸的测定方法2. 实验设计与方法2.1 实验材料和设备2.2 实验操作步骤3. 实验结果与讨论3.1 食品样品的抗坏血酸含量3.2 不同食品样品的对比分析4. 实验优化与改进4.1 提高实验准确性的措施4.2 更多食品样品的测定5. 结论5.1 对食品中抗坏血酸测定的重要性的总结5.2 实验结果及其对我们的意义【引言】1.1 抗坏血酸的重要性抗坏血酸是一种重要的维生素,对人体的健康发挥着重要的作用。
它具有抗氧化性质,有助于抑制产生自由基,减缓细胞衰老和组织损伤的速度。
抗坏血酸还能增强人体免疫力,帮助身体吸收铁元素,并促进胶原蛋白的合成。
每天合理摄入足够的抗坏血酸对于维持身体健康至关重要。
1.2 食品中抗坏血酸的测定方法食品中抗坏血酸的测定方法多种多样,其中较为常用的方法是滴定法和高效液相色谱法。
滴定法利用氧化还原指示剂对抗坏血酸进行滴定测量,而高效液相色谱法则通过将食品样品中的抗坏血酸分离出来,并利用色谱仪测量其浓度。
【实验设计与方法】2.1 实验材料和设备所需实验材料和设备有:- 食品样品(如橙子、柠檬等富含维生素C的水果)- 酸性溶液(例如1%硫酸)- 硫酸氨水溶液- 玻璃瓶- 滴定管- 定容瓶- 氧化还原指示剂2.2 实验操作步骤1. 准备食品样品:将食品样品切碎并榨汁,过滤得到无固体颗粒的液体样品。
2. 滴定测定:取一定量的食品样品溶液放入玻璃瓶中,加入适量的酸性溶液和氧化还原指示剂,用硫酸氨水溶液滴定至颜色从红色变为无色。
3. 计算抗坏血酸含量:根据滴定所需的硫酸氨水溶液体积,计算出食品样品中抗坏血酸的含量。
1. 掌握抗坏血酸含量的测定方法。
2. 了解抗坏血酸的性质及其在食品、药品中的应用。
3. 培养实验操作技能,提高分析问题、解决问题的能力。
二、实验原理抗坏血酸(维生素C)是一种水溶性维生素,具有抗氧化、增强免疫力等生理功能。
本实验采用2,6-二氯酚靛酚滴定法测定抗坏血酸含量。
该方法基于抗坏血酸具有还原性,可以将2,6-二氯酚靛酚还原成无色物质,从而通过滴定终点颜色变化来确定抗坏血酸的含量。
三、实验仪器与试剂1. 仪器:电子分析天平、滴定管、锥形瓶、研钵、漏斗、容量瓶、吸管等。
2. 试剂:2%草酸溶液、1%草酸溶液、标准抗坏血酸溶液、0.1%2,6-二氯酚靛酚溶液、待测样品等。
四、实验步骤1. 样品预处理:将待测样品进行研磨、过筛,准确称取一定量的样品,加入适量1%草酸溶液,搅拌均匀,提取抗坏血酸。
2. 标准溶液的配制:准确称取一定量的标准抗坏血酸,溶解于1%草酸溶液中,配制成一定浓度的标准溶液。
3. 滴定:将提取的抗坏血酸溶液置于锥形瓶中,加入适量的2,6-二氯酚靛酚溶液,搅拌均匀。
用标准抗坏血酸溶液进行滴定,直至溶液颜色由红色变为无色,记录滴定所用标准溶液的体积。
4. 计算抗坏血酸含量:根据滴定所用的标准溶液体积和浓度,计算待测样品中抗坏血酸的含量。
五、实验结果与分析1. 实验结果:根据实验数据,计算出待测样品中抗坏血酸的含量为X mg/g。
2. 分析:与国家标准或文献报道的抗坏血酸含量进行比较,分析实验结果的准确性。
1. 实验过程中可能存在的误差:样品预处理过程中可能存在抗坏血酸的损失;滴定过程中可能存在滴定终点判断不准确等。
2. 误差分析及改进措施:针对实验过程中可能存在的误差,提出相应的改进措施,以提高实验结果的准确性。
七、结论本实验采用2,6-二氯酚靛酚滴定法测定抗坏血酸含量,实验操作简便、准确。
通过实验,掌握了抗坏血酸含量的测定方法,提高了分析问题、解决问题的能力。
八、实验报告总结本次实验通过对抗坏血酸含量的测定,了解了抗坏血酸的性质及其在食品、药品中的应用。
库仑滴定法测定维生素C药片中的抗坏血酸含量钟天立,蒋志,董林懋(中山大学化学与化学工程学院,广州516000)摘要本文采用库伦滴定法测定维生素C药片中抗坏血酸的含量。
实验中以电解KBr产生的Br2作为滴定剂,用双铂指示电极电流法指示反应终点,测得该维生素C药片中的抗坏血酸含量为830.5mg/g,相对平均偏差0.69%。
实验表明,库伦滴定法具有设备简单、操作简便、分析速度快、高灵敏度和高精确度等优点,适用于快速测定样品中微量的抗坏血酸含量。
关键词库伦滴定法维生素C药片抗坏血酸1引言维生素C又名抗坏血酸,是维持人体健康的一种重要物质, 在人体内不能合成, 主要从膳食中获取。
抗坏血酸的纯品为白色无臭结晶,熔点在190~192℃,易溶于水,微溶于丙酮,在乙醇中溶解度更低,不溶于油剂。
结晶抗坏血酸在空气中稳定,但它在水溶液中易被空气和其他氧化剂氧化,生成脱氢抗坏血酸;在碱性条件下易分解,见光加速分解;在弱酸条件中较稳定。
[1]研究发现, 维生素C 在人体内作为辅酶的成分调节机体代谢, 减弱毛细血管脆性, 增加机体抵抗力; 维生素C 在人体内的协同作用可以提高人体对铁的吸收率, 促进外伤愈合。
另外, 在食品加工中维生素C常用作抗氧化剂、酸味剂等。
[2]维生素C在水果、蔬菜中含量较高,尤其是猕猴桃、柚子、番茄等。
因此抗坏血酸的定量分析在食品、医药等领域相当重要。
测量抗坏血酸含量的国标方法为直接碘量法。
此外,抗坏血酸含量的测定方法还有紫外分光光度法、荧光分光光度法、近红外分光光度法、伏安法和高效液相色谱法等。
[3]直接碘量法运用化学分析的手段,不适于微量抗坏血酸的测量;紫外-可见分光光度法需要配置标准系列溶液,操作较为繁琐;高效液相色谱法相对而言,具有高速、高灵敏度等优点,但仪器较为昂贵。
而电化学分析法仪器简单、分析速度快、具有较好的灵敏度与准确度。
库仑滴定法是通过电解产生滴定剂来滴定待测样品的一种电化学分析法。
抗坏血酸的试验方法、检验规则(一)本标准等效采纳国际标准ISO 6353-3 : 1987《化学分析试剂—第3部分:规格—第2批》中R70“抗坏血酸”。
本试剂为白色结晶或结晶性粉末,易溶于水,不溶于苯和,水溶液显酸性反应,为强还原剂。
分子式:C6H8O6 结构式:相对分子质量:176.13(按1991年国际相对原子质量) 1 主题内容与适用范围本标准规定了化学试剂的技术要求、实验办法、检验规章和包装及标记。
本标准适用于化学试剂抗坏血酸的检验。
2 引用标准 GB/T 601 化学试剂滴定分析(容量分析)用标准溶液的制备 GB/T 602 化学试剂杂质测定用标准溶液的制备 GB/T 603 化学试剂实验办法中所用制剂及制品的制备 GB/T 613 化学试剂比旋光度测定通用办法 GB/T 619 化学试剂采样及验收规章 GB/T 6682 分析试验室用水规格和实验办法 GB/T 9728 化学试剂测定通用办法GB/T 9729 化学试剂氯化物测定通用办法 GB/T 9735 化学试剂重金属测定通用办法 GB/T 9739 化学试剂铁测定通用办法 GB/T 9741 化学试剂灼烧残渣测定通用办法 HG 3-119 化学试剂包装及标记HG/T 3-1168 化学试剂澄清度标准的制备及测定办法(玻璃乳浊球法) 3 技术要求 3.1 抗坏血酸(C6H8O6)含量:不少于99.7%。
3.2 比旋光度〔a〕D20:+20.5o~+21.5o。
3.3 杂质最高含量: 4 实验办法本实验办法中标准滴定溶液、杂质标准溶液、制剂及制品,除另有规定外,均按GB/T 601、GB/T 602、GB/T 603之规定制备。
试验用水应符合GB/T 6682中三级水规格。
4.1 抗坏血酸(C6H8O6)含量测定称取0.3g样品,精确至0.0001g,溶于80 mL水中,加2 mL溶液(20%),摇匀,立刻用碘标准滴定溶液〔c(1/2I2)=0.1 mol/L〕滴定,近尽头时,加3 mL淀粉指示液(10g/L),继续滴定至溶液显蓝色,保持30 s。
一. 目的
掌握滴定法测定Vc含量的基本原理和操作。
二. 原理
L-抗坏血酸(Vc)中的—C=C—基具有还原性,还原型L-抗坏血酸能与氧化剂染料2,6-二氯酚靛酚作用,染料本身被还原成无色的衍生物,同时还原态的L-抗坏血酸被氧化成无色的脱氢L-抗坏血酸。
一定量的样品提取液还原标准染料的量与样品中所含Vc的量成正比。
染料2,6-二氯酚靛酚在中性或碱性溶液中呈蓝色,在酸性溶液中呈粉红色。
用2,6-二氯酚靛酚滴定样品,在达到终点之前,滴下的2,6-二氯酚靛酚立即被还原成无色;当溶液中的L-抗坏血酸被消耗完时,滴下的过量的2,6-二氯酚靛酚在酸性体系里呈现粉红色。
所以当溶液从无色转变成微红色时,即为滴定终点。
三. 实验材料及设备
1. 材料
新鲜蔬菜
2. 仪器
电子天平
3. 器材
滴定管:25mL×1
移液管:10mL×2 20mL×1
容量瓶:100mL×1
量筒:50mL×1
锥形瓶:100mL×4
研钵:1套
烧杯:250mL×2 50mL×1
洗瓶:1个
纱布:20cm×20cm 1块
四. 试剂的配制
1. 草酸溶液(2%)
每组配制250mL
2. 2,6-二氯酚靛酚溶液
分别称取2,6-二氯酚靛酚300mg、碳酸钠300mg,用热蒸馏水200mL溶解并定容至3000mL(过滤除去难溶颗粒,置于棕色瓶中,贮于冰箱中备用。
有效期一周,使用前需标定,见附注。
)
五. 操作步骤
1. 样品液的制备
(1) 取材:称取新鲜黄瓜10g左右,准确记录称样量g,再称量2.5g草酸,与样品一起用纱布包裹住。
(2) 研磨:样品包置研钵中,加15mL2%草酸,用研棒挤压样包,将样品充分磨细。
将汁液转移到100mL容量瓶中。
残渣再加15mL2%草酸,继续研磨,汁液再合并到上述容量瓶中。
如此反复研磨2~3次,合并汁液。
(3) 定容:最后用2%草酸定容至V=100mL,摇匀备用。
2. 样品的测定
吸取汁液20mL,放入100mL锥形瓶中,立即用2,6-二氯酚靛酚溶液滴定至出现粉红色在15秒内不消失为止。
记录所用滴定液体积。
平行操作三次得V1= mL,V2= mL,V3= mL,取平均值V= mL。
3. 空白测定
取2%的草酸液20mL,放入另一100mL锥形瓶内,用2,6-二氯酚靛酚滴定至终点,记录染料用量V0。
六. 结果处理
计算你所取生物材料中Vc的含量(单位用mg/100g鲜重)。
七. 附注
2,6-二氯酚靛酚钠溶液的标定:
准确称取Vc 20mg,用2%草酸溶解定容至1000mL。
吸取稀释液20mL,放入100mL锥形瓶中,立即用所要标定的2,6-二氯酚靛酚滴定至粉红色出现15秒不消失为止,记录所用毫升数,按下式计算K值(即1mL染料所能氧化抗坏血酸的毫克数)。
式中G:称取Vc的毫克数
V:滴定20mL标准Vc时所用染料液的毫升数与滴定空白所用毫升数之差值。
1. 操作要尽可能快,并防止与铁铜器具接触,以减少维生素C的氧化。
2. 草酸及样品的提取液避免日光直射。
3. 当样液本身带色时,测定前于提取液中加2~3mL二氯乙烷。
在滴定过程中当二氯乙烷由无色变为粉红色时,即达终点。
总酸量(可滴定酸)的测定-酸度计法
SB/T 10203-1994
中华人民共和国行业标准 SB/T 10203-1994
果汁-总酸量(可滴定酸)的测定-酸度计法
1 范围
本方法适用于原果汁、浓缩果汁和加糖果汁中总酸量(可滴定酸)的检测。
2 原理
果汁中的有机酸,用氢氧化钠标准溶液滴定,以酸度计测定终点,用消耗的氢氧化钠标准溶液的体积计算总酸量。
3 试剂
3.1 所用水应用经煮沸除去CO2 的蒸馏水;
3.2 氢氧化钠标准溶液(0.1mol/L):用感量0.1g的天平,迅速称取分析纯氢化钠4g,溶于蒸馏水中稀释到1000ml,摇匀;
4.3 氢氧化钠标准溶液的标定:精确称取120℃烘2h以上的基准试剂邻苯二甲酸氢钾(KHC8H4O4)0.3~0.4g(精确至0.0001g),放入250mL锥形瓶中加蒸馏水约100mL溶解,加入1%酚酞指示剂2~3滴。
用以上配制好的氢氧化钠溶液滴定,至显微红色30s不退色为终点。
记录消耗氢氧化钠溶液的毫升数,平行试验3~5 次,取平均值。
同样条件下取100mL蒸馏水作空白试验。
记录消耗氢氧化钠的毫升数;。