滴定分析法定义及几个基本术语(精)
- 格式:ppt
- 大小:366.00 KB
- 文档页数:28


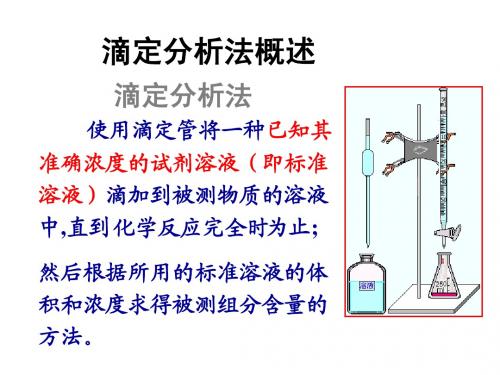
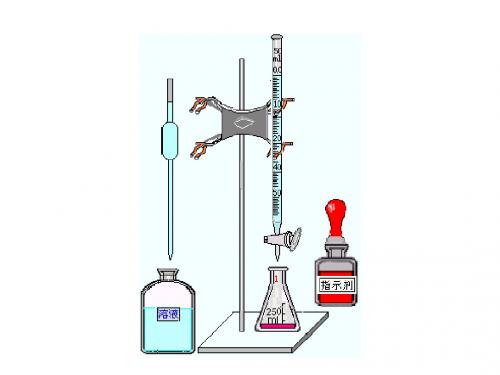
化学滴定基础知识滴定分析法,是一种简便、快速和应用广泛的定量分析方法,是化学分析法的一种,将一种已知其准确浓度的试剂溶液(称为标准溶液)滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测组分的含量,这种方法称为滴定分析法(或称容量分析法)。
一.滴定分析概述(一)滴定分析的优点1. 操作简单;2. 对仪器要求不高;3. 有足够高的准确度误差不高于0.2%;4. 方便,快捷;5. 便于普及与推广。
(二)滴定分析相关术语1. 又称容量分析,它是根据已知准确浓度的溶液(标准溶液)和被测物质完全作用时所消耗的体积计算被测物质含量的方法;2. 滴定:滴定标准溶液的过程;3. 化学计量点(等当点):滴加的标准溶液与待测组分恰好反应完全的这一点,又称滴定终点;4. 滴定终点:依据指示剂的颜色变化确定的等当点;5. 滴定误差:滴定终点与等当点之间存在的误差。
(三)滴定分析的基本条件1. 反应完全:反应必须按方程式定量地完成,通常要求在99.9%以上,不得有副反应,这是定量计算的基础;2. 反应要迅速:必要时需加热或加入催化剂;3. 必须有确定的等当点:要选用合适的指示剂;4. 共存物质不干扰主要反应,或用适当的方法消除其干扰。
(四)滴定分析类型(根据反应的类型可分为四类)1. 酸碱滴定法:建立在酸碱反应基础上的滴定分析方法,本质是酸碱之间的质子传递。
例如:滴定反应,H++OH-→H2O;2. 沉淀滴定法:建立在沉淀反应基础上的滴定分析方法,根据确定终点的方法不同,可分为摩尔法、佛尔哈德法、吸附指示剂法。
例如:银量法:Ag++Cl-→ AgCl↓;3. 配位滴定法:建立在配位反应基础上的滴定分析方法,在配位滴定中,除主反应外,还有各种副反应干扰主反应的进行,反应条件对配伍平衡有很大的影响。
例如,EDTA滴定法:Mn2++H2Y2-→MnY+2H+4. 氧化还原滴定法:建立在氧化还原反应基础上的滴定分析方法,以电子转移为依据,反应条件对平衡有较大影响。