催化作用第八章—几个典型的催化氧化反应实例
- 格式:pptx
- 大小:4.55 MB
- 文档页数:22

催化反应催化反应(1)催化过程安全概述催化反应是在催化剂的作用下所进行的化学反应。
例如由氮和氢合成氨、由二氧化硫和氧合成三氧化硫、由乙烯和氧合成环氧乙烷等都属于催化反应。
在化学反应中能改变反应速度而本身的组成和质量在反应后保持不变的物质,叫做催化剂。
加快反应速度的叫做正催化剂,减慢的称做负催化剂或缓化剂。
通常所说的催化剂是指正催化剂。
常用的催化剂主要有金属、金属氧化物和无机酸等。
在接触作用中的催化剂有时又称触媒或接触剂。
催化剂一般具有选择性,能改变某一个或某一类型反应的速度。
对有些反应,可以使用不同的几种催化剂。
在选择催化剂时,主要有以下几种类型:①生产过程中产生水汽的,一般采用具有碱性、中性或酸性反应的盐类,无水盐类、三氯化铝、三氯化铁、三氧化磷及二氧化镁等。
②反应过程中产生硫化氢的,-般采用盐基、卤素、碳酸盐、氧化物等。
③反应过程中产生氯化氢的,一般采用碱、吡啶、哇啉、金属、三氯化铝、三氯化铁等。
④反应过程中产生氢气的,应采用氧化剂、空气、高锰酸钾、氧化物及过氧化物等。
催化反应有单相反应和多相反应两种。
单相反应是在气态下或液态下进行的,危险性较小,因为在这种情况下,反应过程中的温度、压力及其他条件较易调节。
在多相反应中,催化作用发生于分相界上,多数发生于固定催化剂的表面上,这时要控制温度、压力就不容易。
从安全角度来看,催化过程中应该注意正确选择催化剂,保证散热良好,不使催化剂过量,局部反应激烈,严格控制温度。
如果催化反应过程能够连续进行,自动调节温度,就可以减少其危险性。
在催化反应中产生氯化氢时,有腐蚀和中毒危险。
产生硫化氢时,中毒危险更大,同时硫化氢在空气中的爆炸极限是4.3%~45.5%,所以生产过程又有爆炸危险。
在产生氢气的反应中,由于氢气的爆炸极限是4%~75%,尤其在高压下,氢气的爆炸危险增大,同时还有极大的腐蚀作用,使金属的高压容器脆化,造成事故。
在催化反应中,当原料气中某种能和催化剂发生反应的杂质含量增加时,可能会生成爆炸性危险物,这是非常危险的。
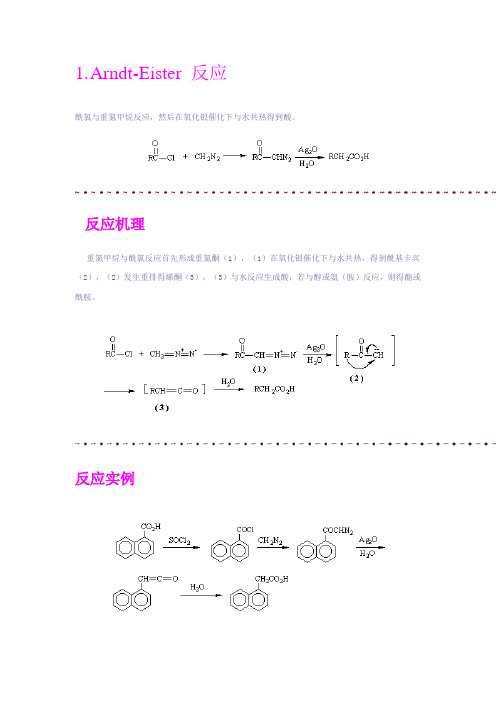
1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。




第八章光催化技术第一节多相光催化技术人们使用“多相光催化”这一术语描述在有光参与的情况下,发生在催化剂及其表面吸附物(如H2O、O2分子和被分解物等) 多相之间的一种光化学反应。
多相光催化的研究起源于1972年,日本 Fujishima和 Honda[1]在Nature杂志上报道,发现在光辐射的TiO2半导体电极和金属电极所组成的电池中,可持续发生水的氧化还原反应,产生H2。
这一发现非常有意义,表明通过半导体电极,可把光能转化为化学能。
从那时起,来自化学、物理、材料等领域的许多科学家们围绕太阳能的转化和储存、光化学合成,进行大量的研究,探索该过程的原理,致力提高光催化效率[2,3,4,5]。
Fujishima和Honda的研究工作引起了人们对半导体在光作用下能否用于污染控制的兴趣,而半导体光电化学的研究结果为开展这一工作奠定了基础。
从七十年代初期以来,国外许多学者竞相开展这方面的研究。
1976年,J. H. Cary[6]报道了TiO2水浊液在近紫外光的照射下可使多氯联苯脱氯,注意到TiO2水体系在光照条件下可非选择性氧化(降解)各类有机物,并使之彻底矿化,生成CO2和H2O。
同年S. N. Frank等研究了多晶电极/氙灯作用下对二苯酚、I-、Br-、Cl-、Fe2+、Ce3+和CN-的光解[7]和用粉末来催化光解水中污染物取得了满意的结果[8]。
S. N. Frank等[9]在1977年又用TiO2、ZnO、CdS、Fe2O3、WO3等多种催化剂在氙灯作光源情况下,对CN-和SO32-进行光解研究,结果TiO2、ZnO、CdS 能有效催化氧化CN-为CNO-;TiO2、ZnO、CdS和Fe2O3能有效催化氧化SO32-为SO42-,其反应速度均大于3.1×10-6 mol / (d·cm2)。
八十年代中期开始,我国学者也开展了半导体光催化的研究。
各国环境科学工作者在这一领域进行了广泛而深入的探索,取得了许多可喜的成绩,并在环保方面得到了应用。









催化反应过程例子
在催化剂作用下进行的化学反应称为催化反应。
化学反应中,反应分子原有的某些化学键,必须解离并形成新的化学键,这需要一定的活化能。
在某些难以发生化学反应的体系中,加入有助于反应分子化学键重排的第三种物质(催化剂)其作用可降低反应的活化能,因而能加速化学反应和控制产物的选择性及立体规整性。
【例子】
(1)工业合成氨:工业制硝酸的第一步:N2+ 3H2= 2NH3(催化剂\高温\高压),
(2)氨的催化氧化:4NH3+5O2= 4NO + 6H2O(催化剂\加热)
(3)工业制硫酸的第二步:SO2的催化氧化2SO2+O2 = 2SO3(催化剂V2O5\加热)
(4)还有你的肝脏天天分泌过氧化氢酶催化能力是氯化铁的千倍;口水里有大量的淀粉酶,超快加速分解淀粉转换成麦芽糖;你的胃里有胃蛋白酶,可以把蛋白质分解成氨基酸。