必修1氧化还原反应
- 格式:ppt
- 大小:1.52 MB
- 文档页数:38



高一化学必修一知识点:氧化还原反应(人教版)【导语】以下是作者为大家推荐的有关高一化学必修一知识点:氧化还原反应(人教版),如果觉得很不错,欢迎分享~感谢你的浏览与支持!一、概念判定:1、氧化还原反应的实质:有电子的转移(得失)2、氧化还原反应的特点:有化合价的升降(判定是否氧化还原反应)3、氧化剂具有氧化性(得电子的能力),在氧化还原反应中得电子,产生还原反应,被还原,生成还原产物。
4、还原剂具有还原性(失电子的能力),在氧化还原反应中失电子,产生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化(由阳离子变单质),也可能被还原(由阴离子变单质)。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性(不一定是价态,,如:Fe2+),阴离子不一定只有还原性(不一定是态,如:SO32-)。
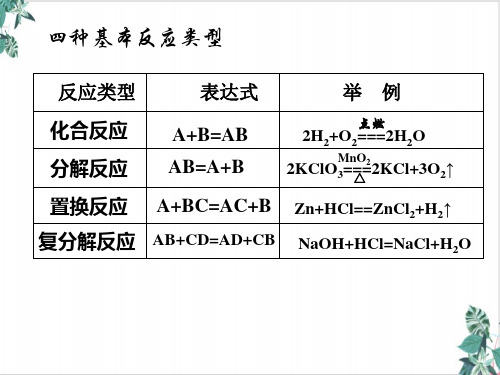
9、常见的氧化剂和还原剂:10、氧化还原反应与四大反应类型的关系:【同步练习题】1.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。
下列说法不正确的是()A.该反应中还原剂是S2O32-B.H2O参与该反应,且作氧化剂C.根据该反应可判定氧化性:Cl2>SO42-D.上述反应中,每生成lmolSO42-,可脱去2molCl2答案:B点拨:该反应方程式为:S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+,该反应中氧化剂是Cl2,还原剂是S2O32-,H2O参与反应,但既不是氧化剂也不是还原剂,故选B。
2.(2011•河南开封高三一模)分析以下残缺的反应:RO3-+________+6H+===3R2↑+3H2O。
下列叙述正确的是()A.R一定是周期表中的第ⅤA族元素B.R的原子半径在同周期元素原子中最小C.上式中缺项所填物质在反应中作氧化剂D.RO3-中的R元素在所有的反应中只能被还原答案:B点拨:RO3-中R为+5价,周期表中ⅤA、ⅦA元素均可形成RO3-离子,A毛病;据元素守恒,反应中只有R、H、O三种元素,则缺项一定为R-,且配平方程式为RO3-+5R-+6H+===3R2↑+3H2O,据此可得R为ⅦA元素,B正确;R-中R处于态,只能作还原剂,C毛病;RO3-中R元素处于中间价态,在反应中既可被氧化又可被还原,D项错。


第三节氧化还原反应知识点一、氧化还原反应【思考与交流】请列举几个氧化反应和还原反应的实例,讨论并交流这类反应的分类标准。
【答案】①3Fe + 2O2点燃Fe3O4;②S + O2点燃SO2;③2H2 + O2点燃2H2O ;④C+2CuO 高温2Cu + CO2↑。
这类反应的4类标准为得氧为氧化反应,失氧为还原反应。
【思考与交流】氧化反应和还原反应为什么一定是同时发生的?【答案】以H2 + CuO △Cu+ H2O为例,既有CuO失去氧发生还原反应,又有H2得到氧发生氧化反应。
因此氧化反应与还原反应是同时进行的。
全面认识氧化还原反应(1)从得、失氧的角度认识氧化还原反应初中根据反应中物质是否得到氧或失去氧,将化学反应分为氧化反应和还原反应。
反应类型得氧失氧的情况举例氧化反应物质得到氧的反应还原反应物质失去氧的反应氧化反应和还原反应是同时发生的,我们把这样的反应称为氧化还原反应。
【特别提醒】氧化反应和还原反应一定是同时发生的。
因为任何化学反应都遵循质量守恒定律,即原子个数守恒,有物质得到氧,就必然有物质失去氧,所以在同一个反应中,既有氧化反应,又有还原反应。
(2)从化合价升、降的角度认识氧化还原反应在氧化还原反应中,某些元素的化合价在反应前后发生了变化。
如在一氧化碳还原氧化铜的反应中碳元素化合价升高,发生氧化反应;铜元素化合价降低,发生还原反应。
由此可知,元素化合价升高的反应是氧化反应;元素化合价降低的反应是还原反应。
在上述反应中,铁元素化合价升高,发生氧化反应;铜元素化合价降低,发生还原反应。
此反应中并没有氧的得失,但也属于氧化还原反应。
【总结】①凡是有元素化合价升降的化学反应,都是氧化还原反应。
氧化还原反应不一定有氧得失。
②若无元素化合价升降,就是非氧化还原反应。
【注意】①在氧化还原反应中,并不是所有的元素化合价都发生改变,故不一定所有的元素都发生氧化还原反应。
②并非只有得氧、失氧的反应才是氧化还原反应。