必修1氧化还原反应1
- 格式:ppt
- 大小:1.06 MB
- 文档页数:19





高中化学必修1《氧化还原反应》优秀教案(最新3篇)(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作总结、计划大全、策划方案、报告大全、心得体会、演讲致辞、条据文书、作文大全、教案资料、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, this store provides various types of classic sample essays for everyone, such as work summaries, plan summaries, planning plans, report summaries, insights, speeches, written documents, essay summaries, lesson plan materials, and other sample essays. If you want to learn about different formats and writing methods of sample essays, please stay tuned!高中化学必修1《氧化还原反应》优秀教案(最新3篇)作为一名默默奉献的教育工作者,编写教案是必不可少的,教案是教学活动的依据,有着重要的地位。


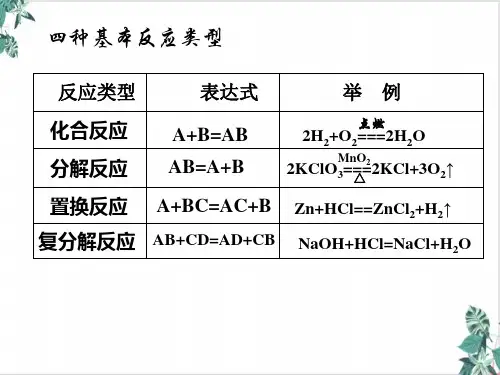
第一章 物质及其变化 第一节 氧化还原反应 第1讲 氧化还原反应概念及表示【讲】知识点1多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应氧化反应:物质得到氧的反应叫做氧化反应,如:S + O 2SO 2 C + O 2CO 2还原反应:物质失去氧的反应叫做还原反应,如:2CuO +C=====高温2Cu +CO 2↑对于反应2CuO +C=====高温2Cu +CO 2↑:(1)氧化铜失去氧,发生还原反应,被碳还原,铜单质是 还原 产物,氧化铜是 氧化 剂。
(2)碳得到氧,发生氧化反应,被氧化铜氧化,二氧化碳是 氧化 产物,碳是 还原 剂。
失去氧的物质,发生还原反应,被还原,对应产物是还原产物,本身是氧化剂。
得到氧的物质,发生氧化反应,被氧化,对应产物是氧化产物,本身是还原剂。
氧化还原反应:一种物质得到氧发生氧化反应,同时另一种物质失去氧发生还原反应的反应。
2.从元素化合价升降的角度认识氧化还原反应(特征) (1)对于有氧元素参加的反应,分析化合价变化2CuO +C=====高温2Cu +CO 2↑ CuO +H 2=====△Cu +H 2O Fe 2O 3+3CO=====高温2Fe+3CO 2①碳化合价 升高 ,碳 得 氧,碳发生 氧化 反应,碳被氧化铜 氧化 ,二氧化碳是 氧化 产物,碳是 还原剂 剂。
②)氧化铜化合价 降低 ,氧化铜 失 氧,氧化铜发生 还原 反应,氧化铜被碳 还原 ,铜单质是 还原 产物,氧化铜是 氧化剂 剂。
化合价降低的物质,发生还原反应,被还原,对应产物是还原产物,本身是氧化剂。
化合价升高的物质,发生氧化反应,被氧化,对应产物是氧化产物,本身是还原剂。
氧化还原反应:凡是有元素 变化 的反应(2)对于无氧元素参加的反应Fe +CuSO 4=====△Cu +FeSO 4:①铁元素元素化合价 升高 ,铁单质发生 氧化 反应,铁单质被 氧化 ,FeSO 4是 氧点燃点燃化产物 ,铁单质是 还原剂 剂。

高一化学必修一氧化还原反应知识点总结在化学方程式中标出组成元素的化合价,只要有一种元素的化合价发生了变化,即说明该反应是氧化还原反应。
今天小编在这给大家整理了高一化学必修一,接下来随着小编一起来看看吧!高一化学必修一氧化还原反应知识点(一)氧化还原反应(1)氧化还原反应的本质:有电子转移(包括电子的得失或偏移)。
(2)氧化还原反应的特征:有元素化合价升降。
(3)判断氧化还原反应的依据:凡是有元素化合价升降或有电子的转移的化学反应都属于氧化还原反应。
(4)氧化还原反应相关概念:还原剂(具有还原性):失(失电子)→升(化合价升高)→氧(被氧化或发生氧化反应)→生成氧化产物。
氧化剂(具有氧化性):得(得电子)→降(化合价降低)→还(被还原或发生还原反应)→生成还原产物。
【注】一定要熟记以上内容,以便能正确判断出一个氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物;氧化剂、还原剂在反应物中找;氧化产物和还原产物在生成物中找。
同一周期从左到右,电子层数相同,原子核电荷数逐渐增加,原子核对最外层电子引力逐渐增强,原子半径逐渐减小。
得电子能力逐渐增强,元素的非金属性逐渐增强,对应单质的氧化性逐渐增强;失电子能力逐渐减弱,元素的金属性逐渐减弱,对应单质的还原性逐渐减弱。
同一主族从上到下,最外层电子数相同,原子层数逐渐增加,原子核对最外层电子引力逐渐减弱,原子半径逐渐增大。
得电子能力逐渐减弱,元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱;失电子能力逐渐增强,元素的金属性逐渐增强,对应单质的还原性逐渐增强。
2.氧化性还原性与金属活动性的关系金属活动性越强,对应单质的还原性越强,对应离子的氧化性越弱。
3.氧化还原反应规律在一个反应中:氧化剂的氧化性大于氧化产物的氧化性。
还原剂的还原性大于还原产物的还原性。
若含有多种氧化剂(还原剂),氧化性(还原性)强的物质优先参与反应。
高一化学必修一氧化还原反应知识点(二)氧化还原反应的七个重要知识点氧化还原反应基本概念的相互联系要点一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。