浙江省杭州二中2014届高三下学期第五次月考化学试卷(解析版)
- 格式:doc
- 大小:472.71 KB
- 文档页数:18

杭州二中2014学年第一学期高三第二次月考化学试考生须知:1.本试卷分试题卷和答题卷,满分100分,考试时间100分钟。
2.所有答案分别答在答题卡和答题卷上。
可能用到的原子量:Fe-56 Cu-64 Na-23 N-14 O-16 H-1 S-32【试卷综析】本试卷是高三第二次月考化学试题,在考查学生的基础知识的同时注重学生的综合能力的培养。
本试卷综合性较强,难度较大,题量较多。
本试卷考查到了化学与生活、阿伏伽德罗常数的应用、元素化合物中以金属和硝酸的知识为主、溶液中的离子反应和离子方程式的书写、氧化还原反应原理的应用、化学反应中的综合计算、化学实验的综合运用等主干知识,考查了较多的知识点。
在注重考查学科核心知识的同时,突出考查考纲要求的基本能力,重视对学生科学素养的考查。
以基础知识和基本技能为载体,以能力测试为主导,注重常见化学方法的使用,应用化学思想解决化学问题,体现了化学学科的基本要求。
第Ⅰ卷(选择题共55分)一、选择题(每小题只有一个选项符合题意,其中1-20每题2分,21-25每题3分)【题文】1.化学在生产和日常生活中有着重要的作用。
下列有关说法正确的是A.二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白B.氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油D.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的【知识点】化学与生产、生活的联系D3 H4 D4【答案解析】C解析:.A、二氧化硫有漂白性,但是不用做食品的漂白,错误;B.PM2.5微粒不是胶体,不具有丁达尔效应,错误;C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油,正确;D.汽车尾气污染物中含有氮的氧化物是吸进汽缸的氮气与氧气发生反应形成的,错误。
【思路点拨】本题考查了二氧化硫的漂白性的应用、常见胶体、地沟油的废物利用、汽车尾气的形成,主要考查到了一些物质的性质的应用,难度不大。
浙江省杭州二中2014届高三第五次(3月)月考文科综合试卷本试卷分选择题和非选择题两部分,满分300分,考试用时150分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的校名、姓名、考号填写在答题卡的密封线内。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在另发的答题卷各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液.不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷和答题卡一并收回。
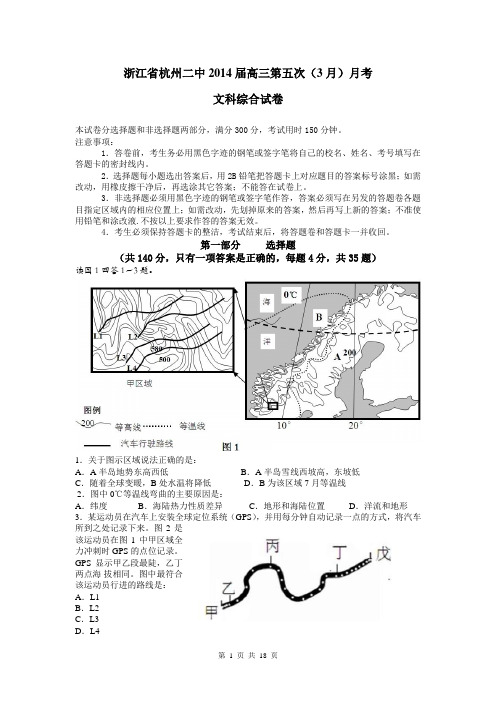
第一部分选择题(共140分,只有一项答案是正确的,每题4分,共35题)读图1回答1~3题。
1.关于图示区域说法正确的是:A.A半岛地势东高西低B.A半岛雪线西坡高,东坡低C.随着全球变暖,B处水温将降低D.B为该区域7月等温线2.图中0℃等温线弯曲的主要原因是:A.纬度B.海陆热力性质差异C.地形和海陆位置D.洋流和地形3.某运动员在汽车上安装全球定位系统(GPS),并用每分钟自动记录一点的方式,将汽车所到之处记录下来。
图2是该运动员在图1中甲区域全力冲刺时 GPS的点位记录。
GPS显示甲乙段最陡,乙丁两点海拔相同。
图中最符合该运动员行进的路线是:A.L1B.L2C.L3D.L4下图是雪线(终年积雪下限),高山寒漠土、林线(山地森林分布的最高界线)和对流层高度随纬度的变化曲线,读图2回答4~5题。
4.图中与林线高度对应的曲线是: A .① B .② C .③ D .④5.与图中高山寒漠土随纬度分布规律基本相似的是:A .气温随纬度的分布规律B .雪线随纬度的分布规律C .海水蒸发量随纬度的分布规律D .昼夜长短年变化幅度随纬度的分规律下图示意我国部分地区日均气温稳定通过≥10.0℃初期和终期等值线的分布。

杭州二中2022学年第二学期高三年级第一次月考语文试卷一、现代文阅读(35分)(一)现代文阅读I(本题共5小题,17分)阅读下面的文字,完成1-5题。
材料一:中华传统文化崇尚以和为贵,重视人际和善、邻里和谐、家庭和睦,这些理念深深影响着中国人的思想和行为,也影响着国家和社会治理方式。
在中华传统法律文化中,“无讼”是一个重要理念。
对于息事避讼,我国古代许多思想家表达过类似的理想态度。
孔子说:“听讼,吾犹人也,必也使无讼乎!”这体现了儒家在国家和社会治理中尚“和”的主张。
道家表达了谦和不争、不争而善胜的处世态度。
法家虽然主张严刑重罚,但究其根本是希望通过法令滋彰来定分止争,并不希望天下纷扰不断。
古代社会所倡导的“无讼”理念,并不是主张杜绝纷争以及解决纷争的诉讼,而是提倡努力减少纷争,并尽可能用不通过官方正式诉讼的方式解决纷争。
在我国古代,有大量体现“无讼”的具体实践。
比如,在民间倡导每个人自觉守规矩,遇争谦让、息事避讼,也就是说,即便遇到争议,也通过谦抑退让平息纷争,尽量避免诉讼。
再如,强调官吏公正裁判,以达到减少诉讼的目的。
对于必须付诸诉讼的纷争,通过公正裁断、明辨是非、晓谕百姓,尽快协调好利益关系,为百姓做好示范,从而减少类似诉讼发生。
还有一种重要方式是民间调处,即不通过诉讼来解决纠纷。
我国古代有较为丰富的民间纠纷调处方式,比如,明朝颁布的《教民榜文》规定:“民间户婚、田土、斗殴、相争一切小事,不许辄便告官,务要经由本管里甲、老人理断。
”“无讼”理念及司法实践对我国古代治理产生了较大影响。
社会对“无讼”目标的追求,使得礼让谦和的道德观念备受推崇,而睚眦必报则受到贬责,“以和为贵”的价值取向更加深入人心。
着眼“无讼”目标,历代统治者在施行教化的同时,采取多种措施对诉讼加以抑制。
一方面,从制度上对提起诉讼的主体、时间、事由、形式、前置程序等予以限定,以此减少诉讼发生。
另一方面,遏制滥讼,制裁和打击恶意兴讼、教唆诉讼的讼师、“讼棍”。

浙江省杭州市西湖高级中学2014届高三9月月考化学试题可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 Al:27 Fe:56 Cu:64第Ⅰ卷(选择题,共44分)一、选择题:(本题包括22小题,每小题2分,共44分,每小题只有一个选项符合题意).1.“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。
如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是 A .能全部通过半透膜 B .能发生丁达尔现象C .一定能导电D .一定为悬浊液或乳浊液2.设N A 为阿伏加德罗常数,下列有关叙述正确的是A.1 mol Cl 2与足量金属铝反应,转移的电子数为3N AB.标准状况下,11.2 L 氦气中约含有N A 个氦原子C.将N A 个NH 3分子溶于1 L 水中得到1 mol·L -1的氨水D.常温下32 g 含有少量臭氧的氧气中,共含有2 N A 个氧原子(氧的相对原子质量:16)3.列叙述正确的是 A .强电解质都是离子化合物,因此NaCl 是离子化合物B .醋酸溶液的导电能力可能比稀硫酸强C .SO 3溶于水,其水溶液能导电,SO 3是电解质D .硫磺是单质,不导电,因此硫磺是非电解质4.同主族两种元素原子序数的差值不可能为A .16 B.26 C.36 D.465.经氯气消毒的自来水,若用于配制以下溶液:①NaOH ②AgNO 3③Na 2CO 3 ④FeSO 4 ⑤KI ⑥Na 2S ⑦Na 2SO 3,会使配制的溶液变质的是A.全部B.②④⑤⑥⑦C.①②⑤D.④⑥6.下列说法正确的是 A .IA 族元素的金属性比IIA 族元素的金属性强B .VIA 族元素的氢化物中,稳定性最好的其沸点也最高C .同周期非金属氧化物对应的水化物的酸性从左到右依次增强D .第三周期元素的离子半径从左到右逐渐减小7.下列氧化还原反应中,水作为氧化剂的是A .CO +H 2O(g)=====高温CO 2+H 2B .3NO 2+H 2O===2HNO 3+NOC.2Na2O2+2H2O===4NaOH+O2↑ D.2F2+2H2O===4HF+O28.下列离子方程式正确的是A.过量铁片加入稀硝酸中: 3Fe +2NO3- + 8H+ = 3Fe2++ 2NO↑ + 4H2OB.向小苏打溶液中加入醋酸:HCO3-+ H+=CO2↑+H2OC.向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2OD.向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO4 2-= BaSO4↓9.下列说法正确的是 A.可以用澄清石灰水鉴别SO2和CO2B.硫粉在过量的纯氧中燃烧可以生成SO3C.SO2能使碘的淀粉溶液、酸性KMnO4溶液褪色D.少量SO2通过浓的CaCl2溶液能生成白色沉淀10.某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):分析表中数据,下列说法不正确的是(标况)A.由①、②可知:①中的固体不足而完全反应B.由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全C.由①可以计算出盐酸的物质的量浓度D.由①可以计算出混合物的NaHCO3的质量分数11.已知下列氧化还原反应:2BrO3-+Cl2==Br2+2ClO3-,5Cl2+I2+6H2O==2IO3-+10Cl-+12H+,ClO3-+5Cl-+6H+==3Cl2↑+3H2O。

2013学年杭州二中高三年级第五次月考数学试卷(文科)本试题卷分选择题和非选择题两部分。
满分150分, 考试时间120分钟。
选择题部分(共50分)注意事项:1.答题前,考生务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔分别填写在试卷和答题纸规定的位置上。
2.每小题选出答案后,用2B 铅笔把答题纸上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
不能答在试题卷上。
参考公式: 球的表面积公式S =4πR 2球的体积公式V =43πR 3其中R 表示球的半径 锥体的体积公式V =13Sh其中S 表示锥体的底面积, h 表示锥体的高柱体的体积公式V=Sh其中S 表示柱体的底面积, h 表示柱体的高 台体的体积公式()1213V h S S =其中S 1, S 2分别表示台体的上、下底面积h 表示台体的高如果事件A , B 互斥, 那么P (A +B )=P (A )+P (B )一、选择题:本大题共10小题,每小题5分,共50分.在每小题给出的四个选项中,只有一项是符合题目要求的.1.设全集U =R ,{(3)0}A x x x =+<,{1}B x x =<-,则图中阴影部分表示的集合为( )A .(3,1)--B .(1,0)-C .[1,0)-D .(,1)-∞- 2.复数23m ii -+(i 为虚数单位)为纯虚数,则实数m 的值为( ) A.13 B.12 C.35 D.323. 已知q 是等比数列{}n a 的公比,则“1q <”是“数列{}n a 是递减数列”的( )条件A. 充分不必要B. 必要不充分C. 充要D. 既不充分也不必要 4.若关于直线,m n 与平面,αβ,有下列四个命题:①若//m α, //n β,且//αβ,则//m n ;②若m α⊥, n β⊥,且αβ⊥,则m n ⊥; ③若m α⊥,//n β,且//αβ,则m n ⊥;④若//m α,n β⊥,且αβ⊥,则//m n ; 其中真命题的序号( )A .①②B .③④C .②③D .①④5.如图,定义某种运算a S b =⊗,运算原理如右图所示,则式子1lg 251(2tan )ln 1043e π-⎛⎫⊗+⊗ ⎪⎝⎭的值为( ) A .11 B .13 C .8 D .4 6.已知焦点在x 轴上的椭圆的离心率为21,它的长轴长等于圆222150x y x +--=的半径,则椭圆的标准方程是( )A .1121622=+y x B. 1422=+y x C. 141622=+y x D.13422=+y x 7.将函数sin(2)3y x π=+的图像平移后所得的图像对应的函数为cos 2y x =,则进行的平移是( ) A .向右平移12π个单位 B. 向左平移12π个单位 C. 向右平移6π个单位 D. 向左平移6π个单位 8.已知一个棱长为2的正方体,被一个平面截后所得几何体的三视图如图所示,则该几何体的体积是( )A .8B .203C .173 D .1439.设x ,y ∈R ,且满足33(2)2sin(2)2,(2)2sin(2)6,x x x y y y ⎧-++-=⎪⎨-++-=⎪⎩则x y +=( )A .1 B.2 C.3 D.410.函数是函数的导函数,且函数在点处的切线为,如果函数在区间上的图象如图所示,且,那么( )A .是的极大值点B .=是的极小值'()y f x =()y f x =()y f x =00(,())P x f x 000:()'()()(),()()()l y g x f x x x f x F x f x g x ==-+=-()y f x =[,]a b 0a x b <<00'()0,F x x x ==()F x 0'()F x 00,x x =()F x点C .不是极值点D .是极值点非选择题部分 (共100分)二、填空题:本大题共7小题,每小题4分,共28分.11.若一组样本数据2,3,7, 8,a 的平均数为5,则该组数据的方差2s = .12.设实数,x y 满足不等式组120x y y x y +≤⎧⎪-≤⎨⎪≥⎩,则目标函数2z x y =-的最小值为 .13.设等差数列}{n a 的前n 项和为S n ,3,0,211==-=+-m m m S S S ,则正整数m 的值为_____________.14.从集合{}2,1,1A =--中随机选取一个数记为k ,从集合{}1,1,3B =-中随机选取一个数记为b ,则直线y kx b =+不.经过第四象限的概率为 . 15.已知正实数,x y 满足24xy x y ++=,则x y +的最小值为 . 16.过双曲线)0,0(12222>>=-b a b y a x 上任意一点P ,作与实轴平行的直线,交两渐近线M 、N 两点,若22b PN PM =⋅,则该双曲线的离心率为 .17.在平面直角坐标系中,O 是坐标原点,若两定点,A B2=⋅==,则点集{}|,2,,P OP OA OB R λμλμλμ=++≤∈所表示的区域的面积是 .三、解答题:本大题共5小题,共72分.解答应写出文字说明、证明过程或演算步骤. 18.在ABC ∆中,角A 、B 、C 所对应的边为a 、b 、c . (1)若cos 2cos 3A A π⎛⎫-=⎪⎝⎭,求A 的值; (2)若1cos 3A =,且ABC ∆的面积2S =,求C sin 的值. 19. 已知数列{}n a 满足135a =,1321n n n a a a +=+,n N *∈.(1)求证:数列11n a ⎧⎫-⎨⎬⎩⎭为等比数列;(2)是否存在互不相等的正整数m 、s 、t ,使m 、s 、t 成等差数列,且1m a -、1s a -、00'()0,F x x x ≠=()F x 00'()0,F x x x ≠=()F x1t a - 成等比数列?如果存在,求出所有符合条件的m 、s 、t ;如果不存在,请说明理由.20.如图,四棱锥P ABCD -的底面ABCD 为矩形,且1PA AD ==,2AB =,120PAB ∠= ,90PBC ∠= , (1)求证:平面PAD 与平面PAB 垂直;(2)求直线PC 与平面ABCD 所成角的正弦值. 21.定义函数()ln k ka xf x x =为()f x 的k 阶函数. (1)当1a =时,求一阶函数()1f x 的单调区间; (2)讨论方程()21f x =的解的个数; (3)求证:33ln e x x ≤.22.已知抛物线()220x py p =>上纵坐标为2的点到焦点的距离为3.(1)求p 的值;(2)若A ,B 两点在抛物线上,满足0AM BM +=,其中()2,2M .则抛物线上是否存在异于A , B 的点C ,使得经过A 、B 、C 三点的圆和抛物线在点C 处有相同的切线?若存在,求出点C 的坐标;若不存在,说明理由.2013学年高三年级第五次月考数学文科答案ADDCB DBCDB 11.265 12. 72- 13. 5 14. 29 15.3 16. 2617. 316 18.(1)由cos 2cos 3A A π⎛⎫-= ⎪⎝⎭,得cos cos sin sin 2cos 33A A A ππ+=,1cos 2cos 2A A A ∴+=3cos A A =,tan A ∴=, 0A π<< ,3A π∴=;(2)1cos 3A =,02A π∴<<,sin 3A ∴==,由21sin 2S bc A ===,得3b c =,由余弦定理得:22222222cos 928a b c bc A c c c c =+-=+-=,a ∴=, 由正弦定理得:sin sin a cA C =,即sin sin c A C =,1sin 3C ∴==. 19.(1)因为1321n n n a a a +=+,所以111233n n a a +=+. 所以1111113n n a a +⎛⎫-=- ⎪⎝⎭. 因为135a =,则11213a -=.所以数列11n a ⎧⎫-⎨⎬⎩⎭是首项为32,公比为31的等比数列;(2)由(1)知,112121333n n n a -⎛⎫-=⨯= ⎪⎝⎭,所以332nn n a =+. 假设存在互不相等的正整数m 、s 、t 满足条件,则有()()()22111s m t m t sa a a +=⎧⎪⎨-=--⎪⎩, 由332n n n a =+与()()()2111s m t a a a -=--,得2333111323232sm t sm t ⎛⎫⎛⎫⎛⎫-=-- ⎪ ⎪⎪+++⎝⎭⎝⎭⎝⎭.即232323343m tm t s s ++⨯+⨯=+⨯.因为2m t s +=,所以3323mts+=⨯.因为3323mts +≥=⨯,当且仅当m t =时等号成立,这与m 、s 、t 互不相等矛盾.所以不存在互不相等的正整数m 、s 、t 满足条件. 20.(Ⅰ)平面PAD ⊥平面PAB ∵090PBC ∠= ∴BC PB ⊥∵四棱锥P ABCD -的底面ABCD 为矩形 ∴BC AB ⊥∵PB ⊂平面PAB ,AB ⊂平面PAB ,且PB ∩AB B = ∴BC ⊥平面PAB (4分) ∵AD ∥BC ∴AD ⊥平面PAB ∵AD ⊂平面PAD平面PAD ⊥平面PAB (6分)(Ⅱ)如图,过点P 作BA 延长线的垂线PH ,垂足为H ,连接CH . 由(Ⅰ)可知AD ⊥平面PAB ∵AD ⊂平面ABCD∴平面PAB ⊥平面ABCD∵PH ⊂平面PAB ,平面PAB ⊥平面ABCD , 平面PAB ∩平面ABCD =AB ∴PH ⊥平面ABCD∴CH 为PC 在平面ABCD 内的射影.∴PCH ∠为PC 与底面ABCD 所成的角. (9分)00120,60PAB PAH ∠=∴∠= ,1PA = ,∴在直角三角形PAH 中,001sin 60cos602PH PA AH PA =⨯==⨯= 在直角三角形HBC 中,152,122BH AH AB BC AD =+=+===故2CH ==在直角三角形PHC 中,PC ==sin 8PH PCH PC ∴∠==故直线PC 与平面ABCD 所成角的正弦值8. (12分) 21.(1)1ln ()(0)a x f x x x =>,122ln (1ln )()(0)a a x a x f x x x x --'==> 令1()0f x '=,当0a ≠时,.x e = ∴当0a =时,1()f x 无单调区间;当0a >时,1()f x 的单增区间为(0,),e 单减区间为(,)e +∞.当0a <时,1()f x 的单增区间为(,)e +∞,单减区间为(0,)e . 4分. (2)由2ln 1,a x x =当0a =时,方程无解.当0a ≠时,2ln 1.x x a =令2ln ()(0).x g x x x =>则432ln 12ln ().x x x xg x x x--'==由()0g x '=得x从而()g x 在单调递增,在)+∞单调递减.max 1().2g x g e==当0x →时,()g x →-∞,当x →+∞()0.g x →∴当1102a e <<,即2a e >时,方程有两个不同解. 当112a e >,即02a e <<时,方程有0个解 当112a e =,10a<或即2a e =或0a <时,方程有唯一解. 综上,当2a e >时,方程有两个不同解.当02a e <<时,方程有0个解.当2a e =或0a <时,方程有唯一解. 9分. (3)特别地,当1a =时由33ln ()(0)xf x x x=>得223643ln 13ln ()x x x x f x x x --'==. 由3()0f x '=得13,x e =则3()f x 在13(0,)e 单调递增,在13(,)e +∞单调递减.133max 31()().3f x f e e==∴33ln 1(),3x f x x e=≤即33ln x x e ≤.22.(1)22x py =;(2)(i )设A ,B 两点的坐标为1122()()A x y B x y ,,,,且12x x <,∵AM BM +=0,可得M 为AB 的中点,即124x x +=.显然直线AB 与x 轴不垂直,设直线AB 的方程为2(2)y k x -=-,即22y kx k =+-,将22y kx k =+-代入22x py =中,得224(1)0x pkx k p -+-=. 2分∴2212416(1)0,2 4.p k k p x x pk ⎧∆=-->⎨+==⎩ ∴1p >. 故p 的取值范围为(1),+∞. (ii )当2p =时,由(i )求得A ,B 的坐标分别为()()0044A B ,,,假设抛物线24L x y :=上存在点24t C t ⎛⎫, ⎪⎝⎭(0t ≠且4t ≠),使得经过A 、B 、C 三点的圆和抛物线L 在点C 处有相同的切线.设圆的圆心坐标为N (,)a b ,∵,.NA NB NA NC ⎧=⎪⎨=⎪⎩∴== 即34,142.8a b a tb t t +=⎧⎪⎨+=+⎪⎩ 解得224,8432.8t ta t tb ⎧+=-⎪⎪⎨++⎪=⎪⎩∵抛物线L 在点C 处切线的斜率为|2x t tk y ='==,而0t ≠,且该切线与NC 垂直, ∴2412t b t a t -⋅=--.即312204a bt t t +--=. 将248t t a +=-,24328t t b ++=代入上式,得32280t t t --=.即(4)(2)0t t t -+=.∵0t ≠且4t ≠,∴2t =-. 故满足题设的点C 存在,其坐标为()2,1-.。

7.下列说法正确的是A .拉瓦锡发现质量守恒定律、卢瑟福发现电子、波尔提出氢原子模型都对化学学科的发展作出了重要贡献B .实验室制备少量氢氧化铝可用下列方法:往AlCl 3溶液中加入稍过量的氨水,抽滤,得到胶状沉淀经洗涤、晾干C .核磁共振、红外光谱、紫外光谱和质谱仪,均可用于分析有机物的结构D .维生素、PLA 、油脂、甲壳素、硝化纤维都是高分子化合物8.下列叙述正确的是A .将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色B .将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色C .如右图,一段时间后给烧杯内的溶液中加入黄色的K 3[Fe(CN)6]溶液,可看到Fe 电极附近有蓝色沉淀生成D .向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解9.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,X 原子核外最外层电子数是次外层的2倍,Y 的氟化物YF 3分子中各原子均达到8电子稳定结构,Z 是同周期中原子半径最大的元素,W 的最高正价为+7价。
下列说法正确的是A .XH 4的沸点比YH 3的高B .X 与W 形成的化合物和Z 与W 形成的化合物的化学键类型相同C .Y 离子的半径比Z 离子的半径小D .元素W 的最高价氧化物对应水化物的酸性比Y 的强10.下列有关说法正确的是A.由—CH 3、、—OH 、—COOH 四种原子团两两组合形成的有机物中,属于弱电解质的有4种 B.向含有溶液中分别加入少量NaOH 固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降C.有机物X 、Y 、M 的转化关系为淀粉→X→Y――→M 乙酸乙酯,X 可用新制的氢氧化铜检验,现象为蓝色沉淀变成绛蓝色沉淀,加热后生成砖红色沉淀D.高分子化合物,其链节为对苯二甲酸和乙二醇11.一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为 6 mol·L-1KOH 溶液,下列说法中正确的是A .放电时K +移向负极 B .放电时电池负极的电极反应为H 2-2e -===2H +C .放电时电池正极的电极反应为NiO(OH)+H 2O +e -===Ni(OH)2+OH -D .该电池充电时将碳电极与电源的正极相连12.下列说法正确的是A.常温下,某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7 B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大D.0.2 mol·L-1 NH4NO3和0.l mol·L-1 NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)13.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、SO32-、MnO4-、Fe3+、NH4+、H+、SO42-、CO32-、AlO2-。
杭州二中2013学年高三年级第五次月考数学试卷注意事项:考试时间:120分钟;满分:150分。
本场考试不得使用计算器,请考生用水笔或钢笔将所有试题的答案填写在答题纸上,答在试卷上的无效。
一、选择题:本大题共10小题,每小题5分,共50分.在每小题给出的四个选项中,只有一项符合题目要求. 1设全集U 是实数集R ,{}{}2|4,|ln(2)0M x x N x x =≥=+≥,则N M C U ⋂)(=( )A.{}|12x x -≤<B.{}|2x x <C.{}|12x x -<<D.{}|2x x ≤2.复平面内,复数201420132ii z +=,则复数z 的共轭复数对应的点在(A.第一象限B.第二象限C.第三象限D.第四象限3.若程序框图如图所示,则该程序运行后输出k 的值是( ) A.4 B.5 C.6 D.74.在38(1)(1)x x -+的展开式中,含2x 项的系数是n ,若nn n x a x a x a a nx +⋅⋅⋅+++=-2210)8(,则=+⋅⋅⋅++n a a a a 210( ) A.0 B.1 C.-1 D.715 5.α为平面,,m n 是两条不同直线,则//m n 的一个充分条件是( ) A.//m α且//n α B.,m n 与平面α所成的角相等 C.m α⊥且n α⊥D.,m n 与平面α的距离相等6.设P 是不等式组⎪⎩⎪⎨⎧≤+-≥-≥≥310,0y x y x y x 表示的平面区域内的任意一点,向量)1,1(=→m ,)1,2(=→n ,若→→→+=n m OP μλ(μλ,为实数),则μλ-的最大值为( )A.4B.3C.-1D.-27.已知三个不全相等的实数q p m ,,成等比数列,则可能成等差数列的是( )A.q p m ,,B.222q p m ,,C.333q p m ,, D.q p m ,,8.若关于x 的不等式2|3|2<++a x x 至少有一个正数解,则实数a 的取值范围是( )第11题A.)32,32(-B.)43,32(-C.)43,43(-D. )32,43(- 9.若三棱锥BCD A -的侧面ABC 内一动点P 到底面BCD 的距离与到棱AB 的距离相等, 则动点P 的轨迹与三角形ABC 组成图形可能是( )A. B. C. D.10.21,F F 双曲线是12222=-by a x 的左右焦点,若在右支上存在点A 使得点2F 到直线1AF 的距离为a 2,则离心率e 的取值范围是( )A.)2,1(B.]2,1(C.),2(+∞D.),2[+∞二、填空题:本大题共7小题,每小题4分,共28分.11.已知正四面体的俯视图如图所示,其中四边形ABCD 是边长 为2的正方形,则这个正四面体的体积为 . 12.设]2,2[ππ-∈x ,)cos(cos x A =令,)sin(sin x B =,则 B A ,的大小关系为 .13. 在等差数列{n a }中,01>a ,10a ·11a <0,若此数列的前10项和10S =36,前18项和 18S =12,则数列|}{|n a 的前18项和为_____________.14.某人参加一档综艺节目,需依次闯关回答8道题,若回答正确,就获得一定的“家庭梦想基金”且可选择拿着“家庭梦想基金”离开或继续答题(假设离开和继续答题的可能性 相等);若回答错误,则此前积累的基金清零,且他离开此节目。
浙江省杭州市重点中学2014届下学期高三年级第二次月考化学试卷,有答案可能用到的相对原子质量: H-1,C-12,N-14,O-16,S-32,Cl-35.5,Na-23,Mg-24,Al-27,Ca-40,Ba-137卷I (40分)选择题:(每小题只有1个选项符合题意。
每题2分,共40分) 1. 从化学角度分析,下列叙述不正确的是A .化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志B .铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等C .明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的净化D .高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障。
但低空的臭氧是污染气体,会给人体造成伤害2.分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是 A .根据纯净物的元素组成,将纯净物分为单质和化合物 B .根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 C .根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体D .根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 3.下列有关化学用语表示正确的是 A .二氧化硅的分子式:SiO 2B .质子数为53,中子数为78的碘原子:I13153 C .甲基的电子式: D .邻羟基苯甲酸的结构简式:4.用N A 表示阿伏加德罗常数,下列说法正确的是 A .0.1 mol 的D 37Cl 分子中的中子数是2N A B .46g 乙醇所含的羟基的电子数是7N AC .2.3gNa 与足量O 2反应,生成Na 2O 和Na 2O 2的混合物,钠共失去0.1N A 个电子D .18g 葡萄糖分子中含有共用电子对数为2.2N A5. X 、Y 、Z 、M 、W 为五种短周期元素。
X 、Y 、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为15,X 与Z 可形成XZ 2分子;Y 与M 形成的气态化合物在标准状况下的密度为0.76g/L ;W 的质子数是X 、Y 、Z 、M 四种元素质子数之和的1/2。
浙江省2014年高考模拟考试理综化学试卷2本卷满分100分考试时间50分钟可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 K 39 Fe 56 S 32第Ⅰ卷(42分)本大题包含7小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.下列说法正确的是A.科恩和渡普尔因理论化学方面的贡献获得化学界最高成就诺贝尔化学奖,标志着化学已成为以理论研究为主的学科B.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重。
因此由PM2.5引起的雾霾一定属于气溶胶C.对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油。
D.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,以提高空气质量;推广可利用太阳能、风能等新能源,发展低碳经济,同时能大大减少对环境的污染8.下列说法不正确的是A.将水杨酸、乙酸酐和浓硫酸在锥形瓶中混合后,85-90℃水浴加热5-10min,取出锥形瓶,置于冰水浴中,使阿司匹林结晶析出,为了使其结晶完全需要向锥形瓶中继续加适量的水。
B.用移液管取液后,将移液管稍倾斜放入锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管C.相同条件下,10mL 0.1mol/LFeCl2溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色由浅绿色变成黄色,10mL 0.1mol/LKI溶液中滴入1mL 0.1mol/L NaNO2溶液,溶液颜色无变化,说明溶液的pH会影响NO2-的氧化性D.为了检验火柴头中的硫元素,先用刀片削下几根火柴的火柴头,放入一支中号试管中,先用酒精灯加热该试管底部引燃“火药”,然后塞上橡皮塞待用。
9. X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。
2019—2020学年度浙江省杭州二中高三化学月考试题高中化学可能用到的相对原子质量: H-1 C-12 N-14 P-31 O-16 S-32 F-19 Cl-35.5 Br-80I-127 Na-23 K-39 Mg-24 Al-27 Ca-40 Fe-56 Cu-64第一卷〔选择题 54分〕一、选择题〔每题只有一个正确答案,每题3分,共18题,54分〕1.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。
以下表达不正确的选项是.......〔〕A.该元素属于第七周期B.该元素位于III A族C.该元素为金属元素,性质与82Pb相似D.该同位素原子含有114个电子和184个中子2.以下物质中,属于含有极性键的离子晶体是〔〕A.CH3COOH B.Na2O2C.NaOH D.MgCl23.以下离子反应方程式错误的选项是......〔〕A.过量的硫化氢通入NaOH溶液 H2S+OH—=HS—+H2OB.向Ba〔OH〕2溶液中逐滴加入硫酸氢钠溶液至中性2H++SO42-+Ba2++2OH—=BaSO4↓+2H2OC.向100mL 0.1mol/L 的FeBr2溶液中通入0.025mol的Cl22Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl—D.碳酸氢镁溶液中加入过量石灰水Mg2++2HCO3—+Ca2++2OH—=CaCO3↓+MgCO3↓+2H2O4.等质量的两份锌粉a、b,分不加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,以下图表示产生H2的体积〔V〕与时刻〔t〕的关系,其中正确的选项是〔〕5.在一定温度下的刚性密闭容器中,当以下哪些物理量不再发生变化时,讲明下述反应:A〔s〕+2B〔g〕 C 〔g〕+D〔g〕已达到平稳状态的是〔〕①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,⑤混合气体的平均相对分子质量,⑥v〔C〕与v〔D〕的比值A.②③⑤B.①②③C.②③④⑥D.①③④⑤6.在一绝热..容器中,饱和石灰水中存在平稳:Ca〔OH〕2〔s〕Ca2++2OH—,现向其中加入少量生石灰,那么以下讲法错误的选项是......〔〕A.析出固体的质量增加B.溶液中Ca2+的浓度减小C.溶液中OH—数目减少D.溶液的pH值不变7.以下讲法正确的选项是〔〕A.有些物质是由分子直截了当构成,如二氧化碳、二氧化硫等;有些物质是由原子直截了当构成,如金刚石、重晶石等;有些物质是由离子直截了当构成的,如食盐、纯碱等B.分子是保持物质性质的一种微粒,也是化学变化中的最小微粒C.N2O5、N2O3、NO2不差不多上酸性氧化物;Na2O、Na2O2、Al2O3不差不多上碱性氧化物D.H2O 是一种专门稳固的化合物,这是由于氢键所致8.在水电离出的c〔H+〕=10—13 mol/L的溶液中,一定不能大量共存的离子组是〔〕A.K+、Fe3+、Cl-、NO3-B. Ba2+、Na+、Cl-、NO3-C. Al3+、NH4+、SO42-、Cl-D. Na+、K+、HCO3-、SO42-9.在实验室中,不慎被玻璃划破了手指,可用FeCl3溶液应急止血,其要紧缘故可能是〔〕A.FeCl3具有杀菌消毒作用B.FeCl3能使血液胶体凝聚C.产生Fe〔OH〕3沉淀堵住伤口D.FeCl3能使血液发生化学变化10.将10mL0.20mol/L的HCl溶液和10mL0.11mol/L的Ba〔OH〕2溶液混合,再用水稀释至2L后,取出10mL,滴入甲基橙试剂,那么溶液显示的颜色是〔〕A.蓝色B.红色C.橙色D.黄色11.甲酸和乙酸差不多上弱酸,当它们的浓度均为0.1mol/L时,甲酸中的c〔H+〕约为乙酸中c〔H+〕的3倍。
浙江省杭州二中2014届高三下学期第五次月考化学试卷一、选择题(共7小题,每小题6分,满分42分)1.(6分)(2014秋•苍南县校级期中)联合国确定2014年“世界水日”的宣传主题是“水与能源”(Water and Energy).水利部确定2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.下列说法正确的是()4.(6分)(2014秋•苍南县校级期中)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法不正确的是()5.(6分)(2014春•上城区校级月考)霉酚酸是一种生物活性化合物.下列有关霉酚酸的说法正确的是()7.(6分)(2014春•上城区校级月考)近年来科学家们发现由100个碳原子构成具有完美对称性的C100分子,最内部是由20个碳原子构成的正12面体,外层的60个碳原子形成12个独立的正五边形,处于中间层次的20个碳原子将内外层碳原子连接在一起,当C100与足量氢气完全反应时,每个碳原子形成四个共价单键,其产物的分子式应为()二、解答题(共4小题,满分60分)8.(15分)(2009秋•盐城期末)汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主要有Hg2+、Hg22+.(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X 溶液溶解锌片回收汞,X溶液可以是(填试剂名称).(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为:.(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究Hg﹣I﹣H2O系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I﹣+4H+=2+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:.(4)国家制定的工业废水排放标准:汞的含量≤0.05mg/L.某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放.已知:25℃HgS的K sp=4×10﹣52;Hg2S的K sp=1.0×10﹣47,FeS的K sp=6.3×10﹣18;HgS+Na2S⇌Na2HgS2(易溶).①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放(选填:“能”或“不能”)②加入FeSO4溶液的作用是.9.(15分)(2009秋•盐城期末)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:(1)铁在元素周期表中位于周期族.(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:(选用右图中的a、b、c、d填空).(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是.(a)其它条件不变,增加高炉的高度(b)调节还原时的炉温(c)增加原料中焦炭与赤铁矿的比例(d)将生成的铁水及时移出反应④△H4=kJ•mol.(5)1100℃时,FeO(s)+CO(g)⇌Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:.10.(15分)(2009秋•盐城期末)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ).制三氯化铬的流程如下:(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因,如何用简单方法判断其已洗涤干净.(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是.(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性.正确的顺序为:⑥→③→.(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为.(5)样品中三氯化铬质量分数的测定称取样品0.3300g,加水溶解并定容于250mL容量瓶中.移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.已知:Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2═Na2S4O6+2NaI.①该实验可选用的指示剂名称为.w ww.k s5u.co m②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是.③样品中无水三氯化铬的质量分数为.11.(15分)(2009秋•盐城期末)吲哚昔酚(idoxifene)可用于治疗骨质疏松症,它的合成路线如下:(1)反应类型:B→C;D→E.(2)D中含氧官能团有:(写名称).(3)满足下列三个条件的A的同分异构体数目有种.①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六员环,G结构简式为:.(5)2,2﹣二甲基戊酸[]是有机合成中间体,请设计合理的方案以丙酮()为唯一有机原料合成2,2﹣二甲基戊酸(用合成路线流程图表示,并注明反应条件).提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;③合成路线流程图示例如下:CH3CH2OH H2C=CH2.2013-2014学年浙江省杭州二中高三(下)第五次月考化学试卷参考答案与试题解析一、选择题(共7小题,每小题6分,满分42分)1.(6分)(2014秋•苍南县校级期中)联合国确定2014年“世界水日”的宣传主题是“水与能源”(Water and Energy).水利部确定2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为3.(6分)(2012•太原一模)X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原4.(6分)(2014秋•苍南县校级期中)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法不正确的是()5.(6分)(2014春•上城区校级月考)霉酚酸是一种生物活性化合物.下列有关霉酚酸的说法正确的是()7.(6分)(2014春•上城区校级月考)近年来科学家们发现由100个碳原子构成具有完美对称性的C100分子,最内部是由20个碳原子构成的正12面体,外层的60个碳原子形成12个独立的正五边形,处于中间层次的20个碳原子将内外层碳原子连接在一起,当C100与足量氢气完全二、解答题(共4小题,满分60分)8.(15分)(2009秋•盐城期末)汞不溶于水,易挥发,易与许多金属形成合金,汞是对人体危害较大的一种金属,据统计世界上有80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们的重视,水体中的无机汞主要有Hg2+、Hg22+.(1)实验时倘若不慎,将汞溅落地面时,可先用涂上X溶液的锌片去粘拾,然后再用足量的X 溶液溶解锌片回收汞,X溶液可以是盐酸或稀硫酸(填试剂名称).(2)检测水体中的Hg2+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为:2Cu2++Hg2++6I﹣=Cu2HgI4+I2.(3)冶金厂治理含汞、含硫的烟气并回收汞,中国冶金工作者在研究Hg﹣I﹣H2O系热力学的基础上,查明KI溶液能有效吸收汞,吸收总反应为:2Hg+SO2+8I﹣+4H+=2+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:HgI42﹣+2e﹣=Hg+4I﹣.(4)国家制定的工业废水排放标准:汞的含量≤0.05mg/L.某合作学习小组的同学拟用硫化钠法处理含汞废水,其步骤为:先将溶液pH调至8~10,然后加入稍过量的硫化钠溶液,最后加入一定量的FeSO4溶液,过滤后排放.已知:25℃HgS的K sp=4×10﹣52;Hg2S的K sp=1.0×10﹣47,FeS的K sp=6.3×10﹣18;HgS+Na2S⇌Na2HgS2(易溶).①若操作程序完全正确,且废水中只含无机汞,上述处理后的废水能否达标排放能(选填:“能”或“不能”)②加入FeSO4溶液的作用是除去过量的硫化钠,并将Na2HgS2转化为HgS沉淀;同时做混凝剂.9.(15分)(2009秋•盐城期末)钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:(1)铁在元素周期表中位于四周期Ⅷ族.(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:cdb(选用右图中的a、b、c、d填空).(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是acd.(a)其它条件不变,增加高炉的高度(b)调节还原时的炉温(c)增加原料中焦炭与赤铁矿的比例(d)将生成的铁水及时移出(4)已知下列反应数值:反应④△H4=7.3kJ•mol.(5)1100℃时,FeO(s)+CO(g)⇌Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:57.1.(已折合为标准状况)物质的量为x==×10.(15分)(2009秋•盐城期末)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ).制三氯化铬的流程如下:(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因除去其中可溶性杂质,如何用简单方法判断其已洗涤干净最后一次洗涤的流出液呈无色.(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是水浴加热(并用温度计指示温度).(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性.正确的顺序为:⑥→③→②④⑤①.(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为COCl2+2C2H5OH→C2H5OCOC2H5+2HCl.(5)样品中三氯化铬质量分数的测定称取样品0.3300g,加水溶解并定容于250mL容量瓶中.移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.已知:Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2═Na2S4O6+2NaI.①该实验可选用的指示剂名称为淀粉.w ww.k s5u.co m②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是除去其中溶解的氧气,防止氧气将I﹣氧化,产生偏高的误差.③样品中无水三氯化铬的质量分数为96.1%.×=0.002mol11.(15分)(2009秋•盐城期末)吲哚昔酚(idoxifene)可用于治疗骨质疏松症,它的合成路线如下:(1)反应类型:B→C加成反应;D→E还原反应.(2)D中含氧官能团有:羧基、羰基、醚键(写名称).(3)满足下列三个条件的A的同分异构体数目有10种.①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色(4)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六员环,G结构简式为:.(5)2,2﹣二甲基戊酸[]是有机合成中间体,请设计合理的方案以丙酮()为唯一有机原料合成2,2﹣二甲基戊酸(用合成路线流程图表示,并注明反应条件).提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;③合成路线流程图示例如下:CH3CH2OH H2C=CH2.的结构简式为:,。