第九章 过渡金属元素(I)
- 格式:pdf
- 大小:276.71 KB
- 文档页数:17










过渡元素的结构化学i
过渡元素,也称为过渡金属,是元素周期表中的一族元素,它们的原子具有未填满的价电子壳层,这使得它们具有独特的化学和物理性质。
在结构化学方面,过渡元素具有一些引人注目的特性。
首先,过渡元素的原子通常具有多个价电子壳层,这意味着它们可以有多个氧化态。
这使得过渡元素在与其他原子或分子相互作用时具有高度的可变性。
例如,铁元素可以在其原子结构中失去两个、三个或全部五个电子,形成二价、三价或五价铁离子。
其次,过渡元素的原子往往具有较低的配位数,这意味着它们倾向于与其他原子形成紧密的结合。
这种紧密的结合是由于过渡金属的空轨道和配位体的电子之间的强烈相互作用。
例如,铜离子倾向于形成四配位的化合物,如硫酸铜。
此外,过渡元素还经常形成具有复杂结构的化合物,如金属间化合物和金属络合物。
这些化合物通常具有特殊的物理和化学性质,可以应用于许多领域,如催化剂、医药和材料科学。
总的来说,过渡元素的结构化学特性使得它们在化学和物理领域中具有广泛的应用。
通过深入研究过渡元素的结构和性质,我们可以更好地了解这些元素的化学行为,从而为未来的科学研究和技术创新提供基础。
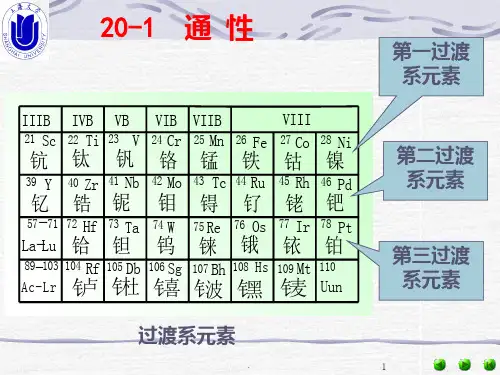
第九章过渡金属元素(I)§9—1 过渡金属元素的通性1—1 过渡金属元素在周期表中的位置及价电子层结构d区 IIIB—VIIIB.过渡金属元素d区(n-1)1—9ns1—2 46 Pd 4d105s0.共计25种元素外过渡金属元素内过渡金属元素 f区(n-2)f1—14(n-1)d0—1ns2共计30种元素(57—71)IIIB---VIIIB Sc Ti V Cr Mn Fe Co Ni 第一过渡金属元素Y Zr Nb Mo Tc Ru Rh Pd 第二过渡金属元素La Ac Hf Ta W Re Os Ir Pt 第三过渡金属元素(57—71) La Ce Pr Nd Pm Sm Eu Gd (64 4f145d06s2) Tb Dy Ho Er Tm Yb Lu1—2 过渡金属元素的重要特征1. 它们都是金属元素,均具有较强的还原能力.2. 同一种金属元素具有多变的氧化数.Cr +6,+3,+2,0“+2氧化数”是特征的Mn +7,+6,+4,+3,+2,0.另外:第四周期第一过渡金属元素高氧化数的化合物具有强氧化性,低氧化性稳定.第二、三过渡金属高氧化数化合物稳定.3. 水合离子或含氧酸根离子具有较深的颜色前者是d—d轨道跃迁.(La系元素是f—f轨道)跃迁所致, 后者是电荷跃迁所致.何为电荷跃迁,它是如何形成的?[问题1](极化效应)4.过渡金属原子元素或离子易形成配合物——这是过渡金属元素最重要的成键特征.1—3. 过渡金属元素的离子半径和原子半径.由于La系收缩现象的产生.使IIIB族中的Sc、Y与15种La系元素共生一起组成17种稀土元素.IVB族的Zn与Hf,VB族的Nb与Ta,VIB族的Mo与W,VIIB族的Tc与Re,VIIIB族的Ru与Os,Rh与Ir,Pd与Pt.原子半径离子半径相近,性质相似.分离困难——这就是La 系收缩的后果.1—4 过渡金属元素氧化物及水合物的酸碱性过渡金属元素除IIIB族外,n ↑,金属的活泼性↓,同一金属氧化物氧化数↑,酸性↑,碱性↓,如:CrO3<CrO3(酸性)MnO<MnO2<Mn2O7(酸性)同n左→右氧化物的酸性↑碱性↓如酸性V2O5<CrO3<Mn2O7同族n↑.氧化物的酸性↓如:CrO3>MoO3>WO3对应水合物的酸碱性变化规律是怎样的呢?[问题2]酸性:H2CrO4>H2MoO4>H2WO4 HMnO4>HTcO4>HReO4酸性:Sc(OH)3<Ti(OH)4<HVO3<H2CrO4<HMnO4 1—5 水合离子及含氧酸根离子的颜色.1. 过渡金属元素的水合离子的颜色.d1 Ti(H2O)63+(t2g1e g0)紫红色 V(H2O)63+绿色 d2 V(H2O)62+(t2g2e g0)紫色d3Cr(H2O)63+(t2g3e g0)蓝紫色 d4 Cr(H2O)62+(t2g3e g0)天蓝色d5 Mn(H2O)62+(淡淡的粉红色)Fe(H2O)63+(淡淡的紫色)(t2g3e g2)d6 Fe(H2O)62+(t2g4e g2)(浅绿色) Co(H2O)63+(t2g6e g1)(兰色)d8 Ni(H2O)62+(t2g6e g2)亮绿色 d7 Co(H2O)62+粉红色(t2g5e g2)d9 Cu(H2O)62+(t2g7e g2)(浅兰色)2含氧酸根离子的颜色VO43-(淡黄色) VO2+(黄色) CrO42-(黄色)Cr2O72-(橙红色) MoO42-、WO42-MnO4-(紫红色)MnO42-绿色 TcO4-、ReO4-淡红色 N bO43-(无色)TaO43-(无色) FeO42-(紫红色)如何解释这些颜色?§9—2 IVB族元素(Ti Zr Hf)(Titanium Subgroup)2—1 概述1 .存在金红石 TiO2 FeTiO3钛铁矿——制备Ti的原料.2. 含量:金属元素第七位.(Al、Fe、Ca、Na、K、Mg、Ti、Mn)3.特性:最亲生物金属,医学上有独特的应用,它用代替损坏的骨头.它的密度很小,4.5g/cm3具有强抗腐蚀能力, 是航天金属.因La系收缩后果.Zr与Hf原子半径相似分离困难.4.Ti的氧化数及元素电势图TiO2无氧化性.Ti3+是很强的还原性, 是实验室常用的还原剂之一.5.化学性质Ti与Al同.虽然活泼,但易产生致密的钝化性的氧化膜.主要是Ti与HCl与HF反应Ti + HCl TiCl3 + H2Ti + HF(aq) TiF62-+ H2Ti、Sn、Fe etc与HCl反应得不到最高氧化数的氯化物, 但与Cl2反应即使单质过量亦生成其最高氧化数的氯化物, 为什么?[问题4]2—3 Ti的重要化合物1. TiO2俗名:金红色钛白它产量标志着一个国家国民经济发展的程度.〈1〉金红石是典型的晶体类型.Ti(+iv)的配位数为6,O2-的配位数为3.〈2〉钛白的制备分4步①钛酰液的制备: FeTiO3 + 2H2SO4 == TiOSO4 + FeSO4 + 2H2O②加入铁回收绿矾③钛酰液水解: TiOSO4 + 2H2O === TiO2H2O + H2SO4④TiO2·2H2O受热分解: TiO2H2O === TiO2 + H2O⑤制备TiCl4 TiO2 + 2C + 2Cl2 ==== TiCl4 + 2CO⑥制备海绵钛 TiCl4 + 2Mg ==== Ti + 2MgCl2⑦精制钛---碘化分解法 Ti + 2I2 ==== TiI4TiI4 === Ti + 2I2金属氧化物 + C + Cl2 → 无水氯化物 + CO---------制备无水氯化物的方法〈3〉TiO2的性质.——两性偏碱,无氧化性.的应用:高级白色颜料,它兼有铅白Pb(OH)2·2PbCO3的掩盖性(即附着力强)和锌白(ZnO)的持久性.2 TiO2+——钛酰离子由于Ti(Ⅳ)的离子半径小,正电荷高.它的离子极化作用很大,溶液中不存在Ti(H2O)64+,而是以TiO2+的形式存在.TiO2+的重要性质是H2O2的反应.(无色)()TiO2+ + H2O2 ==== TiO ( H2O2) 2+桔黄色—— 它是定性、定量鉴定或测量Ti的重要方法及特征反应.注意:强酸性溶液pH<1时溶液呈红色.在弱酸性或中性溶液中呈橙红色.这是由于pH不同值条件下存在形式不同之故.3. TiCl4无色液体,极易水解.(d3s杂化成键的四面体结构)打开塞子即冒白烟.甚至自动溢出.TiCl4 + 2H2O == TiO2 + 4HCl2TiCl4 + Zn == 2TiCl3 + ZnCl2TiCl3溶于水成紫红色[Ti(H2O)6]Cl3,乙醚中变为[Ti(H2O)5Cl]Cl2 H2O显绿色(两种异构体,水合异构体).§9—3 VB族元素(V、Nb、Ta)(Vadanium Subgroup)3—1 VB族元素概述.1. 存在、性质、用途——自学.Ta是最难溶的金属之一, 它难溶解在王水中,可溶解在HNO3——HF混合酸中.可用来制造耐酸设备,代替Pt来制造化学器皿.2. Nb 与Ta原子半径相近,性质相似,分离困难——La系收缩的结果.3.V的氧化数及元素电势图. VO2+ VO2+ V3+ V2+ V黄蓝绿紫3—2 V的重要化合物V5+比Ti4+离子具有更多的正电荷和更小的离子半径,因而水溶液中如同难以存在简单的T i4+离子(主要以TiO2+形式存在)一样,亦难以存在简单的V5+离子,而以VO2+(强酸性条件下)及VO43-(强碱性条件下)等形式存在.由于V—O之间存在较强的极化效应,当这些含氧酸吸收部分可见光后,集中在O一端的电子可向V5+跃迁,即产生所谓的电子跃迁,因此+5氧化数的化合物一般都有颜色.同样V4+在水溶液中以兰色的VO2+形式存在.1. V2O5〈1〉颜色及状态:V2O5呈橙黄色至深红色(冷时橙黄色,热时深红色)的晶体,有〈2〉制备: 2NH4VO3 == V2O5 + 2NH3 + H2O〈3〉性质①两性偏碱性 V2O5 + 2H+ == 2VO2+ + H2OV2O5 +6OH- == 2VO43- + 3H2O②较强的氧化剂 V2O5与浓HCl反应放出Cl2(g)V2O5 + 6HCl(浓) == 2VOCl2 + Cl2 + 3H2O那些氧化物与浓HCl反应放出Cl2?2. 矾酸盐及多矾酸盐VO43-如同ClO4-、SO42-、PO43-一样皆为四面体结构d3s杂化成键,因离子中存在较弱的pπ—dπ反馈π配键,因此在不同pH值下发生不同聚合作用.注:强酸性溶液中,VO2+(黄色)存在,强碱性条件下VO43-(近黄色)形式存在,即:VO43- + 4H+ VO2+ + 2H2O 〈1〉VO2+与Zn的反应在矾酸盐的酸性溶液中加入Zn粒可观察到溶液的颜色由黄色→兰色→绿色→紫色的变化.〈2〉矾酸盐与H2O2的特征反应:弱酸弱减或中性溶液时,矾酸盐溶液与H2O2进行转移过氧键的反应生成黄色的[VO2(O2)2]3-,在强酸性溶液中得到红棕色的V(O2)2+(过氧矾阳离子).〈3〉矾酸盐在酸性碱性中的存在形式VO43- + 4H+ VO2+ + 2H2O§9—4 VIB族元素(Cr、Mo、W)(Chromium Subgroup)4—1 概述一.价电子结构及氧化数 d区 VIB (n-1)d5ns1 W 5d46s2Cr:+6 +3 +2 0CrO42- Cr3+ Cr2+(天兰色)CrO3 Cr(OH)3 Cr(CO)6CrO2Cl2 Cr2O3W Mo +2 +3 +4 +5 +6W、Mo高氧化数化合物稳定活泼性Cr—Mo—W降低性质特性:Cr硬度最大,W熔沸点最高.重点:Cr与HCl的反应:Cr + 2HCl == CrCl2 + H2CrCl2强还原性,可用于除去体系中的微量O2Cr与稀HCl酸的反应生成天蓝色溶液,很快变为绿色溶液.(注:Cr2+的水溶液可以除氧. Cr如同Al、Fe一样遇H2SO4(浓)HNO3(浓)产生钝化现象.三元素电势图显然:〈1〉Cr3+在酸性条件下具有极弱的还原性,很稳定,在碱性条件下具有强的还原性〈2〉Cr2O72-在酸性条件下具有强的氧化能力,但在碱性条件下,存在形式为CrO42-(黄色)很弱的氧化性2CrO42- + 2H+ Cr2O72- + H2O K = 1014四成键特征:1. 形成有颜色的含氧化合物 Cr2O3(绿色)CrO3(暗红色)CrO2Cl2(红棕色)CrO42-(黄色)Cr2O72-(橙红色)Cr(OH)3(灰兰色胶状)这些颜色变化可用电荷转移跃迁来解释.2.形成配合物(Cr3+)Cr3+ d3结构易形成CN = 6的杂化的内轨型,顺磁性八面体的配合物,配合物往往具有颜色,可用d—d轨道跃迁来解释.Cr(H2O)63+(兰紫色), Cr(NCS)63-(兰紫红色)Cr(NH3)63+(黄色)4—2 Cr的重要化合物(+3,+6氧化数对应的化合物)从前面的Cr的元素电势图可以看出:酸性溶液中Cr3+是最稳定具有很弱的还原性,Cr2O72-是强氧化剂,碱性溶液中Cr3+、Cr(OH)4-具有强还原性,CrO42-弱氧化性一.+3氧化数的化合物1. Cr3+的结构特点3d3结构(9—17)e-不规则构型,离子半径64pm,正电性高,有空的价d轨道2. Cr2O3制备3. Cr3+的性质①. 电离作用这一点同Al3+、Fe3+注:Cr3+ 在酸性, 碱性溶液中均易发生水解反应.这是二者的区别亦是简单分离的方法之一.②酸性溶液中较弱的还原性φθCr2O72-/ Cr3+=1.33V③碱性条件下较强的还原性φθCrO42-/Cr(OH)4- = -0.13 V碱性溶液中Cr(III)可被过氧化氢氧化为铬酸根:2Cr(OH)4- + 3H2O2 +2OH- == 2CrO42- + 8H2O④较强的配位作用Cr3+与H2O、X-、en、NH3、EDTA、en、NCS-、C2O42-、CN-等形成稳定的d2sp3杂化的内轨型顺磁性有色的八面体结构的配合物,这是由于Cr3+ d3结构,离子半径小正电性高之故.A. Cr3+在水溶液中进行的配位反应是配体取代H2O分子的过程,因此同一组成的配合物,可能存在多种水合异构体,如:[Cr(H2O)5Cl]Cl2·H2O(兰绿色)Cr(H2O)6Cl3(兰紫色)[Cr(H2O)4Cl]Cl2·2H2O(绿色)后两者互称为水合异构现象.又如,Cr(H2O)63+被NH3取代可得到一系列不同的配离子(必须在NH3·H2O—NH4+条件下),Cr(H2O)63+(兰紫色)[Cr(H2O)4(NH3)2]3+(紫红色)Cr(H2O)3(NH3)33+(浅红色)[Cr(H2O)2(NH3)4]3+(橙红色)[Cr(NH3)5H2O]3+ 橙黄色Cr(NH3)63+(黄色)均可用d—d杂化轨道来解释.B、Cr3+的配合物最重要的特征是立体异构现象.⑤Cr3+、Al3+、Fe3+的相似性及区别A、相似性a、电荷相同,离子半径相近b、形成相同的水合离子如CN = 6 M(H2O)63+,形成M(OH)3(s)c、离子易发生水解,加入CO32-均发生双水解反应d. 成矾 K2SO4 M2(SO4)3••24H2OB、差异性a、水合离子的颜色不同Al(H2O)63+(无色)Fe(H2O)63+(淡淡的紫色)Cr(H2O)63+(兰紫色)氢氧化物沉淀的颜色不同Al(OH)3(s,白色胶状)Fe(OH)3(s,红棕色)Cr(OH)3(灰兰色胶状)b、氢氧化物的酸碱性不同 Al(OH)3、Cr(OH)3 呈两性 Fe(OH)3微弱的两性,难溶解在NaOH溶液中.c、氧化还原性质不同Al3+无氧化还原性,Cr3+酸性条件下具有弱的还原性,碱性条件下强的还原性,Fe3+较强的氧化性,碱性条件下难以被氧化为FeO42-d、形成配合物的能力不同 Fe3+、Cr3+易形成配合物但Al3+则较难,电子构型不同,Al3+ 8e-,Fe3+、Cr3+(9—17)e-不规则构型. 因此利用Fe3+、 Al3+、 Cr3+的差别可以进行离子的分离:二. +6氧化物的化合物.颜色 CrO42-黄色 Cr2O72-橙红色 CrO3暗红色 CrO2Cl2外观似Br2,红棕色结构四面体(d3s) Cr(VI)离子比具有更高的正电荷和更小的离子半径.因此,无论溶液或晶体中,不存在Cr6+离子总是上述形式存在.Cr(VI)的化合物均呈现特征颜色,同样由于电荷跃迁所致.Cr(VI)的化合物毒性很大是环境水重要的测试指标.1. CrO3——暗红色晶体,是H2CrO4的酸酐, 是铬酸洗液(5g K2Cr2O7+100ml 浓H2SO4),析出的暗红色晶体,是很强的氧化剂遇有机物剧烈反应.2. CrO42-和Cr2O72-的化合物①二者的平衡关系:2CrO42- + 2H+ Cr2O72- + H2O K = 1014碱性中CrO42-为主显黄色,酸性中以Cr2O72-为主显橙红色4.0<pH<9.0二者共存.pH<4.0 Cr2O72-为主 pH>9.0CrO42--为主a. 中性、弱酸性溶液中二者共存.b. H2CrO4是中强酸c. H2CrO4中存在较强的反馈配键, 因此难以发生聚合作用.②CrO42-与Cr2O72-的结构 d3s杂化成键, 四面体结构.③CrO42-、Cr2O72-的反应A. 与Ag+、Ba2+、Pb2+等反应均产生铬酸盐的沉淀, 并非重铬酸盐沉淀,这是由于铬酸盐之S很小之故. BaCrO4(黄色)、PbCrO4(黄色)、Ag2CrO4(砖红色)难溶.PbCrO4俗称铬黄,不溶于水但溶于酸.2Ag+ + CrO42- === Ag2CrO4↓(砖红色)4Ag+ + Cr2O72- H2O=== 2Ag2CrO4↓(砖红色) + 2H+B. Cr2O72-的特征反应Cr2O72- + 4H2O2 + 2H+ = 2CrO5(美丽蓝色) + 5H2O---------鉴别 H2O2 或 Cr3+的特征反应K2Cr2O7试纸 -----------可监测司机是否酒后开车:2Cr2O72-(橙黄色)+3CH3CH2OH + 16H+= 4Cr3+(绿色) + 3CH3COOH +11H2OC. CrO42-的检验: Ba2+ or Pb2+ or酸性条件下加入 H2O2乙醚3. CrO2Cl2氯化铬酰,红棕色液体外观似溴(极易水解)4 K2Cr2O7红矾钾——重要的基准试剂Na2Cr2O7·2H2O——了解其制备方法——自学.4—3 W与Mo的化合物——了解——(自学)1 变化规律:H2CrO4 H2MoO4 H2WO4氧化性减弱酸性减弱.2 同多酸及杂多酸不同酸酐组成的多酸.若干个水分子和两个以上相同酸酐组成的多酸.如:H4P2O7即H n+2P n O3n+1同多酸但(NH4)3[PO4·12MoO3]·6H2O(黄色)是杂多酸盐.3NH4++ PO43-+ 12MoO42-+ 24H+== (NH4)3[PO4·12MoO3]·6H2O↓(黄色晶体)+6H2O---------该反应可以定性鉴别PO43-或MoO42-的特征反应.4—4 金属原子簇化合物.一. 含义:含有两个或两个以上彼此以共价键结合的金属原子的化合物——金属原子簇化合物.原子簇化合物化学是目前无机化学极其活泼的研究领域涉及的面很广,前景广阔.Core:该类化合物中含有金属—金属间形成的共价键.二. EAN规则 ——— 18电子规则 ----(n-1)d ns np 9条价轨道三若干个金属原子簇化合物1. 双核金属原子簇化合物(1).Mn2(CO)10EAN = 7+10+1=18e-两个重叠的八面体Mn d2sp3杂化成键,每个Mn原子与五个CO形成σ配键和反馈π键;两个Mn原子以Mn—Mn金属间形成共价键.(CO)8Co d2sp3杂化八面体结构EAN = 9+6+1+2 = 18e-(3).Fe2(CO)9分子中存在Fe—Fe金属共价键,另外三个羰基搭桥成键------桥羰基 EAN = 8 +2×3 + 1 +1×3 =18e-2. 多核金属原子簇化合物(1).Ru3(CO)12EAN = 8 + 2×4 + 1 + 1 = 18e-(2). Ir4(CO)12EAN = 9 + 2×3 + 1×3 = 18e-(3). Mo6Cl84+6个Mo2+在立方体的六个面心上,以八面体的形式排布; 8个Cl-占据立方体的8个顶角位置.每4个Cl-组成平面方形.这两个平面方形相互平行.另外每3个Mo2+与1个Cl-形成多中心键.§ 9—5 VIIIB族(Mn Tc Re)5——1 VIIIB族概述1. 价电子层结构及氧化数VIIB d区(n-1)d5ns2Mn +7 , +6 , +4, +3, +2, 0, -3MnO4- Mn2O7 MnO42- MnO2 Mn2O3 MnSO4 Mn2(CO)10(NO)3EAN = 7+2+3×3=18e-2. 成键特征〈1〉以含氧化合物形式存在且具有颜色.Mn2O7棕色油状 MnO暗绿色 MnO4- MnO42-〈2〉形成配合物Mn2+d5结构往往CN = 6的sp3d2相成杂化的外轨型强顺磁配合物.((9—17)e-不规则构型,半充满状态.因此Mn2+很稳定.)(但Mn(CN)64- 低自旋配合物)并且配合物的颜色均很浅.为什么?3. Mn的元素的电势图〈1〉酸性溶液中MnO4-是极强的氧化剂Mn2+在溶液中很稳定,具有极弱的还原性难以被常见的氧化剂所氧化,只有极强的氧化剂NaBiO3、S2O82-、PbO2 etc Mn2+ →MnO4-.〈2〉酸性条件下MnO42-、Mn3+极不稳定,易发生歧化反应:(棕褐色)只有在碱性条件下 MnO42-(绿色)可存在.〈3〉Mn(OH)2在碱性条件下极不稳定.空气中的O2 Mn(OH)2 →MnO(OH)2〈4〉Mn是活泼性很强的金属元素.5—2存在及应用Mn地壳中含量第八位,是黑色金属.主要以MnO2·x H2O(软锰矿)形式存在.5—3 Mn的重要化合物一. +2氧化数的化合物.(Mn2+的性质)〈1〉极弱的还原性酸性条件下,Mn2+的还原性很弱,稳定性很高,这与d5结构半充满状态有关2Mn2++ 5S2O82-+ 8H2O == 2MuO4-+ 10SO4-+ 16H+2Mn2+ + 5NaBiO3 +14H+ == 2MnO4- + 5Na+ + 5Bi3+ + 7H2O .碱性条件下,较强的还原性.Mn(OH) 2(白色)→ MnO(OH)(s,棕褐色)新生成的白色的Mn(OH)2如同Mg(OH)2一样2可溶解在饱和的NH4Cl溶液中.因此可进行Fe3+、Mn2+的分离.〈2〉Mn2+形成配合物Mn2+d5结构,半充满状态,它的大多数配合物是高自旋的sp3d2杂化的外轨型,八面体结构的强顺磁性的.但与CN-可形成低自旋的d2sp3杂化的内轨型弱磁性的配合物.Mn(CN)64- μ=1.78B.M.CFT Mn2+的高自旋态配合物,d电子排布为:t2g3e g2,电子从低能级的t2g向高能级e g时,其自旋方向要发生改变,这种跃迁是d—d轨道自旋禁阻的跃迁, 这种跃迁的几率是很小,或者说对光的吸收很弱,因此Mn2+的高自旋八面体配合物的颜色很浅几乎无色. 核心:自旋禁阻.二. +4氧化数的化合物.MnO21 强氧化性.2弱的还原性. 3MnO2 + 6KOH + KClO3 3K2MnO4(绿色)+ KCl + 3H2O3与浓H2SO4反应: 2MnO2 + 2H2SO4 2MnSO4 + O2 + 2H2O4. +4氧化数的配合物. MnF62-(金黄色)MnO2 + 2HF + 2KHF2 === K2MnF6 + 2H2O 三. +7氧化数的化合物. KMnO4→MnO4-1 MnO4-的结构及颜色d3s杂化的四面体结构.离子中存在很强的pπ—dπ反馈π配键.因此,HMnO4强酸.溶液中难以发生聚合作用.MnO4-(紫红色),并且它的颜色较VO43-、CrO42-深得多!为什么?同样是电荷迁移(跃迁)所致,只不过这种电荷跃迁比CrO42-更容易.说明:Mn—O键之间的极化效应更强,电子易从O原子跃迁至Mn(VII).2性质.①强氧化性i. 与Fe2+的反应-------测定Feii. 与H2C2O4的反应.——准确标定MnO4-的准确浓度.反应开始很慢,随着反应的进行,反应速率逐渐加快.为什么?(自身指示剂)iii. 与Mn2+的反应:(棕褐色) 2MnO4- + 3Mn2+ + 2H2O === 5MnO2 + 4H+iv . 与SO32-的反应酸性溶液中: 2MnO4- + 5SO32- + 6H+ == 2Mn2+ + 5SO42-+ 3H2O中性溶液中: 2MnO4- + 2SO32- + H2O == 2MnO2 + 2SO42-+ 2OH-碱性溶液中: 2MnO4- + SO32- + 2HO- == 2MnO42- + SO42- + HO2v .与H2O2的反应——非转移过氧链反应.②稳定性:A.酸不稳定性4MnO4- + 4H+ == 3O2 + 2H2O + MnO2B.碱不稳定性 4MnO4- + 4OH- == 4MnO42- +O2 + 2H2OC.热不稳定性 2KMnO4 K2MnO4 + MnO2 + O2D.光不稳定性,见光易分解.因此KMnO4(s)应放在棕色瓶中且低温保存.KMnO4溶液用时先配制.3. 制备:方法一:即碱融氧化法及歧化法.转化率为66.7%.(1)在熔融碱中用O2(或KClO3)氧化MnO2MnO2 + 4KOH + O2 2K2MnO4 + 2H2O3MnO2 + 6KOH + KClO3 3K2MnO4 + KCl + 3H2O(2) 将反应完后的矿样用水浸取,过滤除去残渣,向滤液中通入CO2使K2MnO4歧化成KMnO4和MnO2:3K2MnO4 + 2CO2 = 2KMnO4 + MnO2 + 2K2CO3(3) 过滤除去MnO2,滤液加热蒸发、浓缩、结晶得KMnO4晶体产品。