物质性质与变化的关系
- 格式:pptx
- 大小:129.50 KB
- 文档页数:7

物质的性质与变化物质是构成宇宙万物的基本单位,它们在不同条件下具有不同的性质和表现出多样的变化。
本文将从物质的性质以及物质的变化两个方面进行探讨。
一、物质的性质物质的性质是指物质所固有的特点和属性,包括物质的物理性质和化学性质。
1. 物理性质物理性质是用来描述物质在物理条件下的特征的,它们通常可以通过观察和测量来进行判断。
首先,物质的质量是指物质所固有的质量大小,是物质的基本性质之一。
其次,物质的颜色是物质表面对可见光的反射和吸收特性的反映。
再次,物质的硬度是物质对外力作用下抵抗破坏的能力。
另外,物质的熔点和沸点是物质在升温或降温过程中发生相变的温度。
最后,物质的电导率是物质对电流通过的能力,这是物质电子结构和组成的重要表现。
2. 化学性质化学性质是指物质与其他物质发生化学反应时所表现出的性质,它们通常需要改变物质的组成才能观察到。
首先,物质的可燃性是物质在一定条件下燃烧产生热、光、气体等现象的性质。
其次,物质的氧化性是物质与氧气或其他物质接触时发生氧化反应的能力。
再次,物质的还原性是物质在化学反应中通过失去氧或获得电子而发生还原反应的能力。
另外,物质的酸碱性是物质在水溶液中的酸碱指数,反映了物质对酸碱溶液的中和反应的能力。
最后,物质的稳定性是指物质在不同条件下是否会发生分解、腐蚀或变质等不可逆反应。
二、物质的变化物质的变化是指物质在不同条件下发生的性质或组成的改变。
物质的变化可以分为物理变化和化学变化两种形式。
1. 物理变化物理变化是指在不改变物质的组成的情况下,物质的形态、性质或状态发生变化。
例如,物质的相变是指物质在温度或压力改变的条件下,由一个物相转变为另一个物相。
另外,溶解是指将一个物质溶解到另一个物质中,形成均匀的溶液。
还有,物质的形状改变也是物质的物理变化,例如物体的形状可以通过拉伸、压缩和变形等方式改变。
2. 化学变化化学变化是指物质在发生化学反应时,物质的组成发生改变,生成新的物质。


物质的性质与变化物质是构成一切事物的基本单位,其性质与变化是自然界和化学领域中研究的重要内容。
物质的性质包括各种性质,例如物理性质、化学性质等。
本文将从不同的角度探讨物质的性质与变化。
一、物质的物理性质物质的物理性质是指在不改变化学组成的情况下,通过观察和测量可以获得的性质。
常见的物理性质有颜色、形状、质量、密度等。
例如,铁的物理性质包括金属光泽和导电性。
物质的物理性质可以通过实验进行观测。
例如,我们可以通过称量物体的质量,使用显微镜观察物体的形状和颜色,以及使用密度计来测量物质的密度。
这些物理性质可以帮助我们区分不同的物质,并对物质进行分类。
二、物质的化学性质物质的化学性质是指在与其他物质发生反应时所显示出的性质。
它反映了物质的组成和结构,以及与其他物质之间的相互作用方式。
例如,氧气和铁发生化学反应生成氧化铁,这是铁的一种化学性质。
物质的化学性质可以通过化学反应来观察和研究。
化学反应会改变物质的化学组成,产生新的物质。
通过观察产生的气体、固体或溶液的变化,可以研究物质的化学性质。
化学性质的研究对于理解物质的组成和性质具有重要意义。
三、物质的物理变化物质的物理变化是指在不改变其化学组成的情况下,通过物理手段引起的变化。
物质的物理变化不会生成新的物质,只是改变了物质的外观或状态。
常见的物理变化有融化、沸腾、凝固等。
物质的物理变化通常是可逆的,可以通过逆过程恢复原来的性质。
例如,将水蒸发成水蒸气是物质的物理变化,而将水蒸气冷却后再凝结成水的过程是其逆过程。
物质的物理变化与能量的转移密切相关。
四、物质的化学变化物质的化学变化是指在与其他物质发生反应的过程中,物质发生了化学组成和性质上的变化。
化学变化会生成新的物质,并伴随着能量的吸收或释放。
常见的化学变化有燃烧、腐蚀、酸碱中和等。
物质的化学变化是不可逆的,不可逆过程中物质的性质发生了根本性的改变,无法通过简单的物理手段恢复原来的性质。
例如,木材燃烧生成二氧化碳和水,这是一种化学变化。

物质的性质与变化物质是构成世界万物的基本单位,其性质的不同决定了物质在自然界中的行为与变化。
本文将探讨物质的性质及其变化的原因。
一、物质的性质物质的性质可从多个角度进行分类,下面将从物质的物理性质、化学性质以及生物性质三个方面进行阐述。
1. 物质的物理性质物质的物理性质是指物质在不改变其化学组成的情况下所表现出的性质。
其中包括颜色、形状、硬度、密度、溶解度等。
例如,铁的物理性质包括铁的灰白色、坚硬、密度较大等特点,而水的物理性质则包括无色、透明、不可压缩等。
2. 物质的化学性质物质的化学性质是指物质与其他物质产生化学反应时所表现出的性质。
例如,铁能够与空气中的氧气发生氧化反应而生锈,氧气与可燃物质相遇时能够引发燃烧反应等。
物质的化学性质可以反映出物质的化学反应活性与化学稳定性。
3. 物质的生物性质物质的生物性质是指物质对生物体所产生的影响与相互作用。
例如,食物的味道、毒物对生物体的毒性等。
生物性质的研究对于食品安全、药物研发等领域具有重要意义。
二、物质的变化物质的变化是指物质在一定的条件下,由于受到外界因素的作用而表现出的性质的改变。
物质的变化包括物态的变化以及化学变化两个方面。
1. 物态的变化物态的变化是指物质在不改变其化学组成的前提下,由一个物态转变为另一个物态的过程。
例如,水可以由液态变为固态(冰)或气态(水蒸气),这是由于温度或压力的改变所导致的。
2. 化学变化化学变化指的是物质在发生化学反应时,原有物质的化学组成和性质发生变化,生成新的物质。
化学变化常常伴随着能量的吸收或释放,并且往往无法恢复到原来的状态。
例如,氢气与氧气发生反应生成水分子,这是一种化学变化。
三、物质变化的原因物质的性质和变化的原因主要与物质的微观结构有关。
物质的微观结构决定了物质的性质和变化的方式。
物质的微观结构包括原子、分子以及化学键等。
1. 原子与分子物质是由原子或分子组成的,不同元素的原子或不同分子间的相互作用导致了物质的性质的差异。

物质性质与变化物质是构成宇宙的基本要素,具有各种独特的性质和特征。
在我们的日常生活和科学研究中,我们经常遇到不同物质之间发生的各种变化和相互作用。
本文将探讨物质的性质以及它们在不同条件下的变化。
一、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是描述物质在不改变其化学组成的情况下所表现出来的特征。
例如,物质的颜色、形状、密度、熔点、沸点等都属于物理性质。
这些性质是可以通过观察和测量得到的,并且不会改变物质的分子或原子的组成。
化学性质则是描述物质在发生化学反应时所表现出的特征。
例如,物质的可燃性、腐蚀性、稳定性等属于化学性质。
这些性质是在物质与其他物质发生反应时才能观察到的,并且会导致物质的组成和结构发生改变。
二、物质的变化物质在不同条件下可以发生多种变化,常见的有物态变化、化学变化和核变化。
1.物态变化物态变化是指物质在不同温度或压力条件下由一个物态转变为另一个物态的过程。
常见的物态变化有固体的熔化和凝固、液体的汽化和凝结、气体的液化和升华等。
这些变化是由于温度和压力的改变导致物质分子或原子间相互作用方式的改变所引起的。
2.化学变化化学变化是指物质在与其他物质发生化学反应时,其化学组成和结构发生改变的过程。
化学变化通常伴随着能量的释放或吸收,形成新的物质。
化学变化可以是可逆的,也可以是不可逆的。
例如,铁生锈、木材燃烧和果实腐烂等都是常见的化学变化现象。
3.核变化核变化是指物质的原子核发生改变的过程,从而产生不同的元素或同位素。
核变化包括核裂变和核聚变两种形式。
核裂变是指重核原子核分裂成两个或多个较轻的原子核的过程,同时释放大量能量。
核聚变则是指两个或多个轻核原子核合并成一个较重的原子核的过程,同样伴随能量的释放。
对于物质的变化,有时候我们可以通过一些物理或化学性质的改变来判断其是否发生了变化。
例如,物质的颜色、溶解性、气味等的改变往往可以作为判断物质是否发生了变化的指标。
总结:物质的性质是描述物质的固有特征,包括物理性质和化学性质。


科学探索物质的性质和变化物质是构成宇宙万物的基本要素,其性质和变化规律一直是科学家们关注的焦点。
通过科学的方法和实验手段,我们得以深入探索物质的性质和变化,揭示了自然界中众多的奥秘。
一、物质的性质物质的性质指的是物质所特有的、固有的本质和特点。
物质的性质可以分为物理性质和化学性质两个方面。
1. 物理性质物理性质是指物质在不改变其化学组成的情况下,通过观察和测量可得到的性质。
常见的物理性质包括颜色、形状、密度、熔点、沸点等。
通过对物理性质的研究,我们可以了解物质的外部特征和基本行为。
2. 化学性质化学性质是指物质在与其他物质发生相互作用时所表现出的性质。
物质的化学性质研究的是物质在组成和结构发生改变的过程中所表现出的变化和特性。
例如,物质的可燃性、活泼度、稳定性等都是其化学性质的表现。
二、物质的变化物质的变化主要包括物理变化和化学变化两种形式。
在物质的变化过程中,物质的性质可能会发生改变。
1. 物理变化物质的物理变化是指在物质的外界条件发生改变的情况下,物质本身的形态、状态或组成发生改变,但其化学性质不发生变化。
常见的物理变化包括固体的熔化、液体的蒸发、气体的冷凝等。
在物理变化中,物质的变化只是表面上的改变,其内部结构和组成并未发生改变。
2. 化学变化化学变化是指物质在一定条件下与其他物质相互作用,发生化学反应,原有物质被转化成新的物质。
化学变化会伴随着物质的化学性质的改变,例如颜色的变化、气味的改变、能量的释放等。
化学变化是物质发生本质性改变的过程,涉及到物质的分子结构和化学键的断裂和新的形成。
化学变化是我们研究物质性质和进行化学反应的基础。
三、物质的性质与变化的关系物质的性质决定了其变化的方式和过程。
不同性质的物质在相应的条件下会呈现不同的变化规律和结果。
1. 物质性质影响变化方式不同性质的物质在不同的条件下会发生不同的变化方式。
例如,对于易燃物质而言,其在遇到火源时会发生燃烧变化;而对于不溶于水的物质,其在与水接触时则不会溶解,而是会发生物理变化,如沉淀变化。

物质的性质与变化一、引言物质是构成世界的基本单位,它们具有各自独特的性质,并且在不同条件下会发生变化。
了解物质的性质和变化对于科学研究和日常生活都至关重要。
本文将探讨物质的性质以及它们在不同条件下的变化过程。
二、物质的性质分类1.物理性质物理性质是指物质不改变化学组成的情况下所表现出来的特性。
例如,物质的颜色、形状、质地、密度、熔点和沸点等都是物理性质。
这些性质通常可以通过观察和测量得到,并且不会导致物质的化学变化。
2.化学性质化学性质是指物质在发生化学反应时所表现出来的特性。
通过与其他物质的反应,物质的化学性质可以得到描述。
例如,物质的酸碱性、氧化性、还原性等都属于化学性质。
化学性质的观察和测量往往需要进行化学反应实验。
三、物质的变化过程1.物理变化物理变化是指物质在不改变其分子结构和化学组成的情况下,改变了它的物理性质的过程。
例如,水从液态变为固态、融化、汽化等都属于物理变化。
在物理变化中,物质的性质改变了,但本质并未发生变化。
2.化学变化化学变化是指物质在发生化学反应的过程中,改变了其分子结构和化学组成的过程。
例如,木材燃烧产生火焰、铁生锈、苹果变色等都属于化学变化。
在化学变化中,有新的物质生成,原有物质被改变,因此其性质也相应地发生了改变。
四、物质的性质与变化的关系物质的性质决定了其在不同条件下的变化方式。
不同物质具有不同的性质,因此它们在受到外界刺激或条件变化时会产生不同的响应。
1.性质决定了变化的类型物质的物理和化学性质决定了它在受热、受光、受力等条件下的变化类型。
例如,金属在受热时容易膨胀,有些物质在受光照射下会发生化学反应,不同物质在受力作用下的变形程度也不同。
2.变化揭示了性质通过观察和实验中物质的变化过程,我们可以进一步了解其性质。
例如,铁生锈的过程揭示了铁的氧化性质,石灰石在受热条件下分解产生二氧化碳和水等。
3.变化的控制应用基于对物质性质和变化的理解,我们可以通过控制条件来实现特定的变化,以满足实际需求。
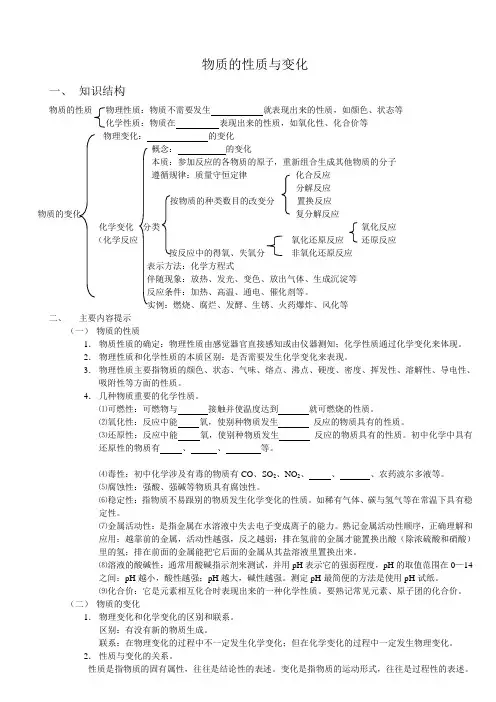
物质的性质与变化一、知识结构物质的性质物理性质:物质不需要发生就表现出来的性质,如颜色、状态等化学性质:物质在表现出来的性质,如氧化性、化合价等物理变化:的变化概念:的变化本质:参加反应的各物质的原子,重新组合生成其他物质的分子遵循规律:质量守恒定律化合反应分解反应按物质的种类数目的改变分置换反应物质的变化复分解反应化学变化分类氧化反应(化学反应氧化还原反应还原反应按反应中的得氧、失氧分非氧化还原反应表示方法:化学方程式伴随现象:放热、发光、变色、放出气体、生成沉淀等反应条件:加热、高温、通电、催化剂等。
实例:燃烧、腐烂、发酵、生锈、火药爆炸、风化等二、主要内容提示(一)物质的性质1.物质性质的确定:物理性质由感觉器官直接感知或由仪器测知;化学性质通过化学变化来体现。
2.物理性质和化学性质的本质区别:是否需要发生化学变化来表现。
3.物理性质主要指物质的颜色、状态、气味、熔点、沸点、硬度、密度、挥发性、溶解性、导电性、吸附性等方面的性质。
4.几种物质重要的化学性质。
⑴可燃性:可燃物与接触并使温度达到就可燃烧的性质。
⑵氧化性:反应中能氧,使别种物质发生反应的物质具有的性质。
⑶还原性:反应中能氧,使别种物质发生反应的物质具有的性质。
初中化学中具有还原性的物质有、、等。
⑷毒性:初中化学涉及有毒的物质有CO、SO2、NO2、、、农药波尔多液等。
⑸腐蚀性:强酸、强碱等物质具有腐蚀性。
⑹稳定性:指物质不易跟别的物质发生化学变化的性质。
如稀有气体、碳与氢气等在常温下具有稳定性。
⑺金属活动性:是指金属在水溶液中失去电子变成离子的能力。
熟记金属活动性顺序,正确理解和应用:越靠前的金属,活动性越强,反之越弱;排在氢前的金属才能置换出酸(除浓硫酸和硝酸)里的氢;排在前面的金属能把它后面的金属从其盐溶液里置换出来。
⑻溶液的酸碱性:通常用酸碱指示剂来测试,并用pH表示它的强弱程度,pH的取值范围在0—14之间:pH越小,酸性越强;pH越大,碱性越强。

物质的性质和变化规律一、物质的性质1.物质的组成:物质是由原子、分子、离子等基本粒子组成。
2.物质的分类:物质可分为纯净物和混合物。
纯净物又可分为元素和化合物。
化合物根据组成元素的类别可分为有机化合物和无机化合物。
3.物理性质:物质不需要发生化学变化就表现出来的性质,如颜色、状态、气味、密度、硬度、熔点、沸点等。
4.化学性质:物质在化学变化中表现出来的性质,如可燃性、助燃性、氧化性、还原性、酸碱性、腐蚀性等。
5.物质的结构:物质内部粒子之间的排列和空间构型。
6.物质的能量:物质具有的能量,包括热能、化学能、电能等。
二、化学反应与变化规律1.化学反应:物质之间发生的一种或多种物质转化为另一种或多种物质的过程。
2.化学变化的实质:反应物分子分解成原子,原子重新组合成新分子。
3.化学反应的类型:氧化还原反应、置换反应、复分解反应、加和反应、消除反应等。
4.化学平衡:反应物和生成物浓度不再发生变化的状态。
5.化学反应速率:单位时间内反应物消失或生成物出现的量。
6.影响化学反应速率的因素:温度、浓度、压强、催化剂、固体表面积等。
7.化学平衡的影响因素:温度、浓度、压强等。
8.化学反应的能量变化:放热反应、吸热反应。
9.热力学定律:能量守恒定律、熵增定律。
10.化学反应的限度:可逆反应中,正反应和逆反应进行的程度。
三、物质的制备与应用1.物质的制备:通过化学反应或物理方法制得所需物质的过程。
2.物质的应用:物质在生产、生活、科研等方面的应用。
3.化学工艺:物质的制备方法和技术。
4.物质的用途:根据物质的性质决定其在实际应用中的用途。
四、物质的检验与鉴别1.物质的检验:通过化学反应或物理方法确定物质的存在。
2.物质的鉴别:根据物质的性质差异,用化学反应或物理方法区分物质。
3.化学试剂:用于检验和鉴别物质的化学物质。
4.分析方法:光谱分析、色谱分析、电化学分析、滴定分析等。
五、物质的可持续发展与环境保护1.可持续发展:满足当代人的需求,不损害后代满足其需求的能力。

化学物质的性质和变化规律化学物质是自然界中最基本的构成物质单位,而其性质和变化规律则是我们认识和理解化学世界的基础。
在本文中,我们将探讨化学物质的性质以及其所遵循的变化规律,以期能够更深刻地了解和应用化学知识。
一、化学物质的性质1.1 物质的宏观性质物质的宏观性质是我们用肉眼能够直接观察到的性质,例如物质的颜色、形状、质地、硬度等。
这些性质通常受到物质的组成和结构的影响,不同的物质表现出不同的宏观性质。
1.2 物质的微观性质物质的微观性质是指通过实验和理论研究能够揭示物质内部构成和性质的性质,例如物质的分子结构、化学键类型、原子间的相互作用等。
了解物质的微观性质可以帮助我们预测物质的宏观性质,进而设计和调控化学反应。
二、物质的变化规律2.1 物质的化学变化化学变化是指物质在一定条件下发生的组成和性质的改变,常见的化学变化包括物质的燃烧、酸碱中和、氧化还原等。
化学变化通常伴随着原子或分子之间的原子键或化学键的断裂和形成,从而导致物质的性质发生显著改变。
2.2 物质的物理变化物质的物理变化是指物质在不改变其化学组成的情况下发生的性质或状态的改变,例如物质的溶解、熔化、汽化等。
物质的物理变化通常不伴随着原子或分子之间的原子键或化学键的断裂和形成,仅仅是物质的组织结构或状态发生改变。
2.3 变化规律:质量守恒定律在任何化学反应中,物质的质量总是保持不变的。
这就是质量守恒定律,它揭示了化学反应中物质的微观信息——原子的不灭性。
根据质量守恒定律,我们可以利用化学方程式平衡反应物与生成物的质量。
2.4 变化规律:化学反应速率化学反应速率是指单位时间内反应物消耗或生成的量,它受到温度、浓度、压力、催化剂等因素的影响。
根据化学反应速率的变化规律,我们可以确定最佳反应条件,从而提高化学反应的效率。
2.5 变化规律:平衡态许多化学反应在一定条件下会达到平衡态,即反应物和生成物的浓度保持在一定比例范围内不再发生变化。
在平衡态下,反应物和生成物之间的速率相等,这可以用化学平衡常数来表征。
物质的性质和变化物质是构成世界的基本单位,它具有多种性质和能够发生多种变化。
本文将探讨物质的性质以及它们所经历的变化过程。
一、物质的性质物质的性质是指它们的特征和表现形式。
根据物质的性质可分为物理性质和化学性质。
1. 物理性质物理性质是描述物质外部特征和行为的性质,如颜色、形状、相对密度、熔点、沸点等。
这些性质不会改变物质的化学组成,只是表明它们在外观和状态上的差异。
以水为例,它的物理性质包括无色、无味、透明等。
通过改变温度,水的物态可发生变化,如冰、液态水以及水蒸气。
这些不同状态的水均具有相同的化学成分,只是在物理状态上发生了改变。
2. 化学性质化学性质是描述物质内部组成和与其他物质发生反应的性质。
物质的化学性质决定了它们与其他物质如何相互作用和变化。
举个例子,当纯铁暴露在空气中时,会与氧气发生化学反应,生成铁锈。
这是由于铁的化学性质使其具有与氧气反应的趋势,导致铁的物理性质发生改变。
二、物质的变化物质的变化是指物质在一定条件下发生的转变过程。
根据变化类型可分为物理变化和化学变化。
1. 物理变化物理变化是指物质在经历变化后,其分子结构和化学组成没有发生改变的过程。
这种变化通常与物质的物理性质有关。
例如,当我们将固体冰加热时,它会逐渐熔化成液态水,但冰的分子结构和化学组成并没有改变,只是分子之间的排列方式发生了改变。
2. 化学变化化学变化是指物质在一定条件下,其分子结构和化学组成发生改变的过程。
这种变化通常伴随着能量的吸收或释放。
例如,当木材燃烧时,木材分子与氧气分子发生反应,产生二氧化碳和水蒸气,同时释放出大量热能。
这是一种化学变化,木材的化学组成发生了变化,形成了新的物质。
三、物质的性质与变化的关系物质的性质决定了其在变化过程中所表现出的特征和行为。
物质的性质决定了其对外界条件的响应,如温度、压力、环境等。
不同物质具有不同的物理性质和化学性质,因此它们在变化过程中会表现出不同的特点。
物质的变化是由其性质所引发的。
温度变化与物质性质的关系研究在我们日常生活中,温度变化是一个常见的现象。
无论是在夏天的炎热中还是冬天的寒冷中,我们都能感受到温度的变化。
而这种温度变化不仅仅影响着我们的舒适度,还对物质的性质产生着深远的影响。
本文将探讨温度变化与物质性质之间的关系。
首先,温度变化对物质的相变过程有着重要的影响。
相变是指物质在特定条件下由一种相转变为另一种相的过程。
常见的相变包括固态到液态的熔化、液态到气态的汽化以及气态到液态的凝结等。
而温度变化是导致相变的主要因素之一。
以水为例,当温度升高时,水从固态转变为液态,然后再转变为气态。
相反,当温度降低时,水从气态转变为液态,然后再转变为固态。
这种相变过程不仅仅是由于温度的变化,还与物质的性质密切相关。
其次,温度变化还会对物质的化学反应速率产生影响。
化学反应是指物质之间发生的化学变化。
温度是影响化学反应速率的重要因素之一。
根据化学动力学理论,温度升高会使化学反应速率加快,而温度降低则会使化学反应速率减慢。
这是因为温度的升高会增加物质分子的热运动速率,使得分子之间的碰撞频率增加,从而促进了反应的进行。
反之,温度的降低会减慢分子的热运动速率,使得分子之间的碰撞频率减少,从而减缓了反应的进行。
因此,温度变化对于化学反应的速率具有重要影响。
此外,温度变化还会对物质的电导率产生影响。
电导率是指物质导电能力的大小。
一般来说,温度升高会使物质的电导率增加,而温度降低则会使电导率减小。
这是因为温度的升高会增加物质中自由电子的热运动速率,从而增加了电子的碰撞频率,促进了电流的传导。
反之,温度的降低会减缓电子的热运动速率,减少了电子的碰撞频率,导致电流的传导减弱。
因此,温度变化对于物质的电导率具有显著影响。
最后,温度变化还会对物质的热膨胀性产生影响。
热膨胀性是指物质在温度变化下体积发生变化的性质。
一般来说,温度升高会使物质的体积增大,而温度降低则会使体积减小。
这是因为温度的升高会增加物质分子的热运动速率,使得分子之间的间距增大,从而导致物质的体积增大。
初中化学物质的变化和性质1.物质的变化:物理变化:没有生成其他物质的变化。
化学变化:生成了其他物质的变化。
化学变化和物理变化常常同时发生。
物质发生化学变化时一定伴随物理变化;而发生物理变化,不一定同时发生化学变化。
物质的三态变化(固、液、气)是物理变化。
物质发生物理变化时只是分子间的间隔发生变化,而分子本身没有发生变化;发生化学变化时,分子被破坏,分子本身发生变化。
化学变化的特征:生成了其他物质的变化。
2.物质的性质 (描述性质的语句中常有“能……”“可以……”等字)物理性质:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性。
化学性质:通过化学变化表现出的性质。
如还原性、氧化性、酸性、碱性、可燃性、热稳定性。
元素的化学性质跟原子的最外层电子数关系最密切。
原子的最外层电子数决定元素的化学性质。
(二)物质的分类金属单质混合物单质非金属单质稀有气体氧化物碱性氧化物质纯净物元素种类无机物酸其他氧化物碱化合物有机物盐3.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成)例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水),矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
4.纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4 ·5H2 O)都是纯净物冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
5.单质:由同种(或一种)元素组成的纯净物。
例如:铁氧气(液氧)、氢气、水银。
6.化合物:由不同种(两种或两种以上)元素组成的纯净物。
名称中有“某化某”“某酸某”的是化合物。
7.有机物(有机化合物):含碳元素的化合物(除CO、CO2和含碳酸根化合物外)无机物:不含碳元素的化合物以及CO、CO2和含碳酸根的化合物8.氧化物:由两种元素组成,其中一种是氧元素的化合物。
物质的性质及转化关系(一)物质的变化与性质的关系1.从物质变化的角度认识化学变化有新物质产生的变化叫作化学变化,又叫作化学反应。
所以同素异形体之间的转化都属于化学变化,如。
3O 2一定条件2O32.从化学键的角度认识化学变化化学变化的实质是旧化学键的断裂和新化学键的形成。
旧化学键的断裂和新化学键的形成是一个化学变化过程中的两个方面,仅有旧化学键的断裂,没有新化学键的形成不是化学变化,如NaCl固体熔化是物理变化。
3.熟记常见的物理变化与化学变化变化比较物理变化化学变化三馏①蒸馏②分馏干馏四色焰色反应①显色反应②颜色反应③指示剂变色反应五解潮解①分解②电解③水解④裂解十四化①熔化②汽化③液化④升化①氧化②风化③钝化④皂化⑤硝化⑥酯化⑦裂化⑧油脂的硬化⑨煤的液化⑩煤的气化(二)常见物质的转化1.化学反应的分类化学反应⎩⎪⎪⎪⎪⎨⎪⎪⎪⎪⎧按反应物、生成物种类及数目多少分为⎩⎪⎨⎪⎧化合反应分解反应置换反应复分解反应按反应中有无离子参与分为⎩⎪⎨⎪⎧ 离子反应非离子反应按反应中有无电子转移分为⎩⎪⎨⎪⎧ 氧化还原反应非氧化还原反应按反应进行的程度和方向分为⎩⎪⎨⎪⎧ 可逆反应不可逆反应按反应的能量变化分为⎩⎪⎨⎪⎧吸热反应放热反应2.酸、碱、盐、氧化物和单质之间的转化(1)强酸制弱酸:如实验室制CO 2和SO 2,其离子方程式分别为CaCO 3+2H +===Ca 2++CO 2↑+H 2O 和SO 2-3+2H +===SO 2↑+H 2O 。
(2)强碱制弱碱:如制NH 3,NH 4Cl +NaOH=====△NaCl +NH 3↑+H 2O 。
(3)易溶物转化为难溶物:如AgNO 3+NaCl===AgCl ↓+NaNO 3。
(4)难溶物转化为更难溶物:如3Mg(OH)2+2FeCl 3===3MgCl 2+2Fe(OH)3。
(5)难挥发物转化为易挥发物:如 NaCl +H 2SO 4(浓)=====△HCl ↑+NaHSO 4。
化学物质的物理性质与化学性质的变化规律化学是研究物质的性质、组成和变化的科学。
化学物质既具有物理性质,也具有化学性质。
在研究化学物质性质的过程中,我们常常关注它们的物理性质和化学性质,以及它们的变化规律。
本文将探讨化学物质的物理性质与化学性质的变化规律。
一、化学物质的物理性质化学物质的物理性质是指那些能够通过观察和测量而不改变物质本身化学成分的性质。
物理性质是可以用物理量来描述的,比如颜色、形状、质量、密度、熔点、沸点等。
下面我们以水为例,来说明物理性质的变化规律。
1. 颜色:水的颜色通常是无色的。
2. 形状:在常温下,水以液体的形式存在,没有固定的形状。
3. 质量:水的质量取决于其分子的数量,质量越大,分子越多。
4. 密度:水的密度是一个物理属性,可以用质量除以体积得到。
5. 熔点:水的熔点是0摄氏度,低于0摄氏度时水会凝固,形成冰。
6. 沸点:水的沸点是100摄氏度,在达到100摄氏度时水开始变为蒸汽。
以上示例表明,物理性质是可以通过观察和测量获得的,其变化规律也是确定的。
二、化学物质的化学性质化学物质的化学性质是指物质发生化学反应时表现出来的性质。
化学性质通常需要通过改变物质的组成或结构来观察和测量。
化学性质可以通过物质与其他物质发生反应的结果来描述,比如氧化、还原、酸碱中和等。
以下是一些关于水的化学性质的例子。
1. 氧化性:水可以被氧化剂氧气氧化为氢气和氧气。
2. 还原性:水可以还原一些物质,比如还原金属离子成为金属。
3. 酸碱性:水可以发生酸碱中和反应,与酸反应产生盐和水,与碱反应产生盐和水。
4. 水解性:水可以对一些物质进行水解反应,将其分解为更简单的物质。
化学性质是在物质之间发生化学反应时才会显现出来的,其变化规律与反应类型和条件密切相关。
三、物理性质与化学性质的变化规律物理性质和化学性质是化学物质的两个重要方面,它们之间有着密切的联系和互相影响。
物理性质的变化通常不会改变物质的化学成分,而化学性质的变化则会导致物质的化学变化。