二氧化碳的制取和收集装置
- 格式:ppt
- 大小:178.50 KB
- 文档页数:3

二氧化碳的制取和收集装置
1:原理利用碳酸钙和盐酸的反应。
2:药品用大理石或者石灰石与稀盐酸反应。
药品选用有几个需要注意的问题
不能用浓盐酸代替稀盐酸,因为浓盐酸也有挥发性,会使制得的二氧化碳不纯,还有氯化氢气体杂质。
不能用稀硫酸代替稀盐酸,因为硫酸与碳酸钙反应生成的硫酸钙微溶于水,会覆盖在大理石表面,阻止反应的进行。
不能用碳酸钠代替大理石或者石灰石,因为反应速率太快,不容易收集。
3:装置的选择,实验室制取的发生装置和收集装置在制取氧气是已详细说明了。
实验室制取二氧化碳的发生装置用固液常温,收集装置用排空气法,不能用排水法。
如果用多功能瓶,应该长进短出。
4:操作步骤:连接仪器—检查装置气密性—加入药品—收集气体
5:验满:用燃着的木条放在集气瓶口,若木条熄灭,则说明已收集满。
6:检验:把生成的气体通入澄清石灰水中,若澄清石灰水变混浊,则说明该气体是二氧化碳。
7:经常会出现说制取一瓶纯净和干燥的二氧化碳,是提示你需要除杂和干燥,先除杂后干燥。
制取二氧化碳中,含有的气体杂质一般是氯化氢,常用饱和的碳酸氢钠溶液除去,然后用浓硫酸干燥。


《二氧化碳的实验室制取与性质》讲义一、二氧化碳的性质在了解二氧化碳的制取方法之前,我们先来认识一下二氧化碳的性质。
二氧化碳是一种无色、无味的气体。
在通常状况下,它的密度比空气大,能溶于水,在一定条件下还能与水反应生成碳酸。
二氧化碳不能燃烧,也不支持燃烧。
这一性质使得它在灭火方面有着广泛的应用。
此外,二氧化碳还是一种重要的温室气体,对地球的气候有着重要的影响。
二、实验室制取二氧化碳的原理实验室制取二氧化碳通常使用大理石(或石灰石)与稀盐酸反应。
化学方程式为:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑选择大理石(或石灰石)与稀盐酸反应制取二氧化碳,主要是因为该反应速率适中,便于控制,且原料易得。
三、实验装置1、发生装置实验室制取二氧化碳的发生装置通常采用“固液不加热型”。
这是因为反应不需要加热,且大理石(或石灰石)是固体,稀盐酸是液体。
常见的发生装置有以下几种:(1)简易装置:由长颈漏斗、锥形瓶和双孔橡皮塞组成。
长颈漏斗的下端要伸入液面以下,以防止生成的气体从长颈漏斗逸出。
(2)启普发生器:这是一种能控制反应随时发生和停止的装置。
当打开导气管上的活塞时,酸液与固体接触,反应发生;当关闭活塞时,产生的气体使容器内压强增大,将酸液压回长颈漏斗,使酸液与固体脱离接触,反应停止。
2、收集装置由于二氧化碳的密度比空气大,且能溶于水,所以通常采用向上排空气法收集二氧化碳。
收集装置一般由集气瓶和玻璃片组成。
收集时,导气管要伸到集气瓶的底部,以保证收集到的二氧化碳较为纯净。
四、实验步骤1、检查装置的气密性在装入药品之前,首先要检查装置的气密性。
方法是:连接好装置,将导管的一端放入水中,然后用手握住锥形瓶,若导管口有气泡冒出,松开手后,导管内形成一段水柱,则说明装置气密性良好。
2、装入药品先在锥形瓶中放入适量的大理石(或石灰石),然后通过长颈漏斗或分液漏斗向锥形瓶中加入稀盐酸。
3、收集气体用向上排空气法收集二氧化碳。


《二氧化碳的实验室制取与性质》讲义一、二氧化碳的性质在我们深入了解二氧化碳的实验室制取方法之前,先来认识一下二氧化碳的性质。
二氧化碳是一种无色、无味的气体。
它的密度比空气大,所以在实验中,我们常常能看到二氧化碳会像“瀑布”一样向下倾倒。
二氧化碳能溶于水,通常情况下,一体积水大约能溶解一体积的二氧化碳。
溶解在水中的二氧化碳会部分与水发生反应,生成碳酸。
这也是为什么我们将二氧化碳通入紫色石蕊试液中,试液会变红的原因。
二氧化碳不可燃烧,一般也不支持燃烧。
这一性质在灭火中有着重要的应用。
二、二氧化碳的实验室制取(一)实验药品实验室制取二氧化碳通常使用大理石(或石灰石)与稀盐酸反应。
大理石和石灰石的主要成分都是碳酸钙(CaCO₃),稀盐酸的溶质是氯化氢(HCl)。
(二)反应原理碳酸钙与稀盐酸反应的化学方程式为:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑(三)实验装置制取二氧化碳的实验装置包括发生装置和收集装置两部分。
1、发生装置由于反应物是固体和液体,且反应不需要加热,所以我们选择“固液不加热型”发生装置。
常见的有以下两种:(1)简易装置:用长颈漏斗和锥形瓶组成。
长颈漏斗的下端要伸入液面以下,形成液封,防止气体从长颈漏斗逸出。
(2)启普发生器:它能随时控制反应的发生和停止。
2、收集装置因为二氧化碳的密度比空气大,且能溶于水,所以我们采用向上排空气法收集二氧化碳。
收集装置通常由集气瓶和导管组成。
导管要伸到集气瓶的底部,以便将瓶内的空气排尽,收集到更纯净的二氧化碳。
(四)实验步骤1、检查装置的气密性在装入药品之前,我们要先检查装置的气密性。
方法是:连接好装置,将导管的一端放入水中,然后用手紧握容器外壁,如果导管口有气泡冒出,松开手后导管内形成一段水柱,说明装置的气密性良好。
2、装入药品先向锥形瓶(或反应容器)中加入大理石(或石灰石),然后通过长颈漏斗(或其他添加仪器)慢慢加入稀盐酸。
3、收集气体用向上排空气法收集二氧化碳。
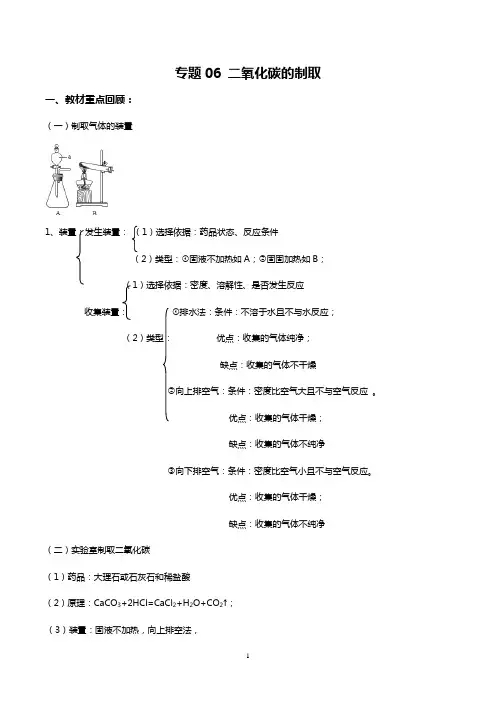
专题06 二氧化碳的制取一、教材重点回顾:(一)制取气体的装置1、装置:发生装置:(1)选择依据:药品状态、反应条件(2)类型:①固液不加热如A;②固固加热如B;(1)选择依据:密度、溶解性、是否发生反应收集装置:①排水法:条件:不溶于水且不与水反应;(2)类型:优点:收集的气体纯净;缺点:收集的气体不干燥②向上排空气:条件:密度比空气大且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净③向下排空气:条件:密度比空气小且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净(二)实验室制取二氧化碳(1)药品:大理石或石灰石和稀盐酸(2)原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)装置:固液不加热,向上排空法,(4)步骤:①连接装置;②检查装置的气密性;③向锥形瓶中加入大理石;④从长颈漏斗加入稀盐酸;⑤收集二氧化碳;⑥验满。
(5)收集法:向上排空气法:原因密度比空气大且不与空气反应;能溶于水,不能用排水法。
(6)验满:向上排空气法,用燃着的木条放在,瓶口,木条熄灭则收集满。
(7)检验:将气体通入澄清石灰水,若石灰水浑浊,则是二氧化碳。
原理:Ca(OH)2+CO2 =CaCO3↓+H2O(8)注意事项:①长颈漏斗的下端要伸到液面以下(防止产生的气体从长颈漏斗口逸出);②锥形瓶中的导管只能刚刚露出橡皮塞(有利于产生的气体排出);③集气瓶中的导管口要接近集气瓶底(目的:便于排净空气)。
(9)药品的选择:①实验室制取二氧化碳不能用稀硫酸和大理石反应是因为(稀硫酸和大理石反应生成的硫酸钙微溶于水,会附着在大理石表面,阻碍反应的继续发生)。
②也不用浓盐酸是因为(浓盐酸易挥发,使制得的二氧化碳中混有氯化氢气体而不纯)。
二、中考考点梳理二氧化碳的制取,是每年中考的必考内容之一,考查的知识点包括制取二氧化碳的装置、药品、原理、步骤、收集、验满、检验、注意事项等;以实验探究题为主。
也有少量选择题。

实验室制取二氧化碳一、实验目的1、使学生初步掌握实验室制取二氧化碳的药品、原理、实验装置、收集方法等。
2、进一步培养学生的观察能力和思维能力。
3、渗透物质的性质决定制法的思想方法。
二、反应原理CaCO3+2HCl=CaCl2+H2O+CO2↑三、仪器装置(如下图所示)四、实验步骤“查”:检查装置的气密性。
“装”:从锥形瓶口装大理石,塞紧塞子。
“加”:从长颈漏斗(或分液漏斗)加入稀盐酸。
“收”:收集气体。
“验满”:用燃着的木条放在集气瓶口,木条熄灭证明已收集满。
五、收集方法用向上排空气法收集二氧化碳(因为二氧化碳密度比空气大)。
不能用排水法收集二氧化碳(因为二氧化碳溶于水)。
六、注意事项装置注意事项:发生装置的导管露出塞子即可,不能伸入过长;长颈漏斗下端要伸入液面以下。
操作注意事项:用向上排空气法收集二氧化碳时导管要伸入集气瓶底部。
七、实验室制取二氧化碳析疑(一)为什么选用大理石或石灰石制取二氧化碳?答:大理石或石灰石的主要成分是碳酸钙。
碳酸盐跟酸起反应,一般都有二氧化碳生成。
若选用可溶性的碳酸盐(如碳酸钠等),与酸反应速度过快,难以控制;若选用不溶性碳酸盐(如碳酸镁等),则其来源一般较少。
大理石或石灰石与酸反应适中,其在自然界中含量也极其丰富,价格低廉。
所以,选用大理石或石灰石制二氧化碳。
(二)实验室制取二氧化碳时,为什么最好选用稀盐酸?答:如果用稀硫酸和大理石或石灰石反应,有关化学方程式为:CaCO3+H2SO4=CaSO4+H2O+CO2↑,结果生成微溶性固体硫酸钙,它覆盖在大理石或石灰石表面,使酸与大理石或石灰石脱离接触,导致反应太缓慢。
如果用硝酸与大理石或石灰石反应,由于硝酸是一种不稳定性的酸,在见光或受热时易分解:4HNO3光照4NO2↑+O2↑+2H2O,从而使制得的CO2中混有NO2和O2等杂质。
如果用浓盐酸和大理石或石灰石反应,由于浓盐酸具有挥发性,使制得的CO2中混有较多的氯化氢气体。

专题05 二氧化碳的制取考点扫描☆聚焦中考二氧化碳的制取,是每年中考的必考内容之一,考查的知识点包括制取二氧化碳的装置、药品、原理、步骤、收集、验满、检验、注意事项等;以实验探究题为主。
也有少量选择题。
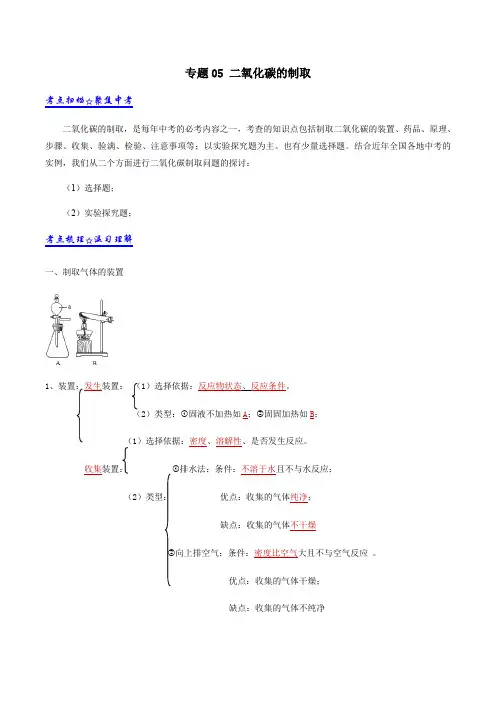
结合近年全国各地中考的实例,我们从二个方面进行二氧化碳制取问题的探讨:(1)选择题;(2)实验探究题;考点梳理☆温习理解一、制取气体的装置1(1)选择依据:反应物状态、反应条件。
(2)类型:①固液不加热如A;②固固加热如B;(1)选择依据:密度、溶解性、是否发生反应。
收集装置:①排水法:条件:不溶于水且不与水反应;(2)类型:优点:收集的气体纯净;缺点:收集的气体不干燥②向上排空气:条件:密度比空气大且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净向下排空气:条件:密度比空气小且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净二、实验室制取二氧化碳(1)药品:大理石或石灰石和稀盐酸;(2)原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)装置:固液不加热,向上排空法,(4)步骤:①连接装置;②检查装置的气密性;③向锥形瓶中加入大理石;④从长颈漏斗加入稀盐酸;⑤收集二氧化碳;⑥验满。
(5)收集法:向上排空气法:原因密度比空气大且不与空气反应;能溶于水,不能用排水法。
(6)验满:向上排空气法,用燃着的木条放在,瓶口,木条熄灭则收集满。
(7)检验:将气体通入澄清石灰水,若石灰水浑浊,则是二氧化碳。
原理:Ca(OH)2+CO2 =CaCO3↓+H2O;(8)注意事项:①长颈漏斗的下端要伸到液面以下(防止产生的气体从长颈漏斗口逸出);②锥形瓶中的导管只能刚刚露出橡皮塞(有利于产生的气体排出);③集气瓶中的导管口要接近集气瓶底(目的:便于排净空气)。
(9)药品的选择:①实验室制取二氧化碳不能用稀硫酸和大理石反应是因为(稀硫酸和大理石反应生成的硫酸钙微溶于水,会附着在大理石表面,阻碍反应的继续发生)。

气体发生装置反应物的状态固体和固体反应固体和液体反应液体和液体反应…反应条件是否需要加热、加催化剂等⎧⎨⎪⎪⎩⎪⎪⎧⎨⎪⎪⎪⎩⎪⎪⎪()气体收集装置排空气法密度比空气的大——向上排气法密度比空气的小——向下排气法排水法不易溶于水、不与水发生反应⎧⎨⎪⎩⎪⎧⎨⎪⎪⎩⎪⎪()第六单元 二氧化碳的制取【目标导读】一.室验室制取CO 2的药品,反应原理的探究。
实验室用什么药品来制取CO 2?制取时有什么现象发生? 做如下几个实验: 1. 稀盐酸与大理石反应: 有气泡产生,原理:2. 稀硫酸和大理石反应: 刚有气泡,马上又停止。
分析:生成微溶物,覆盖在大理石或石灰石表面,阻止反应继续进行,不宜采用。
3. 用稀盐酸与碳酸钠反应立即有大量气泡产生,速度很快。
分析:速度太快,来不及收集,不宜采用。
结论:实验室制取CO 2的药品:大理石或石灰石与稀盐酸反应原理:二.实验室制取CO 2装置的探究: 1. 实验室里制取气体的装置的确定。
实验室里制取CO 2的装置包括两部分:发生装置和收集装置。
确定气体发生装置和收集装置时应考虑的因素。
CaCO HCl CaCl CO H O 32222+=+↑+CaCO H SO CaSO CO H O 324422+=↓+↑+CaSO 4Na CO HCl NaCl CO H O 232222+=+↑+CaCO HCl CaCl CO H O 32222+=+↑+2. 二氧化碳和氧气制取实验及相关性质比较反应物的状态反应条件气体密度比空气的大或小是否与水反应二氧化碳固体+液体常温大反应氧气固体、或固体+液体加热或常温略大不反应结论:CO2的发生装置不需要加热,CO2的收集不能用排水法。
3. 通过讨论,设计一套最佳装置来制取CO2以下仪器可供设计制取二氧化碳的装置时选择,你也可以另选或自制仪器,还可以利用代用品。
设计气体制备的装置要本着安全、简便、易控的原则。
实验室制取CO2可以用以下装置,或其他正确装置。
实验室制取二氧化碳收集装置一、什么是二氧化碳?大家好,今天我们来聊聊实验室怎么制取二氧化碳,并且顺便收集起来。
其实二氧化碳这个东西啊,离我们并不远,呼吸的时候我们就能排放出来,植物又能吸收它。
这种气体虽然咱们看不见摸不着,但却无处不在,比如我们喝的碳酸饮料里面,那咕嘟咕嘟的气泡就是二氧化碳。
而在实验室里,制取二氧化碳的方式有很多,今天我们就一块儿来看看最常见的一种,顺便讲讲怎么收集这个“隐形的气体”!嗯,感觉有点像侦探破案,收集线索的那种感觉。
二、制取二氧化碳的原理这就得从化学反应说起了,别担心,听我慢慢说,绝对不会让你头疼。
我们常见的一种方法,就是让石灰石(主要成分是碳酸钙)和盐酸发生反应,反应生成的二氧化碳就会冒出来。
大家肯定也知道,盐酸和石灰石这两种东西放到一起,反应可是非常激烈的!盐酸把石灰石搞得一团糟,二氧化碳气体就溜溜溜地冒出来,咕噜咕噜,往上冲。
看着这一切,你会发现,原来化学反应有时候也挺神奇的。
还记得小时候做实验,看到气泡不断产生的那种感觉吗?那真是美妙啊!反应式挺简单的:CaCO3+2HCltoCaCl2+H2O+CO2看!就是这么简单,碳酸钙和盐酸碰到一起,生成氯化钙、水和二氧化碳。
而二氧化碳呢,就从反应瓶里冒出来,进入下一步的“收集”环节。
三、二氧化碳的收集现在,二氧化碳产生了,问题来了,怎么把这个气体收集起来?好像想把空气抓住一样,听起来有点难,但其实挺简单的!其实咱们常用的方法就是“水置换法”。
说白了就是把一个盛满水的容器倒扣,把二氧化碳气体通过管道引到这个容器下面。
二氧化碳会慢慢地替换掉水,最后这个气体就被收集到了容器里。
有点小窍门,水置换法之所以好用,是因为二氧化碳不溶于水,气体在水面上方不容易溶解进去,这就给我们提供了一个机会,能把气体给“藏”起来。
所以,大家如果去实验室做这个实验,一定要小心操作,不然水一溅出来,那就麻烦了。
再有,别忘了使用干净的管子和设备,管道堵了可就麻烦了。