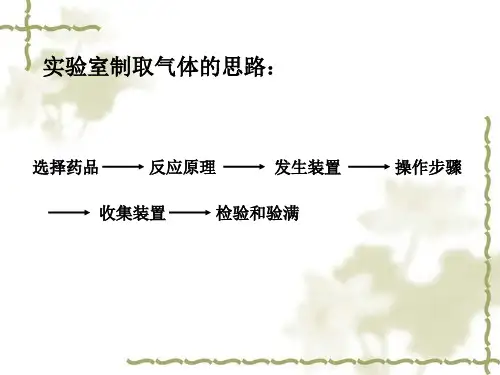
探究实验室制取二氧化碳的装置
- 格式:ppt
- 大小:1.06 MB
- 文档页数:17



制取二氧化碳的实验装置
制取二氧化碳的实验装置通常包括以下组成部分:
1. 原料氧化装置:通常使用碳酸钙(石灰石)作为原料,在反应容器中加热石灰石,将其分解为氧化钙和二氧化碳。
2. 反应容器:用于容纳原料和反应产物的容器,通常使用玻璃容器或不锈钢容器。
3. 加热装置:用于加热原料和反应容器,通常使用电炉或燃气炉进行加热。
4. 冷凝装置:用于将反应产生的二氧化碳气体冷凝成液体,通常使用冷却水制冷的冷凝管或冷凝器。
5. 气体收集装置:用于收集并测量制得的二氧化碳气体,常用的方法有置换法(收集在反应容器中,顶部装有水或液体)和排空法(通过水柱排空,以测量排出的二氧化碳体积)。
6. 测量仪器:用于测量二氧化碳气体的体积或质量,常用的测量仪器有气体密度计、气体吸收器和天平等。
以上是制取二氧化碳的主要实验装置,但实际操作过程中还需要注意安全问题,如防止二氧化碳泄漏和避免高温炉或火源的危险等。
在进行实验时,应根据具体需求选择适当的装置和操作方法。

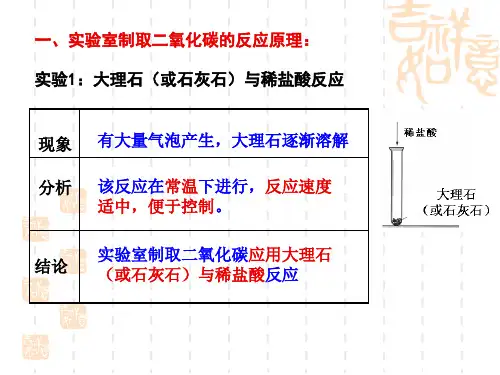


一、二氧化碳气体的实验室制法 (1)实验原理实验室里用大理石(或石灰石)跟稀盐酸反应制取二氧化碳气体↑++→+22232CO O H CaCl HCl CaCO(2)实验发生装置特殊装置构造:由试管,多孔塑料板、长颈漏斗、弹簧夹或活塞组成。
工作原理:使用时,打开橡皮管上的弹簧夹,稀盐酸从长颈漏斗流下,浸没大理石,大理石跟稀盐酸发生反应,二氧化碳气体从试管上部的导管导出。
如果将弹簧夹夹紧橡皮导管,试管内二氧化碳气体的压强增大,稀盐酸被压回长颈漏斗,大理石和稀盐酸脱离接触,反应也就自行停止了。
作用:可以控制反应的发生,随时关闭,随时开启。
普通装置:不能控制反应的发生。
【注意事项】:1、检漏:检查装置的气密性2、用块状大理石而不是粉末状:粉末状反应速率太快,来不及收集反应就已经结束3、用盐酸而不是硫酸:硫酸与碳酸钙反应产生的硫酸钙是一种粘稠性固体,附着在碳酸钙表面阻止反应的进行。
二氧化碳的实验室制备4、用稀盐酸而不是浓盐酸:浓盐酸极易挥发,具有强烈的腐蚀性。
(3)收集装置收集气体问题要考虑两点:、【搭建合适装置】在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。
应选用的仪器是(填入仪器的编号)。
[分析]题设要求设计能随开随用、随关随停的气体发生装置,显然与启普发生器的原理是相同的。
设计的关键在于当我们需要反应停止时,关闭导气管开关,产生的气体能将液体压回容器中从而与固体分开,反应停止。
装置如下图:根据特殊装置的工作原理,我们还可设计其他一些形式的启普发生器原理式反应装置,如由上两个图所示。
图Ⅱ1、现在有下列实验仪器:①大试管 ②烧杯 ③酒精灯 ④集气瓶 ⑤长颈漏斗 ⑥带导管的双孔橡皮塞 ⑦导气管 ⑧玻璃片 ⑨铁架台 ⑩水槽等仪器,在实验制取CO2时,应选用的仪器有 (填序号)。
2、实验室制取二氧化碳有以下几个步骤,正确的操作顺序的________________。

制取二氧化碳的化学方程式及装置
制取二氧化碳通常使用碳酸钙(石灰石或大理石)与稀盐酸反应的方法。
该反应的化学方程式如下:CaCO3 + 2HCl=CaCl2 + H2O +CO2
实验装置通常包括以下几个部分:
1. 反应瓶:装有碳酸钙固体的容器,可以是圆底烧瓶。
2. 分液管或橡胶塞:带有孔的橡胶塞,用于连接导管和引入稀盐酸。
3. 导管:将产生的二氧化碳气体从反应瓶中导出。
4. 收集瓶:用来收集二氧化碳气体,通常放置在水槽中,以水封的方式收集。
5. 水槽:装有水,用来为收集瓶提供水封,防止二氧化碳气体逸出。
实验步骤如下:
1. 将一定量的碳酸钙放入反应瓶中。
2. 使用带有孔的橡胶塞将分液管或导管密封好,并将其引入反应瓶内。
3. 通过分液管向反应瓶中缓慢加入稀盐酸,开始反应。
4. 二氧化碳气体会通过导管进入到倒置在水槽中的收
集瓶中,由于二氧化碳比空气重,它会从底部进入,排出收集瓶内的空气,从而实现收集。
需要注意的是,反应过程中应缓慢加入稀盐酸,以控制反应速率,避免过猛的反应导致溶液喷出或压力过大。
同时,二氧化碳是一种无色无味的气体,在实验室操作时应采取适当的安全措施,如佩戴防护眼镜和手套,确保通风良好。

二氧化碳制取的装置
二氧化碳制取装置
原理
二氧化碳制取装置的工作原理是利用化学反应来释放二氧化碳。
最常用的反应是:
碳酸氢钠(小苏打)与盐酸反应生成二氧化碳、氯化钠和水:
NaHCO3 + HCl → CO2 + NaCl + H2O
装置
二氧化碳制取装置通常由以下部分组成:
反应瓶:用于盛放反应物(碳酸氢钠和盐酸)。
滴液漏斗:用于缓慢滴入盐酸,控制反应速率。
导管:用于将反应产生的二氧化碳输送到收集瓶中。
收集瓶:用于收集生成的气体。
安全装置:如单向阀或气球,以防止气体回流。
步骤
二氧化碳制取的步骤如下:
在反应瓶中加入一定量的碳酸氢钠(小苏打)。
在滴液漏斗中加入盐酸,并调节流速至合适的速度(通常为几滴每秒)。
打开安全装置,确保气体能够顺利排出。
缓慢地将盐酸滴入反应瓶中,观察二氧化碳气泡的产生。
当收集瓶中收集到足够的气体时,关闭安全装置。
注意事项
使用二氧化碳制取装置时,需要遵循以下注意事项:
实验过程中,应始终佩戴防护手套和护目镜。
使用适当浓度的盐酸。
过高浓度的盐酸可能会产生过量的热量或有毒气体。
控制反应速率,避免产生过多的气体和产生过大的压力。
定期检查安全装置,确保其正常工作。
不要将收集到的二氧化碳吸入体内。
应用
二氧化碳制取装置在各个领域有着广泛的应用,包括:
教育和研究,展示二氧化碳的产生和性质。
食品工业,用于碳酸饮料的生产。
医疗行业,用于灭火器和气腹镜手术。
环境保护,用于中和废气中的酸性物质。
专题05 二氧化碳的制取考点扫描☆聚焦中考二氧化碳的制取,是每年中考的必考内容之一,考查的知识点包括制取二氧化碳的装置、药品、原理、步骤、收集、验满、检验、注意事项等;以实验探究题为主。
也有少量选择题。
结合近年全国各地中考的实例,我们从二个方面进行二氧化碳制取问题的探讨:(1)选择题;(2)实验探究题;考点梳理☆温习理解一、制取气体的装置1(1)选择依据:反应物状态、反应条件。
(2)类型:①固液不加热如A;②固固加热如B;(1)选择依据:密度、溶解性、是否发生反应。
收集装置:①排水法:条件:不溶于水且不与水反应;(2)类型:优点:收集的气体纯净;缺点:收集的气体不干燥②向上排空气:条件:密度比空气大且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净向下排空气:条件:密度比空气小且不与空气反应。
优点:收集的气体干燥;缺点:收集的气体不纯净二、实验室制取二氧化碳(1)药品:大理石或石灰石和稀盐酸;(2)原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)装置:固液不加热,向上排空法,(4)步骤:①连接装置;②检查装置的气密性;③向锥形瓶中加入大理石;④从长颈漏斗加入稀盐酸;⑤收集二氧化碳;⑥验满。
(5)收集法:向上排空气法:原因密度比空气大且不与空气反应;能溶于水,不能用排水法。
(6)验满:向上排空气法,用燃着的木条放在,瓶口,木条熄灭则收集满。
(7)检验:将气体通入澄清石灰水,若石灰水浑浊,则是二氧化碳。
原理:Ca(OH)2+CO2 =CaCO3↓+H2O;(8)注意事项:①长颈漏斗的下端要伸到液面以下(防止产生的气体从长颈漏斗口逸出);②锥形瓶中的导管只能刚刚露出橡皮塞(有利于产生的气体排出);③集气瓶中的导管口要接近集气瓶底(目的:便于排净空气)。
(9)药品的选择:①实验室制取二氧化碳不能用稀硫酸和大理石反应是因为(稀硫酸和大理石反应生成的硫酸钙微溶于水,会附着在大理石表面,阻碍反应的继续发生)。
制取氧气二氧化碳氢气的装置
实验室制取氧气、二氧化碳和氢气的装置主要有以下几种:
1. 制取氧气:
- 装置:酒精灯、铁架台、硬质玻璃试管、水槽、导管、橡胶塞(用于气体的接受装置)
- 反应原理:氯酸钾在二氧化锰催化下加热分解,或高锰酸钾直接加热分解
2. 制取氢气:
- 装置:启普发生器
- 反应原理:锌与稀硫酸反应
3. 制取二氧化碳:
- 装置:启普发生器
- 反应原理:大理石与稀盐酸反应
这些装置都是用于实验室中制取氧气、二氧化碳和氢气的方法。
在操作时,请务必遵守安全规程,确保实验过程顺利进行。
在收集气体时,可以使用排水集气法或向上排空气法,根据气体的密度选择合适的收集方法。
实验室制取二氧化碳的仪器
反应仪器:长颈漏斗,锥形瓶,导管,集气瓶。
长颈漏斗是漏斗的一种,主要用于固体和液体在锥形瓶中反应时随时添加液体药品。
一般还可以用分液漏斗替代。
锥形瓶一种化学实验室常见的玻璃仪器,由德国化学家理查·鄂伦麦尔于1861年发明。
锥形瓶一般使用于滴定实验中。
为了防止滴定液下滴时会溅出瓶外,造成实验的误差,再将瓶子放在磁搅拌器上搅拌。
气体导管导管泛指做疏导用的管子。
工业用导管是灌注导管,气体导管用于气体输送装置。
空气采样装置的气体导管,必须选用无化学活性的惰性材料制成,外部包以绝热材料。
导管连接应严密,并定期清洗。
集气瓶:一种广口玻璃容器,瓶口平面磨砂,能跟毛玻璃保持严密接触,不易漏气。
用于收集气体、装配洗气瓶和进行物质跟气体之间的反应。
实验室制取二氧化碳的原理
1、实验室制取二氧化碳,用大理石或石灰石与稀盐酸反应,它们的主要成分为碳酸钙,生成物有氯化钙、水和二氧化碳;
2、二氧化碳能溶于水,与水反应生成碳酸,不能用排水法收集,由于密度比空气大,可用向上排空气法收集;
3、检验二氧化碳时,利用二氧化碳与氢氧化钙反应生成碳酸钙沉淀的性质,方法是把制取的气体通入澄清的石灰水,如石灰水变浑,则气体是二氧化碳。
化学实验室制取二氧化碳的装置和方法
化学实验室中,可以使用以下装置和方法制取二氧化碳:
装置:
1. 烧石灰管装置:使用石灰石(氢氧化钙)作为反应原料,通过热分解制取二氧化碳。
装置主要包括加热器、烧石灰管、冷凝器和收集瓶等部分。
2. 马尔托夫瓶装置:使用醋酸和小苏打(碳酸氢钠)发生反应,产生二氧化碳。
装置主要包括马尔托夫瓶、玻璃漏斗、橡胶塞、导管和收集瓶等部分。
方法:
1. 热分解法:通过将石灰石(氢氧化钙)加热至高温,分解产生氧化钙和二氧化碳的混合物,然后通过冷凝器将二氧化碳液化,最终收集到容器中。
2. 醋酸和碳酸氢钠反应法:将适量的醋酸和小苏打(碳酸氢钠)混合加入马尔托夫瓶中,通过导管将产生的二氧化碳气体导入收集瓶中。
需要注意的是,在进行二氧化碳的制备实验时,要注意安全操作,确保实验环境通风良好,避免二氧化碳的过量积聚造成危
险。
另外,对于液态二氧化碳的收集和储存,需要采取相应的安全措施。
实验室制取二氧化碳及探究二氧化碳化学实验报告一、用稀盐酸和石灰石制取二氧化碳实验器材:大试管、单孔橡皮塞、带胶皮的导管、集气瓶、水槽、铁架台附铁夹、矿泉水瓶实验药品:稀盐酸、石灰石(碳酸钙)实验步骤:1.按照要求将实验室制取二氧化碳的简单装置组装好;2.将导管通入水槽,检查装置的气密性;3.在试管中用药匙装入少量石灰石,并倒入适量稀盐酸,体积不超过试管容积的三分之一;4.塞上橡皮塞,将导管通入集气瓶中,使用向上排空气法收集二氧化碳,一段时间后取出导管,用毛玻璃盖住瓶口,共收集两集气瓶及一矿泉水瓶二氧化碳;5.将点燃的木条放在集气瓶口,木条熄灭,说明二氧化碳已经收集满。
实验原理:二、验证二氧化碳的物理性质实验器材:烧杯、阶梯蜡烛实验药品:收集到的一集气瓶二氧化碳实验步骤:1.用火柴引燃放在烧杯中的阶梯式蜡烛;2.将集气瓶口的毛玻璃移开,顺着烧杯口将集气瓶倾斜,使二氧化碳气体进入烧杯。
实验现象:第一次实验时,上面的蜡烛先熄灭,下面的蜡烛后熄灭;第二次实验时,下面的蜡烛先熄灭,上面的蜡烛后熄灭。
现象分析:由于第一次从烧杯有蜡烛的一面倾倒二氧化碳气体,所以上面的蜡烛先熄灭,下面的蜡烛后熄灭;第二次实验时从烧杯没有蜡烛的一面倾倒二氧化碳气体,由于二氧化碳的密度比空气大,故二氧化碳沉入烧杯底部,下方的蜡烛先熄灭。
实验结论:1.二氧化碳一般不支持燃烧;2.二氧化碳的密度比空气大。
三、验证二氧化碳的化学性质(1)实验药品:收集到的一矿泉水瓶二氧化碳、足量水实验步骤:1.将矿泉水瓶瓶口打开,迅速倒入适量的水,然后迅速盖上瓶盖;2.拿住瓶盖进行震荡并观察。
实验现象:二氧化碳气体和水反应,生成一种极不稳定的液体,此液体很快又重新分解成气体和无色的液体。
实验猜想:生成的液体有可能是碳酸,而碳酸由于不稳定又会分解成水和二氧化碳。
实验结论:二氧化碳能和水反应生成碳酸,反应的化学方程式为:CO2+H2O =H2CO3而碳酸又会重新分解成水和二氧化碳,反应的化学方程式为:H2CO3= CO2↑+H2O四、实验小结:这次的实验要在有限的时间内完成多个实验,不过由于昨天做过收集二氧化碳的实验,所以整个过程还算顺利。